Introducción
La función tiroidea de la mujer embarazada muestra cambios importantes por varios mecanismos fisiológicos. Al inicio del embarazo, la tiroides se estimula por la gonadotropina coriónica humana (hCG) que, al tener homología estructural con la tirotropina, puede unirse al receptor tiroideo e inhibir su secreción por la hipófisis.1 Además, los altos niveles de estrógenos circulantes estimulan la síntesis y disminuyen el catabolismo de la globulina fijadora de tiroxina, con lo cual se duplican o triplican los valores previos a la gestación y aumentan las hormonas tiroideas totales en sangre.2) A esto se suma la intensa actividad de la desyodasa placentaria, que condiciona el aumento del catabolismo de la tiroxina (T4) y la triyodotironina (T3).2,3
El aumento en los niveles de tirotropina se reporta en alrededor del 2 % de las gestantes que viven en zonas con suficiencia de yodo.2,4,5 El hipotiroidismo primario manifiesto se confirma ante concentraciones de tirotropina por encima del rango de referencia específico para cada trimestre del embarazo y una T4 disminuida. El hipotiroidismo subclínico, por su parte, se diagnostica con una tirotropina superior al intervalo de referencia y una T4 normal. Su prevalencia varía según la población y los puntos de corte empleados.4) La hipotiroxinemia aislada se plantea ante una gestante con tirotropina normal y la T4 por debajo del 2,5 o el 5 percentil.3,4,5
Alrededor del 0,2 % de las embarazadas puede presentar un hipertiroidismo manifiesto y el 2,5 % un hipertiroidismo subclínico.3,4,5 El hipertiroidismo manifiesto durante la gestación se define como la disminución de los valores de tirotropina y una T4 elevada, según los rangos establecidos para el embarazo. La presentación subclínica se establece ante una tirotropina disminuida y concentraciones normales de T4.3) A pesar del papel dominante de la tirotropina en la definición de la disfunción tiroidea gestacional, se puede advertir que la concentración de T4 también es importante en este sentido.5
Los rangos de referencia de las pruebas de función tiroidea pueden variar entre poblaciones de gestantes de distintas regiones, esto depende de factores como la edad materna y gestacional, la raza, el hábito de fumar, la paridad, el estado nutricional del yodo y el índice de masa corporal.3,5) Estudios recientes6,7,8,9,10,11,12) evidencian que los valores de referencia para la tirotropina son diferentes a los preestablecidos por las principales guías clínicas relacionadas con la enfermedad tiroidea durante el embarazo.13,14) Por este motivo, los consensos de varias asociaciones médicas se pronuncian a favor del uso de intervalos específicos basados en cada población, a partir de una muestra representativa de gestantes que no tengan factores que interfieran con estos parámetros.5,15,16,17) En el caso de la T4, se sugiere el uso de rangos de referencia concretos debido a las variaciones entre los distintos métodos.3,5
Teniendo en cuenta lo anteriormente expuesto, este estudio tuvo como objetivo establecer los valores de referencia por trimestre para la tirotropina y las hormonas tiroideas en una población de embarazadas cubanas.
Métodos
Se realizó un estudio descriptivo transversal a 362 mujeres embarazadas del municipio Plaza de la Revolución, zona cercana a la costa y con suficiente nutrición de yodo,18 entre marzo de 2015 y febrero de 2020.
Para seleccionar la muestra se tuvieron en cuenta los intervalos de referencia para la tirotropina basados en los percentiles 2,5 y 97,5 de al menos 120 voluntarios eutiroideos normales, pautas de la Academia Nacional de Bioquímica Clínica de los Estados Unidos.19 Se seleccionaron al azar 3 áreas de salud y se incluyeron las mujeres embarazadas que aceptaron participar. Se excluyeron los embarazos gemelares, los casos con antecedentes personales o familiares de enfermedad tiroidea, los que padecían insuficiencia renal, hepática, malabsorción intestinal o tenían tratamiento con glucocorticoides, amiodarona, fenitoína, carbamazepina, litio, furosemida u otros medicamentos que interfieren en el metabolismo del yodo o la función de la glándula tiroides.19,20 También fueron excluidas las mujeres con anticuerpos positivos a la peroxidasa tiroidea o la tiroglobulina y las que tuvieron alterado el ultrasonido de tiroides. La muestra quedó conformada por 362 mujeres, 122 con tres meses y 120 del segundo y del tercer trimestre respectivamente.
Las participantes fueron entrevistadas para obtener datos como edad materna, edad gestacional, raza, hábito de fumar, paridad, consumo de suplementos nutricionales que contienen yodo e índice de masa corporal (IMC; kg/m2) al inicio del embarazo. Se tomó una muestra de sangre para determinar tirotropina, T4 y T3 totales y libres, anticuerpos contra la peroxidasa tiroidea (TPO) y contra la tiroglobulina (Tg). Los procederes se realizaron en el horario de la mañana.
Las determinaciones de tirotropina, T4 y T3 totales libres y anticuerpos anti-Tg y anti-TPO se realizaron mediante kits disponibles de IZOTOP (Institute of Isotopes Ltd, Hungría). La tirotropina se midió mediante ensayo inmuno-radiométrico con una sensibilidad funcional de 0,07 mUI/mL y coeficientes de variación inter e intraensayo de 2,0 % y 1,19 %, respectivamente. Se determinaron T4 y T3 totales y libres mediante radioinmunoensayo directo y los valores registrados fueron los siguientes:
| SF | CVE | CVI | |
| T4 total | 7 nmol/L | 2,8 % | 2,3 % |
| T3 total | 0,22 nmol/L | 4,1 % | 2,98 % |
| T4 libre | 0,7 pmol/L | 2,83 % | 0,94 % |
| T3 libre | 0,58 pmol/L | 4,76 % | 2,2 % |
SF: sensibilidad funcional; CVE: variación interensayo; CVI: variación intraensayo.
Los rangos de referencia del fabricante fueron 0,30 - 4,00 mUI/L para la tirotropina; 55 - 170 nmol/L para la T4 total; 10 - 22 pmol/L para la T4 libre; 1,25 - 3,03 nmol/L para la T3 total y 1,9 - 5,7 pmol/L para la T3 libre. Los anticuerpos anti-Tg y anti-TPO se midieron por radioinmunoensayo y se consideraron positivos cuando eran superiores a 100 mUI/mL para los anticuerpos anti-Tg y mayores que 25 mUI/ml para los anticuerpos anti-TPO.
Se utilizó el paquete estadístico SPSS (Statistical Package for Social Sciences) 21.0 para Windows. Se determinaron distribuciones de frecuencias de las variables cualitativas y media y desviación estándar de las cuantitativas. A fin de corroborar el supuesto de normalidad se realizó la prueba de Kolmogorov-Smirnov. Las variables tuvieron una distribución normal, excepto la T4 total en el primer trimestre y la tirotropina. Se compararon las medias de las variables cuantitativas entre trimestres del embarazo mediante el análisis de varianza de una vía. Se utilizó la prueba Chi cuadrado para comprobar si existían diferencias entre las variables cualitativas según el trimestre del embarazo.
A las variables con distribución normal se les determinaron los percentiles 2,5 y 97,5 como valores de referencia de los límites inferior y superior, respectivamente. La variable tirotropina se transformó mediante su raíz cuadrada y para la T4 total del primer trimestre se utilizó la transformación 1/T4 total. Los percentiles se calcularon mediante las transformaciones inversas a cada variable. Cada cálculo se realizó, de manera independiente, para cada trimestre del embarazo. En todos los análisis se consideró el valor de 0,05 como nivel de significación estadística.
Las embarazadas participaron de manera voluntaria. Se solicitó su consentimiento por escrito. Los resultados se utilizaron sólo con fines científicos y se mantuvo la confidencialidad de los datos. Este proyecto obtuvo la aprobación del Comité de Ética de las Investigaciones del Instituto de Endocrinología (código I 070LH 1807).
Resultados
La edad y el índice de masa corporal resultaron similares para los tres grupos. En todos los trimestres predominaron las gestantes blancas, no fumadoras, nulíparas y que no consumían suplementos yodados, aunque estas diferencias no resultaron significativas desde el punto de vista estadístico (tabla 1).
Tabla 1 Características generales de las embarazadas estudiadas
| Variables | Trimestre 1 n=122 | Trimestre 2 n=120 | Trimestre 3 n=120 | p |
|---|---|---|---|---|
| Edad (años) | 28,4±5,0 | 27,9±4,8 | 28,0±5,1 | 0,72 |
| Edad gestacional (semanas) | 11,4±1,3 | 18,3±3,3 | 30,9±3,9 | - |
| Raza Blanco Negro Mestizo | 75 (61,5) 17 (14,0) 30 (24,6) | 71 (59,2) 14 (11,6) 35 (29,2) | 76 (63,3) 16 (13,3) 28 (23,4) | 0,77 |
| Hábito de fumar Fumadoras No fumadoras | 10 (8,2) 112 (91,8) | 3 (2,5) 117 (97,5) | 12 (10,0) 108 (90,0) | 0,16 |
| Paridad Nulíparas Multíparas | 75 (61,5) 47 (38,5) | 76 (63,3) 44 (36,7) | 75 (62,5) 45 (37,5) | 0,96 |
| Suplementos yodados Sí No | 17 (13,9) 105 (86,1) | 18 15,0) 102 (85,0) | 12 (10,0) 108 (90,0) | 0,59 |
| IMC inicial (kg/m2) | 24,0±4,9 | 24,6±5,0 | 24,0±3,8 | 0,63 |
Se apreció que la tirotropina tuvo los valores más bajos en el primer trimestre del embarazo. La T4 total no fue relevante en ningún grupo. En cambio, la T4 libre presentó niveles inferiores en las mujeres con más tiempo de gravidez. En el caso de la T3, los niveles de su fracción total resultaron similares y la media de T3 libre fue superior en los primeros tres meses de gestación (tabla 2).
Tabla 2 Variables de función tiroidea por trimestre del embarazo
| Variables | Trimestre1 n=122 | Trimestre2 n=120 | Trimestre3 n=120 | p |
|---|---|---|---|---|
| Tirotropina (mUI/L) | 1,2±0,4 | 1,6±0,3 | 1,7±0,3 | 0,00 |
| T4 total (nmol/L) | 125,9±27,0 | 135,8±24,3 | 133,5±25,3 | 0,40 |
| T4 libre (pmol/L) | 10,6±2,4 | 9,7±2,3 | 8,2±1,8 | 0,00 |
| T3 total (nmol/L) | 2,7±0,5 | 2,8±0,5 | 2,8±0,6 | 0,29 |
| T3 libre (pmol/L) | 4,4±1,7 | 2,8±1,2 | 3,0±1,3 | 0,00 |
De acuerdo con estos resultados, el límite inferior del intervalo de referencia para todas las hormonas en cada uno de los trimestres es el que corresponde al 2,5 percentil y el límite superior se encuentra en el 97,5 percentil (tabla 3).
Tabla 3 Distribución en percentiles de la tirotropina y las hormonas tiroideas
| 2.5 | 25 | 50 | 75 | 97.5 | |
| Tirotropina (mUI/L) |
0,1 | 0,8 | 1,2 | 2,1 | 3,3 |
| Segundo | 0,6 | 1,1 | 1,6 | 2,5 | 3,4 |
| Tercero | 0,3 | 1,2 | 1,7 | 2,6 | 3,9 |
| T4 total (nmol/L) |
90,1 | 114,9 | 125,0 | 149,3 | 204,1 |
| Segundo | 92,2 | 118,5 | 136,9 | 153,5 | 189,2 |
| Tercero | 79,8 | 110,9 | 132,8 | 150,4 | 170,4 |
| T4 libre (pmol/L) |
7,3 | 9,5 | 10,6 | 12,1 | 16,7 |
| Segundo | 6,3 | 8,2 | 9,7 | 10,9 | 17,3 |
| Tercero | 5,6 | 7,3 | 8,2 | 9,3 | 12,7 |
| T3 total (nmol/L) |
1,8 | 2,4 | 2,7 | 3,0 | 3,9 |
| Segundo | 1,8 | 2,4 | 2,8 | 3,1 | 3,9 |
| Tercero | 1,7 | 2,5 | 2,8 | 3,1 | 4,0 |
| T3 libre (pmol/L) |
1,0 | 3,0 | 4,4 | 5,4 | 7,4 |
| Segundo | 0,7 | 2,2 | 2,8 | 3,8 | 6,3 |
| Tercero | 0,7 | 2,1 | 3,0 | 4,4 | 5,4 |
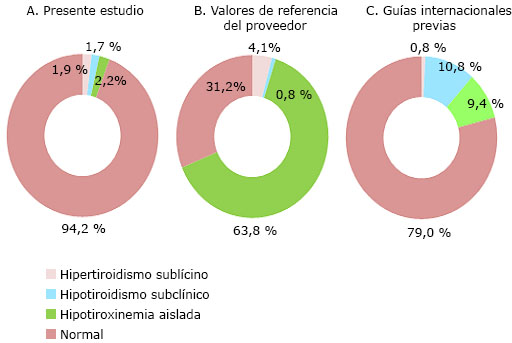
En la figura 1 se muestra la distribución de las categorías de función tiroidea según diferentes puntos de corte. En el primero de los anillos (2A) se representa la función de acuerdo con los intervalos de esta investigación y se aprecia que el 94,2 % de las embarazadas tuvo una función tiroidea normal. La alteración más frecuente fue la hipotiroxinemia aislada (2,2 %), seguida del hipertiroidismo subclínico con un 1,9 % y el hipotiroidismo subclínico en el 1,7 %.
Según los valores de referencia para la población general de los kits para las determinaciones hormonales (2B), la mayor parte de las mujeres (63,8 %) se catalogaría con una hipotiroxinemia aislada y el 31,2 % tendría una función normal. Al 4,1 % se les diagnosticaría un hipertiroidismo subclínico y al 0,8 %, un hipotiroidismo subclínico.
Al tener en cuenta los puntos de corte de las guías internacionales anteriores (2C), como la de la Asociación Americana de Tiroides de 2011,13 la Sociedad Endocrina de los Estados Unidos de 201214 o la Sociedad Latinoamericana de Tiroides de 2013,17 la frecuencia de disfunción tiroidea sería de un 21 %, con hipotiroidismo subclínico en el 10,8 % de las gestantes, hipotiroxinemia aislada en el 9,4 % e hipertiroidismo subclínico en el 0,8 %.
Discusión
El estudio demostró las variaciones del perfil tiroideo durante el periodo de gravidez. El descenso de las concentraciones de tirotropina durante los primeros tres meses se ha señalado en otras investigaciones,6,7,21,22 por ejemplo, en la India se reporta una disminución de dicha hormona antes del cuarto mes, seguida de un aumento que casi alcanza el nivel de la población general después de este periodo;23) Kim y colaboradores10) muestran una mediana de tirotropina de 1,32, 1,62 y 1,59 mUI/L en el primer, segundo y tercer trimestres, respectivamente. Esto se relaciona con el efecto clásico de la hCG prácticamente a los 90 días del embarazo, que suprime la tirotropina y estimula la producción de hormonas tiroideas.1
Las hormonas tiroideas totales no sufrieron modificaciones significativas. La T4 y la T3 libres mostraron niveles inferiores desde el inicio hasta el final de la gestación, lo que se puede explicar por el cese del pico de hCG después de las 10 semanas.5Sekhri y colaboradores23) también reportaron que la media de T4 libre se reduce de forma gradual en las embarazadas y los niveles más bajos se registran durante el tercer trimestre. Existen otras publicaciones que evidencian resultados similares.8,9,10
Los valores de referencia para los parámetros de función tiroidea resultaron diferentes a los propuestos por los fabricantes de los inmunoensayos utilizados. El intervalo para la tirotropina resultó más estrecho durante los 9 meses, aunque en las mujeres con mayor tiempo de gestación prácticamente no se modificó. Estos resultados son comparables con los de Europa y Latinoamérica,6,7,11,22) sin embargo, investigaciones de zonas geográficas como Asia9,10,12) muestran límites superiores por encima de 4,0 mUI/L, probablemente por las diferencias genéticas, nutricionales y ambientales entre las poblaciones.
La Asociación Americana de Tiroides de 2017 recomendó reducir 0,4 mUI/L al límite inferior y 0,5 mUI/L al límite superior del rango de referencia para la población general,3 pero esto no se corresponde con los hallazgos de este trabajo, sobre todo los relacionados con el límite inferior.
Los valores de referencia de la T4 total en la muestra estudiada son superiores al de la población general, lo que depende de los cambios en las concentraciones de la globulina fijadora de tiroxina que es más variable que las concentraciones de T4 libre, sobre todo al inicio del embarazo.24 Por este motivo, son pocas las publicaciones que evalúan la T4 total, lo más extendido es la determinación de la fracción libre.
Algunos expertos plantean que si no se cuenta con los medios para determinar la T4 libre, se puede multiplicar el rango de T4 total para la población general por 1,5 después de la semana 16.14,25) Sin embargo, en los intervalos de este estudio, todos los límites inferiores están por encima y los superiores, por debajo de dicho cálculo; de modo que este método podría no ser totalmente confiable. Existen investigadores que consideran esta fórmula una simplificación de las modificaciones hormonales del embarazo y no constatan en sus estudios el incremento en el 50 % de la T4 total en las gestantes.26)
Los valores de referencia de la T4 libre fueron inferiores a los límites del fabricante. Este hallazgo se corresponde con lo descrito en otros estudios.10,23 En una revisión sistemática para establecer los intervalos de referencia para la T4 libre durante el segundo y tercer trimestres, se observó una disminución en los límites superior e inferior.8) Se considera que la T4 libre es un indicador más útil que la T4 total para evaluar la función tiroidea al inicio del embarazo, pues no se afecta directamente por el aumento de las proteínas transportadoras.23
Los límites superior e inferior de T3 total aumentaron en todos los trimestres, lo que se corresponde con el aumento de las proteínas en sangre. Los intervalos de referencia para la T3 libre se hicieron más amplios por la disminución de su límite inferior y el incremento del superior. Existen pocos estudios que hayan determinado los valores de referencia para la T3 libre en embarazadas.6,7,11,23,27)
Al comparar la frecuencia de disfunción tiroidea según los distintos puntos de corte, se comprobó que con el intervalo de los kits diagnósticos, un grupo de mujeres con disfunción subclínica no se diagnosticaría y varios casos con función normal se considerarían con hipotiroxinemia aislada. En cambio, si se hubieran utilizado los valores de las guías internacionales, se hubieran diagnosticado, y probablemente tratado, un hipotiroidismo subclínico e hipotiroxinemia aislada a gestantes con una función tiroidea normal. Esto corrobora la pertinencia y utilidad de este estudio porque confirma el planteamiento de los expertos de que la enfermedad tiroidea en el embarazo requiere del uso de rangos de referencia específicos para cada población.
Se determinaron por primera vez los valores de referencia para la tirotropina y las hormonas tiroideas en una población de embarazadas de Cuba, país con un Programa Nacional de yodación de la sal para el consumo humano.18) Estos valores de referencia resultaron diferentes a los establecidos por los kits diagnósticos y las guías internacionales. El diseño transversal impidió estudiar los cambios intraindividuales en los parámetros de la función tiroidea por la exposición variable al yodo a corto plazo.