Introducción
Bordetella pertussis es un patógeno exclusivo de humanos, en los que produce una enfermedad respiratoria aguda altamente contagiosa llamada tos ferina, tos convulsa o coqueluche.1 Esta bacteria produce la exotoxina pertussis, que impide la síntesis de proteínas en las células ciliadas del tracto respiratorio y produce necrosis por la acumulación de monofosfato de adenosina cíclico, lo que inmoviliza los cilios incrementando la producción y secreción de mucus en las vías respiratorias.2
La B. pertussis se transmite de persona a persona a través de la inhalación o el contacto de las mucosas con gotitas de aerosol generadas al hablar, toser o estornudar, o procedentes de secreciones respiratorias de personas infectadas. El período de incubación oscila entre 1 y 2 semanas hasta causar tos ferina. A pesar de ser considerada una enfermedad de la infancia, eventualmente podría afectar a cualquier grupo de edad, como adolescentes y adultos jóvenes en los que muchas veces no se identifica la enfermedad como tal, pero actúan como fuente de contagio para neonatos y lactantes. La edad en que ocurre la mayor incidencia es en lactantes menores de 4 meses, que no han completado el esquema de tres dosis de vacunación, razón por la cual este grupo es más vulnerable a complicaciones como neumonía e infecciones graves asociadas a altas tasas de mortalidad. Globalmente se estima que cada año se reportan más de 16 millones de casos de tos ferina y aproximadamente 195.000 muertes.3
La vacunación es la principal medida preventiva frente a la tos ferina, ya que posee una eficacia demostrada del 80-85%, lo que ha permitido reducir la incidencia de la enfermedad y su mortalidad. Actualmente, existen dos tipos de vacunas comercializadas contra B. pertussis, una compuesta por células enteras inactivadas y la otra constituida por antígenos altamente purificados o vacuna acelular. Estas vacunas son usualmente combinadas con otros antígenos (difteria, tétanos, hepatitis B, Haemophilus influenzae tipo b, poliovirus inactivados). Según los esquemas de vacunación, se deben administrar tres dosis durante el primer año de vida y, al menos, una dosis de refuerzo antes de los 2 años de edad.3
Varios estudios han demostrado que la protección que brinda la vacunación disminuye con el tiempo, esto explica por qué se afectan más los adolescentes y adultos jóvenes que recibieron la vacuna hace varios años, así como los lactantes que no están protegidos por los anticuerpos de su madre a través de la lactancia.4 Existe poca información de la duración exacta de la respuesta inmune inducida por ambos tipos de vacunas y esto se debe a no contar con un correlato de protección fiable. Investigaciones recientes han sugerido que las vacunas compuestas por células enteras inactivadas protegen durante períodos más largos de tiempo que las acelulares.5 Cuba produce y utiliza vacunas combinadas que incluyen células enteras inactivadas de B. pertussis.6
La cuantificación de anticuerpos IgG contra células enteras de B. pertussis por la técnica de ELISA (Enzyme linked immunosorbent assay, por sus siglas en inglés) se utiliza para estudiar la respuesta inmune inducida por estas vacunas.7 Debido a inconvenientes en la adquisición de estuches comerciales, nos hemos propuesto como objetivo estandarizar un ensayo inmunoenzimático tipo ELISA para la cuantificación de IgG contra células enteras de B. pertussis en muestras de sueros de niños entre 1 y 5 años de edad.
Materiales y Métodos
Determinación de la concentración de recubrimiento
Para determinar la concentración de recubrimiento, placas de 96 pocillos MaxiSorp (Nunc, Dinamarca) se recubrieron con diluciones seriadas dobles de células enteras inactivadas de B. pertussis (100 μL/pocillo), en el rango de 8 - 0,04 Unidades de opacidad (UO)/mL, disueltas en solución salina tamponada con fosfatos (SSTF) 1X (137 mM NaCl; 2,7 mM KCl; 4,3 mM Na2HPO4*7H2O; 1,4 mM KH2PO4), pH 7,2 ± 0,2. Después de incubadas las placas durante 12-18 h a 4ºC, fueron lavadas tres veces con solución de lavado (SSTF 1X y 0,05% de Tween 20). Se empleó como control positivo el suero de referencia internacional (SRI) 06/142 del NIBSC; como control negativo, sueros de humanos no reactivos a la bacteria y el blanco reactivo fue la solución de anticuerpos (SSTF 1X; 0,05% Tween 20 y NaN3; pH 7,2 ± 0,2).
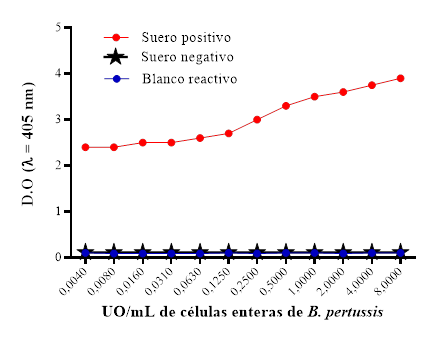
Se escogió como concentración de recubrimiento, la menor concentración donde se alcanzaron las densidades ópticas (D.O) deseadas para el suero control positivo sin la ocurrencia de valores de fondos, es decir, donde se observó la mayor diferencia entre las D.O del suero control positivo y el blanco reactivo.8
ELISA
Para las diferentes evaluaciones se utilizó un ensayo inmunoenzimático en fase sólida, cuantitativo, de tipo indirecto. Se realizó el recubrimiento con la concentración seleccionada, tal como se describió en el acápite anterior. Luego de lavadas las placas, se procedió a adicionar 100 μL/pocillo (por duplicado) de las muestras de los sueros problema, los controles y la curva estándar a partir del SRI, diluidas en solución de anticuerpos. Las placas se incubaron 1 h a temperatura ambiente y se lavaron posteriormente de la forma descrita. Luego se adicionó 100 μL/pocillo del anticuerpo anti-IgG humano conjugado a fosfatasa alcalina (Sigma-Aldrich, EUA) preparado en solución de anticuerpos. Las placas se incubaron nuevamente 2 h a temperatura ambiente y más tarde se lavaron de la forma descrita. Posteriormente, se aplicaron 100 μL de la disolución cromogénica p-nitrofenil fosfato hexahidratado (0,5 mg/mL), diluida en tampón sustrato (dietanolamina, MgCl2*6H2O, HCl 6M, pH 9,8 ± 0,05). La reacción se desarrolló durante 30 min a temperatura ambiente, protegida de la luz y se detuvo con 50 μL/pocillo de NaOH 3M. Las lecturas se realizaron en un lector de microplacas (TECAN, Austria) acoplado a una computadora haciendo uso del programa Magellan 7; la absorbancia se midió con una longitud de onda de 405nm con 690nm de referencia.
Determinación del rango lineal de la curva y titulación del conjugado
Se realizaron tres ensayos en los que se evaluaron 12 diluciones seriadas con factor 3 del SRI 06/142 del NIBSC, comenzando desde 1/100. En cada ensayo se procesaron seis réplicas de cada suero. Se seleccionó el segmento de la curva correspondiente a aquellas diluciones que alcanzaran un coeficiente de determinación (R2) ≥ 0,98, un coeficiente de correlación (r) ≥ 0,99, así como un coeficiente de variación (CV) menor del 10% entre las concentraciones de cada punto, una vez corregidas por el factor de dilución. Los parámetros de la ecuación se determinaron mediante regresión no lineal polinómica. El CV debe ser menor del 20% para los tres ensayos realizados.9 El SRI recibió una asignación arbitraria de 100 unidades arbitrarias por mililitro (UA/mL), para su empleo como curva de calibración.
La dilución del anticuerpo anti-IgG humano conjugado a fosfatasa alcalina se tituló igualmente en diluciones entre 1:10.000 y 1:20.000, con incrementos de 5.000 con las mismas curvas del SRI. Se seleccionó como dilución óptima aquella cuya razón suero positivo/suero negativo fue mayor.
Precisión del ensayo
Precisión intraensayo
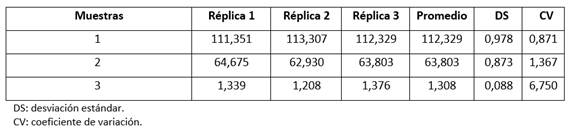
La repetibilidad del ensayo se evaluó utilizando tres sueros de diferentes concentraciones dentro del rango de la curva estándar, a través del análisis de cinco réplicas. Se determinaron la media, la desviación estándar (DS) y el CV. Para considerar la precisión intraensayo como adecuada, el coeficiente de variación no debe superar el 10% entre las determinaciones realizadas.9
Precisión interensayo
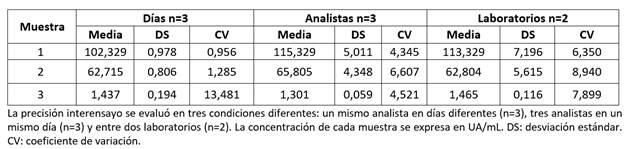
La precisión interensayo se evaluó con los sueros referidos en el acápite anterior, por duplicado, en cuatro diluciones dobles seriadas. La evaluación se realizó bajo las condiciones de: un analista en días diferentes, tres analistas en un mismo día y entre dos laboratorios y se utilizaron las mismas soluciones y equipos excepto cuando se realizó en el otro laboratorio. La temperatura durante el ensayo se mantuvo en un rango de 18°C a 24°C. Para cumplir con este parámetro, el CV no debe superar el 20% para cada uno de los casos.8
Paralelismo
Se procesaron en el mismo ensayo, dos réplicas de cada punto de la curva de calibración a las diluciones previamente seleccionadas, con al menos seis réplicas de cuatro diluciones de suero, desde 1/100 hasta 1/800, de siete muestras procedentes de niños previamente vacunados. Se calculó el R2 de cada curva obtenida que debe ser ≥ 0,98, así como el CV entre las concentraciones de cada muestra, una vez corregidas por el factor de dilución, que debe ser inferior al 10%.9
Valor de corte y límite de detección
Para establecer el valor de corte y límite de detección se utilizaron los sueros positivos y negativos (sueros positivos a tétano y difteria) como se describe en el acápite anterior. El límite de detección se calculó como la media de la respuesta de anticuerpos de las muestras de sueros no relacionadas más tres veces la DS expresada en UA/mL.
Especificidad
Para determinar la especificidad de la técnica, se evaluaron sueros humanos inmunizados con diferentes inmunógenos: células enteras de B. pertussis, toxoide tetánico (TT) y toxoide diftérico (TD) con una concentración conocida de anticuerpos en cada caso. El criterio de aceptación fue que los sueros positivos para otros antígenos resultaran no respondedores para B. pertussis según el criterio seleccionado anteriormente.9
Aplicación del ELISA en Ensayos Clínicos
Para evaluar el uso del ELISA, se determinaron las concentraciones de anticuerpos contra B. pertussis en sueros de niños procedentes del Ensayo Fase II/III “Evaluación de la inmunogenicidad y eficacia del candidato vacunal heptavalente contra neumococos en niños pre-escolares (ISCANI, RPCEC00000182)”; este candidato vacunal en estudio se aplicó de manera concomitante con otras vacunas del calendario nacional de vacunación. Se evaluaron dos grupos etarios comprendidos entre 12-23 meses y 2-5 años.
Resultados y Discusión
Las vacunas de células enteras contra B. pertussis han sido utilizadas desde 1940 con cierto éxito en el control de la tos ferina. Por su reactogenicidad, fueron sustituidas en algunos esquemas de inmunización por las vacunas acelulares. A pesar de ello, el microorganismo sigue re-emergiendo, aun cuando existe alta cobertura y esquemas de inmunización eficientes a nivel mundial. Las causas de esta re-emergencia son multifactoriales por lo que se impone la necesidad de evaluar continuamente el estado serológico de las poblaciones pediátricas.10
Los ensayos inmunoenzimáticos ELISA han sido extensamente utilizados en estudios inmunoepidemiológicos de B. pertussis. Estos ensayos se realizan con frecuencia mediante la evaluación directa de los anticuerpos específicos contra la toxina pertussis relacionada estrechamente con la protección.11 Adicionalmente, el seguimiento y evaluación de la respuesta de anticuerpos contra la célula entera constituye una herramienta necesaria como diagnóstico y evaluación de la inmunogenicidad vacunal.12) Estos ensayos permitirían además determinar y caracterizar la respuesta de anticuerpos específicos en esquemas de vacunación combinados o concomitantes con vacunas como la anti-neumococica.
Recubrimiento
En la Figura 1 se puede apreciar una curva sigmoidal con un ligero ascenso de las concentraciones de recubrimiento. En este caso se escogió 0,5 UO/mL de células enteras de B. pertussis, donde se alcanzó la mayor señal posible con el menor valor de blanco y se comienza a observar un discreto ascenso de la respuesta, ya que cualquier concentración superior de antígeno no proporcionará una respuesta superior.
Establecimiento del rango lineal de la curva y el título del conjugado
Al evaluar la dilución adecuada del anticuerpo anti IgG humana conjugado a fosfatasa, se determinó que la mayor relación entre el suero control positivo y el suero control negativo se observó con la dilución 1:10.000.
Luego de evaluar 12 diluciones seriadas triples del suero de referencia se escogió el segmento de la curva comprendido entre 1/100 y 1/72.900 por ser el segmento que mejor ajuste mostraba con una curva polinómica de grado 3 con un coeficiente de determinación R2 de 0,994 y coeficiente de correlación (r) de 0,995 (Fig. 2). El suero estándar dilución 1/100 recibió una asignación arbitraria de 100 UA/mL para su empleo como curva estándar.
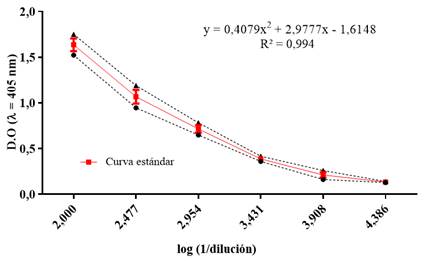
Fig. 2 Curva de calibración del ELISA de cuantificación de anticuerpos contra células enteras de B. pertussis. Se grafica la densidad óptica (D.O) contra el logaritmo del inverso de la dilución del intervalo seleccionado. El valor promedio de las determinaciones de las curvas realizadas en días diferentes se muestra en línea continua. Las líneas discontinuas representan el valor promedio ± 2 desviaciones estándar (DS).
Precisión
Precisión intraensayo
La precisión intraensayo es el parámetro que se utiliza para evaluar la variabilidad intrínseca del método. Es llevada a cabo sobre la base de un número suficiente de determinaciones, en las mismas condiciones, por un mismo analista, en el mismo laboratorio, con los mismos equipos y reactivos; generalmente en un corto intervalo de tiempo.13
En la Tabla 1 se muestran los CV para tres réplicas de cada muestra, siendo estas menores del 10%, por lo tanto, el ensayo posee una variabilidad intrínseca aceptable.9 Esto significa que el método posee una buena precisión entre determinaciones independientes realizadas en las mismas condiciones.
Precisión interensayo
La reproducibilidad es la medida de la precisión de los resultados de un método analítico que se efectúa sobre la misma muestra, pero en condiciones diferentes: analistas, laboratorios, equipos y días, entre otras. Es decir, evalúa la variabilidad debida a un factor extrínseco al método.13 En la Tabla 2 se muestran las medias de las concentraciones obtenidas para cada una; el CV interensayo para todos los casos fue inferior al 20%. De acuerdo con estos resultados puede afirmarse que el método posee una reproducibilidad satisfactoria.13
Paralelismo
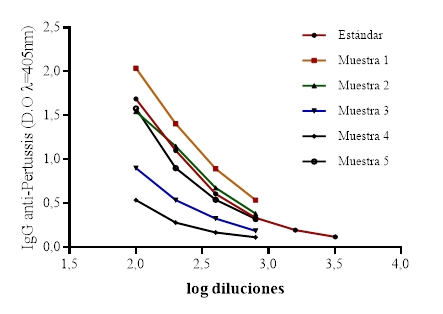
Se evaluó, además, el paralelismo entre la respuesta de la curva de calibración y la obtenida en sueros de niños participantes en el Ensayo ISCANI. Los sueros individuales de cada sujeto fueron evaluados para medir la respuesta específica contra B. pertussis. En la Figura 3 se muestran los valores promedios de cada suero con respecto a la curva de calibración obtenida a partir del SRI. En todos los casos los R2 obtenidos fueron superiores a 0,98 y el CV entre las concentraciones de cada muestra fue inferior al 10%, una vez corregido los valores obtenidos por el factor de dilución, lo que avala la linealidad de la respuesta.9
Límite de detección
El límite de detección calculado fue de 0,04 UA/mL. Los sueros negativos con valores asignados para otros antígenos no relacionados presentaron valores de respuesta bajos, inferiores al límite de detección. Las muestras de los sueros no relacionados que resultaron negativas se encontraron por debajo del límite de detección, por lo que este también se convierte en el valor de corte del ensayo. Dado este valor los sujetos con valores por encima del mismo serán considerados respondedores.
Especificidad
La especificidad se define como la capacidad del ensayo para identificar o medir el analito en una muestra en presencia de otros componentes previsibles en el producto (impurezas, productos de degradación, otros componentes de la formulación). Este criterio define la propiedad del método de detectar el anticuerpo de interés, sin que otros anticuerpos afecten o influyan sobre el valor obtenido. Se puede determinar adicionando a la muestra una cantidad conocida de impurezas en concentraciones adecuadas y demostrar que el análisis no resulta afectado por la adición de esta sustancia.14) Para la determinación de la especificidad se evaluaron sueros humanos inmunizados contra células enteras de B. pertussis, incluyendo otros positivos a TT y diftérico TD.
En la Figura 4A se observan los valores de las D.O de los sueros que se evaluaron. Los dos sueros negativos no relacionados presentaron respuestas bajas en todos los casos, estadísticamente significativas (p=0,002), con respecto al suero control positivo contra B. pertussis. La absorbancia del suero positivo contra células enteras de B. pertussis fue superior a la de los sueros específicos para otros antígenos. Lo que demuestra que el ensayo cuantifica los anticuerpos anti células completas de B. pertussis sin que los valores sean afectados por la presencia de interferencias en el suero.
Aplicación del Ensayo
En el ensayo se utilizaron sueros de 200 niños participantes en el Ensayo ISCANI, del candidato vacunal cubano contra neumococo PCV7-TT. En la Figura 4B se muestran las medias geométricas de las concentraciones calculadas para cada grupo etario evaluado, el grupo comprendido de 12-18 meses mostró valores de anticuerpos más altos que los encontrados en el grupo de 2-5 años. La inmunización de refuerzo de células enteras de B. pertussis que recibe la población infantil a los 12 y 18 meses pudiera ser la razón del por qué los títulos de anticuerpo son superiores, los cuáles van decayendo en el tiempo y por esto se ve una disminución en el grupo de 2-5 años.
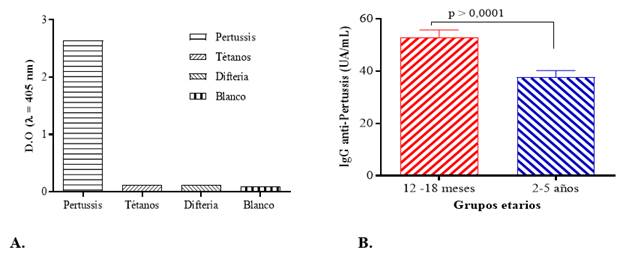
Fig. 4 Especificidad y aplicación del ELISA de cuantificación en ensayos clínicos. A) Pertussis (suero positivo contra células enteras de B. pertussis), Tétanos (suero positivo contra TT) y Difteria (suero positivo contra TD). B) Se observan las medias geométricas de las concentraciones de los sueros procedentes del ensayo ISCANI. Las barras de error corresponden a las desviaciones estándar calculadas. D.O: densidad óptica.