Introducción
El tratamiento anestésico del paciente obeso durante la cirugía bariátrica representa un reto para el anestesiólogo, no solo por las alteraciones fisiológicas, anatómicas y farmacológicas que pueden presentarse cuando se requiere prescribir un fármaco,1 sino por el incremento en la incidencia de enfermedades asociadas, que disminuyen el margen de seguridad de las drogas usadas durante la anestesia.2 Esto hace que la administración de fármacos en ellos sea compleja y poco precisa, ya que parte del conocimiento acerca de la dosificación de drogas y su cinética proviene de datos en pacientes no obesos.
A pesar que los opioides son considerados la piedra angular de la práctica anestésica, su uso en pacientes obesos presupone un elevado riesgo de complicaciones, dado principalmente por el agravamiento del síndrome de apnea obstructiva del sueño con hipoxemia posoperatoria, insuficiencia respiratoria, eventos cardíacos posoperatorios e ingresos en la Unidad de Cuidados Intensivos (UCI) mayores al doble.3
Un efecto secundario menos conocido es la debilidad del músculo faríngeo, que contribuye a patrones respiratorios obstructivos, con incremento en el riesgo de complicaciones y mortalidad en el obeso con síndrome de apnea obstructiva del sueño (SAOS).4
La anestesia libre de opioides (ALO) es una opción anestésica que surge de alternativas farmacológicas que permiten lograr estabilidad hemodinámica, supresión de la respuesta simpática y analgesia, considerados estos los cimientos fundamentales de todo acto anestésico, y que solo eran factibles en el pasado con opioides.5
En el año 2005 se publicó el primer reporte acerca de un paciente de 433 kg con SAOS, hipertensión pulmonar y reflujo gastroesofágico, programado para un bypass gástrico, en quien se evitaron los opioides por su efecto depresor central, y la anestesia se basó en el uso de dexmedetomidina.6 A partir de entonces se han publicado diversos informes de casos exitosos, así como ensayos clínicos en los que se han exaltado las ventajas de las técnicas libres de opioides.7,8
Uno de los protocolos que se ha tenido como referencia, se realizó en el Hospital “Saint Jan Brugge”, en Brujas, donde se proponen las dosis de impregnación e infusión de dexmedetomidina, ketamina, lidocaína, esmolol, sulfato de magnesio, propofol y rocuronio. En una cohorte de 5061 pacientes, encontraron una reducción drástica del uso de opioides posoperatorios en las primeras 24 h, con menores complicaciones y una disminución de la estadía hospitalaria.9)
Además, de la anestesia regional, muchos analgésicos no opioides reducen los requerimientos perioperatorios de opioides, incluida la infiltración dirigida y/o infusiones intravenosas de anestésicos locales, analgésicos no esteroideos (AINES), antagonistas del N-metil-D-aspartato (NMDA), alfa 2 agonistas, anticonvulsivantes, antidepresivos, glucocorticoides y beta-bloqueadores.10,11
En Cuba no existen aún de forma consensuada protocolos establecidos para la conducta anestésica del paciente obeso tratado por cirugía bariátrica laparoscópica, tampoco existen investigaciones en las bases de datos cubanas que acrediten el uso de técnicas libres de opioides en estos pacientes.
Dado que los obesos mórbidos son un grupo especial de pacientes que requieren una atención adicional durante el período perioperatorio, comprender los cambios anatómicos, fisiológicos, metabólicos y farmacológicos es imprescindible para que el anestesiólogo module la técnica anestésica, a fin de obtener los mejores resultados.
El objetivo de la presente investigación es evaluar la efectividad y seguridad de una técnica anestésica multimodal libre de opioides en el paciente obeso intervenido con cirugía bariátrica laparoscópica.
Métodos
Se realizó un estudio observacional analítico, prospectivo y longitudinal, en 23 pacientes obesos seleccionados por muestreo no probabilístico, intervenidos quirúrgicamente por técnicas gástricas restrictivas laparoscópicas con anestesia general multimodal libre de opioides en el HUGCG, en el período de enero de 2019 a enero de 2020.
Se incluyeron pacientes de uno u otro sexo, con edad igual o mayor de 18 años, con IMC mayor o igual a 35 kg/m2, que dieron su consentimiento a participar en la investigación. Fueron excluidos aquellos con antecedentes de cualquier tipo de dolor crónico, alergia conocida a cualquier fármaco de los utilizados, con enfermedad coronaria de moderada a severa o bloqueos cardíacos, los que recibían tratamiento con betabloqueadores, anticonvulsivantes o cualquier tipo de opioide y los pacientes con disfunción cognitiva o incapacidad para interpretar la escala de dolor aplicada.
La analgesia intraoperatoria se evaluó a través de la respuesta hemodinámica al estímulo quirúrgico, evidenciado por las variaciones en la tensión arterial media (TAM), la frecuencia cardíaca (FC) e índice de perfusión (IP); antes e inmediatamente después de la incisión quirúrgica, y cada 10 min durante el intraoperatorio. La analgesia posoperatoria se valoró por la intensidad del dolor según escala numérica verbal (ENV) (0: ausencia de dolor, 1-3: dolor leve, 4-6 dolor moderado y 7-10: dolor intenso), en siete momentos: inmediatamente después de extubado (M0), de forma horaria en las primeras 3 h (M1, M2, M3), a las 6 h (M6), 12 h (M12) y a las 24 h (M24). Con un valor de la ENV por debajo o igual a tres puntos se administraron analgésicos menores (dipirona 1,8 gr intravenoso) y con valores mayores o igual a 4 puntos, se administró analgesia de rescate intravenosa (tramadol 1 mg/kg peso corregido al 40 %) y se registró momento y número de dosis.
El tiempo total de recuperación anestésica se evaluó mediante dos elementos de recuperación, primero, el tiempo transcurrido desde que se interrumpen las infusiones de anestésicos, hasta la extubación orotraqueal; y segundo, a través del tiempo necesario para alcanzar una puntuación de 10 puntos en la escala de Aldrete-Kroulik modificada en la Unidad de Cuidados Posanestésicos (UCPA). Se describen, además, las complicaciones intraoperatorias y posoperatorias inmediatas.
Todos los pacientes recibieron medicación preanestésica por vía intravenosa con metoclopramida 10 mg y midazolam 0,04 mg/kg (según peso real), 30 min antes de entrar a quirófano.
Una vez allí se monitorizó con electrocardiografía continua de tres derivaciones, análisis automático del segmento ST, tensión arterial no invasiva, frecuencia cardíaca (FC), pulsioximetría, capnografía/capnometría, temperatura, índice de shock (IS) e índice de perfusión (IP). De igual manera se monitorizó el grado de nocicepción (qNox) y el grado de hipnosis (qCon) con monitor qCON2000 de Quantium Medical. Una vez intubado el paciente se agregaron las presiones intrapulmonar y curvas de presión y flujo. Durante y después de la realización del neumoperitoneo se monitorizó la presión del neumoperitoneo, la velocidad de insuflación y el consumo de CO2.
Se realizó preoxigenación con mezcla de aire-oxígeno (FiO2 0,6), a 4 L/min y PEEP entre 8 y 10 cmH2O. Para el abordaje de la vía respiratoria se utilizó laringoscopio McCoy, y sondas endotraqueales de diámetros 7,0 y 7,5 para mujeres y 8,0 y 8,5 para hombres. Una vez acoplados a máquina de anestesia, se empleó ventilación controlada por volumen y se establecieron parámetros ventilatorios con volumen corriente (Vc) entre 8 y 12 ml/kg, frecuencia respiratoria (FR) entre 10-12 rpm, PEEP entre 8-12 cmH2O, con maniobras de reclutamiento pulmonar antes del establecimiento de la PEEP y cada 30 min hasta el final de la intervención (presión positiva inspiratoria de 40 cmH2O por 15 seg). Los parámetros ventilatorios fueron ajustados intraoperatoriamente para mantener presión pico por debajo de 35 mmHg y EtCO2 entre 30 y 45 mmHg.
Los parámetros del laparoinsuflador se programaron con una presión intrabdominal (PIA) de 12 cmH2O y la velocidad de insuflación inicial a 0,5 L/min y posterior mantenimiento a 8 a 10 L/min.
La técnica anestésica: inmediatamente de la intubación y antes de la incisión quirúrgica se comenzó la administración de infusión intravenosa de metamizol sódico 2 gr en 250 mL de solución salina al 0,9 % y dexametasona 8 mg en bolo. La inducción se realizó con: lidocaína 2 % 1,5 mg/kg + propofol 1,5 mg/kg + vecuronio 0,1 mg/kg + sulfato de magnesio 30 mg/kg (según peso ideal) + ketamina 0,3 mg/kg (según peso corregido al 40 %).
Todos los fármacos administrados en bolos. El mantenimiento fue con: TIVA: ketamina 0,3 a 0,2 mg/kg/h (según peso corregido al 40 %) + lidocaína 1,5 mg/kg/h + sulfato de magnesio 15 mg/kg/h (según peso ideal) + propofol TCI. Cp: 4 a 2,5 mcg/mL (según peso corregido al 40 %, para mantener hipnosis entre valores de 40 y 60 según qCon). El vecuronio se utilizó en bolos, según necesidades para mantener la relajación neuromuscular. La infusión de propofol se descontinuó 10 min antes de finalizada la intervención quirúrgica y las infusiones de ketamina, lidocaína y magnesio al término del último punto de piel.
Al finalizar la intervención quirúrgica se administró diclofenaco 75 mg en 100 mL de solución salina al 0,9 %, e infiltración con bupivacaína 0,25 % (50 mg) a nivel de las incisiones quirúrgicas, se antagonizó el efecto del bloqueante neuromuscular con neostigmina 0,03 mg/kg de peso real y atropina 1 mg intravenoso y además, se utilizó ondasetrón 4 mg intravenoso, para profilaxis de náuseas y vómitos posoperatorios. Todos los pacientes pudieron ser extubados dentro del quirófano. Después fueron trasladados a la UCPA para la recuperación anestésica total, donde permanecieron por espacio de 24 h.
Los datos fueron procesados con el programa estadístico Statistical Package Social Sciencie (Spss) versión 18.0. Las variables cualitativas se analizaron a través de los números absolutos y relativos (porcentajes). Las cuantitativas a través de la media y la desviación estándar, así como el mínimo y el máximo.
Para la comparación entre variables cualitativas se empleó la prueba de ji cuadrado de independencia y para las cuantitativas el test de student para muestras independientes. Cuando fue necesario estimar la intensidad de la asociación se utilizaron los coeficientes de correlación lineal: Pearson y Spearman según tipo de variable. Se prefijó un error alfa de 0,5 y se consideró significativo el valor de p < 0,05 para un nivel de confianza del 95 %.
El estudio se analizó y se aprobó por el Consejo Científico y el Comité de Ética del Hospital Universitario “General Calixto García”. El consentimiento informado se obtuvo sistemáticamente de todos los pacientes. También se aplicaron los principios que declara la Declaración de Helsinki12
Resultados
Se realizaron 17 gastroplicatura vertical laparoscópica y 6 gastrectomías en manga. El 73,9 % (n = 17) fueron del sexo femenino, diferencia que fue significativa respecto al sexo masculino (p = 0,0004). La edad promedio fue 38,19 ( 8,73, con un predominio en el grupo de 40 a 49 años. La mayoría de los pacientes fueron clasificados como ASA II (65,2 %), con diferencias significativas respecto a los clasificados como ASA III (p = 0,0043). El 56,5 % de los pacientes (n = 13) presentaron una obesidad mórbida (grado III), que coincide con el valor promedio de IMC (47,9 ( 7,88), el cual osciló entre 35,9 y 65,8 kg/m2.
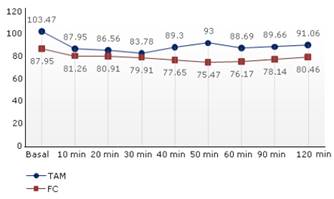
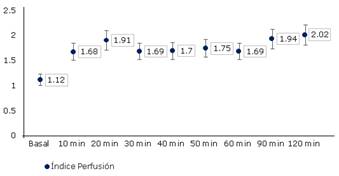
Se representan las variaciones intraoperatorias de los parámetros hemodinámicos (TAM, FC e IP). Tanto la TAM como la FC, tuvieron una disminución respecto a los valores basales posterior a la inducción anestésica, que se mantuvo estable durante todo el resto de la intervención quirúrgica, dentro del rango de la normalidad y sin diferencias significativas entre las mediciones (p = 0,322). En el caso del índice de perfusión se mantuvo con una tendencia al incremento, lo que supone una mejoría en la perfusión tisular (fig.1 y 2).
Con los datos de monitorización obtenidos, se pudo establecer una relación entre el IP y el grado de nocicepción intraoperatorio, medido por qNox. Los valores promedios basales del IP se mostraron por debajo de 1,2 con el paciente despierto (qNox 99,47), durante el intraoperatorio existió una relación inversamente proporcional entre ambos parámetros, para estabilizarse hacia el final de la intervención quirúrgica, donde se igualó la tendencia entre estas variables.
El 82,6 % (n = 19) de los pacientes al llegar al posoperatorio no presentaron dolor, cuatro pacientes (17,4 %) tuvieron dolor leve, y ninguno tuvo dolor moderado o severo. A los 60 min 16 pacientes (69,6 %) seguían sin referir dolor, seis pacientes (26,1 %), refirieron dolor leve y un solo paciente (4,3 %) refirió dolor moderado. A las 2 y 3 h siguientes, el 60,9 % y 73,9 % respectivamente, permanecían libres de dolor; resultados que fueron significativos en los cuatro tiempos analizados.
Una vez pasadas las 6 h y hasta las 24 h, no hubo pacientes con dolor intenso. En todos los tiempos evaluados hubo predominio de los pacientes sin dolor, y en menor medida con dolor leve. Según los datos analizados se pudieron evidenciar que los intervalos más frecuentes de EVA están entre 0 y 3 en todos los escenarios de tiempo, es decir desde la inexistencia de dolor hasta un dolor leve o controlado.
Estos resultados fueron significativos con un valor de p = 0,01, el cual resulta muy por debajo del error alfa prefijado de 0,5 para un nivel de confianza del 95 % (fig. 3).
Al analizar la necesidad y el número de dosis de analgesia de rescate, se observó que el 21,7 % (n = 5) de los pacientes requirieron alguna dosis de analgesia posoperatoria, mientras que la mayoría (78,3 %, 18 pacientes) no la necesitaron.
En los pacientes que requirieron algún tipo de rescate, se administraron bolos de tramadol, y se tomaron en cuenta el número de dosis que fueron requeridos en las horas de posoperatorio evaluadas. De los cinco pacientes que requirieron analgesia de rescate, cuatro (80 %) ameritaron solo una dosis de entre 50 y 75 mg de tramadol, mientras que un paciente necesitó que se le administraran 2 dosis de rescate de 50 mg de tramadol a la segunda y tercera hora del posoperatorio (tabla 1).
Tabla 1 Necesidad de analgesia de rescate y número de dosis. HUGCG. 2019-2020
| Analgesia de rescate | n.o | % |
|---|---|---|
| Sí | 5 | 21,7 |
| No | 18* | 78,3 |
| Total | 23 | 100,0 |
| Número de dosis de rescate | ||
| 1 dosis | 4 | 80,0 |
| 2 dosis | 1 | 20,0 |
Fuente: Modelo de recolección de datos. * p < 0,05.
Se representa la recuperación total de los pacientes según el tiempo transcurrido para la extubación y el tiempo de recuperación total en la UCPA. La totalidad de los pacientes emergieron de la anestesia sin complicaciones, con un tiempo promedio para la extubación de 6,7 ± 0,8 min y alcanzaron el puntaje máximo en la escala de Aldrete- Kroulik en la UCPA en menos de 30 min (29,6 ± 0,8) (tabla 2).
Tabla 2 Valores promedios de recuperación de los pacientes. HUGCG. 2019-2020
| Característica | Media | DE |
|---|---|---|
| Tiempo extubación | 6,7 min | ± 0,8 |
| Tiempo de recuperación total UCPA | 29,6 min | ± 0,8 |
Fuente: Modelo de recolección de datos.
Del total de casos, seis pacientes (26,1 %) presentaron efectos adversos. Los más frecuentes fueron la hipotensión arterial (8,7 %) y la bradicardia (8,7 %) que se presentaron en dos de los pacientes, y en menor medida los mareos (4,3 %) y la hipertensión (4,3 %) se observaron en un paciente cada uno. Hubo dos pacientes que tuvieron algún efecto adverso en el intraoperatorio y se repitió en el posoperatorio.
Discusión
El dolor posoperatorio de los pacientes obesos intervenidos por cirugía bariátrica constituye una de las principales causas de morbilidad posoperatoria y es una condicionante en la rehabilitación y recuperación del paciente.13 Los objetivos fundamentales del control del dolor son la propia analgesia, la movilización precoz y la optimización de la función respiratoria, lo que favorece además la realización de fisioterapia respiratoria; todo ello sin producir sedación ni compromiso ventilatorio.14,15
El uso de ketamina a bajas dosis como coadyuvante analgésico fue planteado hace más de 30 años. Desde entonces, se ha tratado de demostrar su efecto sobre la disminución en el consumo de opioides posoperatorios con diferentes modalidades de administración.16
Ante la aparición de múltiples trabajos en los que se explora el uso como analgésico de la ketamina, varias metaanálisis han reportado un efecto beneficioso de esta sobre la intensidad del dolor posoperatorio, la disminución en el consumo pre y posoperatorio de opioides y la reducción del dolor crónico después de la cirugía.
Bell y otros17 publicaron una revisión sistemática con el objetivo de evaluar la tolerancia y efectividad del uso de ketamina en dosis subanestésicas en el tratamiento del dolor agudo posoperatorio, que incluyó 2240 pacientes de 37 estudios. Aunque el resultado mostró una disminución del consumo de morfina y de las náuseas y de los vómitos posoperatorio; la heterogeneidad de los estudios incluidos y las diferentes dosis de ketamina usadas, así como los momentos en los que fue administrada hicieron tener ciertas precauciones al momento de considerar definitivas sus conclusiones.
Uno de los principales problemas que se plantea a la hora de comparar resultados entre varios estudios que emplean anestesia libre de opioides, son las diferentes alternativas para realizar la técnica.
Con las tendencias en el tiempo de los parámetros hemodinámicos evaluados, los cuales se mantuvieron dentro de la normalidad, se puede afirmar que la técnica utilizada tuvo un efecto beneficioso sobre la analgesia intraoperatoria. Cuando se relacionó el IP con el grado de nocicepción, las curvas tuvieron una relación inversa en el intraoperatorio. Lo cual quiere decir que la respuesta simpática que se establece con el estímulo quirúrgico de vasoconstricción, no se presentó pues la tendencia del IP fue al crecimiento, es decir a la mejora de la perfusión tisular. Esto se corroboró con un plano analgésico efectivo según los valores del qNOX entre 40 y 60. Al final de la intervención quirúrgica y durante la emersión de la anestesia, estas curvas se estabilizan hacia el crecimiento, lo que indica que los pacientes se despertaron sin dolor.
Estos resultados concuerdan con la revisión sistemática realizada por Forget y otros18 en la que evaluaron la estabilidad hemodinámica proporcionada por la ketamina y el magnesio como técnicas libres de opioides. Incluyeron 11 ensayos clínicos aleatorizados (cinco para ketamina y seis para sulfato de magnesio), con un total de 371 pacientes. Los resultados muestran que, en los análisis cuantitativos, la ketamina frente al placebo, no mostraron un efecto significativo sobre la frecuencia cardíaca (+ 0,71 lpm; IC del 95 % [-1,52 a +2,93], p = 0,53) pero redujeron significativamente la variabilidad de la presión arterial (- 8,4 mmHg; IC del 95 % [- 15,1 a - 1,8], p = 0,0005). Concluyen que la ketamina y el magnesio, de manera diferente pero consistente, reducen la variabilidad hemodinámica durante la cirugía y pueden considerarse complementarios no solo para el control del dolor, sino también para proporcionar anestesia estable. Este estudio respalda el uso de esos medicamentos para controlar la respuesta simpática a la cirugía en el contexto de la anestesia libre de opioides.
Monsour y otros19 realizaron un estudio, que incluyó a 28 pacientes divididos aleatoriamente en dos grupos: (grupo opioide) y (no opioide). La inducción en el grupo no opioide se realizó con propofol 2 mg/kg, ketamina 0,5 mg/kg y rocuronio 0,5 mg/kg. La misma inducción se realizó en el grupo opioide con la excepción de la ketamina, que se reemplazó con fentanilo 2-5 mcg/kg. Ambos grupos se mantuvieron con sevoflurano e infusión de ketamina o fentanilo, respectivamente.
Posoperatoriamente, el grupo no opioide fue tratado con paracetamol, diclofenaco y tramadol, mientras que el grupo opioide recibió paracetamol y fentanilo. Los dos grupos tenían indicado morfina de rescate de 2 a 4 mg cada 2 h según fuera necesario.
Los resultados mostraron que no hubo diferencias en la frecuencia cardíaca, la presión arterial media, la saturación de oxígeno ni en el CO2 espirado, y las puntuaciones de dolor fueron mejores dentro del grupo no opioide que en su contraparte. Un efecto secundario experimentado por el grupo no opioide que no se observó en el grupo opioide fueron las alucinaciones, aunque solo ocurrió en el 7,14 % de los pacientes.
Las guías de la ASA (American Society of Anesthesiologists) recomiendan como el estándar de oro, mantener un dolor agudo posoperatorio bajo, esto correspondería en cualquier escala análoga visual o verbal numérica a un puntaje menor a 3.20 De acuerdo con lo anterior, se demostró que la técnica ALO utilizada permitió mantener a la mayoría de los pacientes libres de dolor desde el fin de la intervención y hasta las primeras 24 h evaluadas.
El adecuado tratamiento del dolor agudo posoperatorio, debe garantizar la analgesia de rescate, en los casos en que la pauta analgésica no logre el control de este. La presencia de prescripción de analgesia de rescate y ausencia de administración de esta puede considerarse como un indicador indirecto de la eficacia del tratamiento, puesto que conlleva que el paciente no ha experimentado dolor.
En base a las observaciones anteriores, en este estudio el analgésico de rescate fue el tramadol por vía intravenosa, el cual solo se administró en 5 pacientes (21,7 %) y 4 de ellos requirieron una sola dosis entre 50 y 75 mg. Lo que reafirma la calidad analgésica de la técnica utilizada, y que coincide con otras investigaciones reportadas.21
Chan y otros,22 analizaron la relación de la ketamina y el magnesio al comparar 44 pacientes obesos tratados por cirugía bariátrica. Todos ellos recibieron: acetaminofén intravenoso, un opioide de acción corta (remifentanilo o fentanilo), o uno de acción prolongada (morfina o buprenorfina).
Los sitios de los puertos de entrada de los trócares también fueron infiltrados con un anestésico local. La diferencia fue que 9 de los 44 pacientes recibieron solo ketamina, 5 pacientes recibieron solo magnesio, mientras que 30 pacientes recibieron tanto ketamina como magnesio. El estudio concluyó que la analgesia de rescate en la UCPA se administró al 56,8 % de los pacientes que recibieron ketamina y magnesio, mientras que los pacientes tratados con ketamina o magnesio requirieron analgesia de rescate a una tasa superior de (71,4 %).
El estudio tiene una pequeña muestra de población, pero los resultados indican que tanto la ketamina como el magnesio son útiles para controlar el dolor, los dos coadyuvantes juntos parecen proporcionar un mejor control del dolor. Esos resultados concuerdan con los obtenidos en la presente investigación, los que a su vez superan los reportados por Lam y otros,23 donde solo el 46,7 % de los pacientes no precisó tratamiento de rescate.
Es conocido que con la extubación y recuperación temprana de los pacientes anestesiados se reduce la frecuencia de complicaciones. Los tiempos totales de recuperación de la serie fueron bajos. Todos los pacientes pudieron ser extubados intraquirófano y se trasladaron a la UCPA en buenas condiciones clínicas y sin riesgos.
Para la administración de los agentes anestésicos intravenosos, se han descrito un número variable de fórmulas y ecuaciones en aras de buscar la mejor forma de administrarlos, algunas muy complejas, pero todas basadas en cálculos matemáticos que se acercan al perfil farmacocinético de las drogas.24
En la investigación se utilizaron dos escalas de las que mayormente se utilizan en la práctica clínica. El peso ideal según fórmula de Lemmens y el peso corregido con un factor de corrección del 40 %. Este último es aplicado con la intención de corregir el aumento del volumen de distribución y se utiliza para aproximarse de forma práctica al cálculo del peso magro. Por lo que es posible que los resultados observados en la serie de pacientes respondan a esta explicación.
Una de las ventajas de las técnicas libres de opioides es evitar los efectos adversos tan conocidos de estos fármacos.7 En la serie de pacientes estos fueron escasos y con poca repercusión clínica. Se presentaron en el 26,1 % y en su mayoría fueron de tipo cardiovascular, que por el número tan reducido no influyeron en las tendencias de las variables hemodinámicas. Otros efectos adversos que pudieran esperarse como las NVPO, recuerdos intraoperatorios y alucinaciones, fueron buscados, pero no se presentaron en ninguno de los pacientes.
En el estudio con más casos publicado hasta la fecha de Mulier y otros25 obtuvieron resultados similares a los de esta serie, e incluso aparecieron menos complicaciones en el grupo ALO que en el grupo control que empleó anestesia convencional con opioides.
Todos los estudios analizados indican que el tratamiento del dolor posoperatorio se puede alcanzar sin opioides o con una cantidad reducida de esto, al tiempo que se evitan sus efectos secundarios, lo que puede resultar en una disminución de la estadía en la UCPA. Esto último puede ser debatido, ya que algunos estudios no han mostrado significación estadística en la duración de la recuperación en la UCPA entre la anestesia general libre de opioides y la anestesia general basada en opioides. Sin embargo, lo que es bien sabido es que los mecanismos respiratorios en pacientes obesos ya están comprometidos, por lo que es imperativo evitar cualquier disminución adicional en la función ventilatoria.
Dentro de las limitaciones que presenta esta investigación están las propias de un estudio tipo serie de casos sin grupo control y con una muestra igualmente reducida de pacientes. También el tiempo de seguimiento de los pacientes fue limitado a 24 h posoperatorio, por lo que no se pudo obtener conclusiones pasado este tiempo.
No obstante, estudios observacionales como el aquí descrito son necesarios y exigidos por las comisiones hospitalarias de farmacia con el objetivo de conocer la efectividad y la seguridad a partir de la implantación de un nuevo protocolo hospitalario o para la realización de un ensayo clínico controlado y debidamente aleatorizado.
Se concluye que la técnica de anestesia multimodal libre de opioides utilizada en el paciente obeso, propuesto para cirugía bariátrica restrictiva laparoscópica resultó segura y efectiva. Se obtuvo un adecuado estado de analgesia perioperatoria con escasas complicaciones.