INTRODUCCIÓN
Más de 40 millones de personas en todo el mundo son prescritas con inhibidores de la enzima convertidora de angiotensina (IECA). Como consecuencia del envejecimiento progresivo de la población, se ha producido un aumento en la prevalencia de la hipertensión arterial, por esta razón los IECA pertenecen a los cinco tipos de medicamentos que se esperan sean los más usados en el mundo en el 2023.1) Estos fármacos constituyen la piedra angular en el tratamiento de diversas enfermedades, como la hipertensión arterial, nefropatía diabética o la insuficiencia cardíaca.1
Al igual que todos los medicamentos, los IECA presentan efectos secundarios potenciales, los más frecuentes son: tos persistente, mareo, cefalea, hipotensión, disgeusia y deterioro de la función renal en pacientes con estenosis de la arteria renal. El angioedema es un efecto adverso poco frecuente, con una incidencia de 0,1-0,5 %, pero potencialmente peligroso si compromete la vía aérea.2,3
Una de las principales causas de la interrupción del tratamiento por IECA es la aparición de tos y/o edema angioneurótico.2 El edema angioneurótico es una reacción adversa grave que puede provocar incluso la muerte; 4 no obstante, su mecanismo de acción no está claramente dilucidado, aunque varios autores consideran la acumulación de bradiquinina como un factor esencial y asociado causalmente al uso de estos medicamentos.2,3
Si bien el angioedema por IECA es un efecto adverso bien documentado, la baja frecuencia de su manifestación y la gravedad del cuadro clínico justifican su notificación y obligan a su rápido diagnóstico y tratamiento. Por ello se considera significativo alertar acerca de este potencial evento adverso asociado con la administración de IECA, que permita la actuación inmediata con la finalidad de reducir la morbimortalidad asociada.5,6
Por tales razones el propósito de este trabajo es presentar un caso de angioedema con mayor afectación de la lengua que ocurrió después del uso de enalapril por más de cuatro años. Se discuten sus mecanismos patogénicos, aún hoy poco conocidos, la dificultad diagnóstica y su manejo.
PRESENTACIÓN DEL CASO
Paciente masculino, de color de piel blanca, de 67 años de edad, con antecedentes patológicos personales de diabetes mellitus tipo 2, para lo cual llevaba tratamiento con metformina 500 mg en desayuno, almuerzo y comida, por aproximadamente siete años y antecedentes de hipertensión arterial para la que llevó tratamiento con enalapril 20 mg 2 veces/día e hidroclorotiazida 25 mg 1vez/día; este tratamiento lo había llevado el paciente por cuatro años.
En horas tempranas de la mañana comenzó con ligero entumecimiento de la lengua que en pocos minutos fue empeorando hasta aparecer edema severo de esta que le impedía la comunicación y la deglución, por lo que acudió a cuerpo de guardia.
Al interrogatorio, el paciente refirió no haber tenido eritema cutáneo ni prurito, fiebre ni sensación distérmica u alguna otra sintomatología por aparatos. No ingesta de otras sustancias no habituales.
En el examen físico se observaron las siguientes constantes vitales: TA de 180/90 mm Hg; FC de 100 l/m; FR: 26 respiraciones /minuto, saturación de O2 basal del 97 %. Estaba afebril, con buen estado general sin exantema cutáneo ni lesiones habonosas.
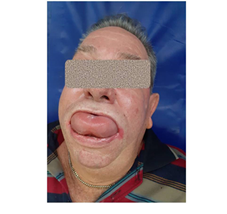
La exploración de la orofaringe se realizó con gran dificultad por el volumen de la lengua, fundamentalmente sus dos tercios distales, que hacían que protruyera hacia el exterior de la boca, distendiendo sus comisuras labiales hasta hacerlas sangrar. (Fig. 1)
Se observó gran edema del suelo de la boca, la úvula y el paladar blando ligeramente edematoso y enrojecido, vías aéreas superiores permeables, no dificultando la respiración; distención del cuello, ligero edema palpebral. La auscultación cardiopulmonar no reveló datos patológicos.
Se le administraron 300 mg de hidrocortisona y difenhidramina 25 mg por vía endovenosa. Además, se administraron 40 mg de furosemida por vía intramuscular para el tratamiento de las cifras elevadas de TA en ese momento.
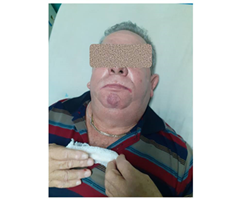
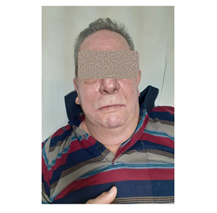
Se mantuvo en observación de urgencias. A las dos horas comenzó a disminuir el edema, cediendo en casi su totalidad en las siguientes dos horas. (Fig. 2 y Fig. 3).
Se le dio de alta sin complicaciones dos horas después y se suspendió el tratamiento con enalapril. Se inició tratamiento con amlodipino por vía oral, 10 mg cada 24 horas, se mantuvo la hidroclorotiazida y la metformina.
Se indicó, además, prednisona 10mg/d por vía oral durante tres días, difenhidramina 25mg/8 horas por vía oral y dieta hipoalergénica durante una semana. Se citó dentro de las 48 horas siguientes a control, encontrándose asintomático.
La decisión de mantener los otros fármacos como la hidroclorotiazida y la metformina que podrían plantearse como fármacos sospechosos, se basa en que la revisión bibliográfica realizada sugiere que probablemente el angioedema sea atribuible a enalapril. Sólo se ha descrito un caso de angioedema por metformina en una paciente que contaba con antecedentes de alergia a este fármaco o con hidroclorotiazida se ha observado en pacientes que toman combinaciones a dosis fijas con un IECA o un antagonista de los receptores para la angiotensina.6,7,8
Según las definiciones de caso de la Brighton Collaboration, y el Common Terminology Criteria for Adverse Events (CTCAE) versión 5.0, el evento fue clasificado como severo.10
Mediante el documento de Buenas Prácticas de Farmacovigilancia para las Américas. Washington, DC: diciembre del 2010,11 se pudo clasificar objetivamente el evento como de probable angioedema relacionado con la administración de enalapril, obteniéndose una categoría de causalidad inferior para hidroclorotiazida y la metformina.
Posteriormente el caso se comunicó al centro de farmacovigilancia de referencia de la provincia de Cienfuegos.
DISCUSIÓN
La patogenia del angioedema inducido por IECA es todavía hoy desconocida y no se considera de carácter inmunológico. La hipótesis más aceptada es que se encuentra mediado por la bradicinina, un potente vasodilatador, por lo que resulta así más un efecto farmacológico que una reacción adversa, la enzima de conversión de la angiotensina interviene en el catabolismo de la bradicinina.3,5 El bloqueo de la degradación de la bradiquinina es en parte responsable de la eficacia de los IECA, sin embargo, la acumulación excesiva de la bradiquinina conduce a angioedema por aumento en la permeabilidad vascular en las zonas afectadas.(12,13, 14)
El angioedema se caracteriza por áreas de edema, generalmente asimétrico, induradas, bien demarcadas, frecuentemente eritematosas, no pruriginosas, sin descamación y de rápida instalación.9) Afecta a las capas profundas de la piel y tejido celular subcutáneo. Puede ser único o múltiple. Las zonas más afectadas son los párpados, cara, labios, lengua, orofaringe, laringe y más raramente manos, pies y aparato digestivo.3,6,12
El periodo de latencia entre la toma del IECA y la aparición del angioedema es muy variable, desde las primeras semanas en 42-72 % de los casos hasta siete años después. No tiene relación con la dosis administrada; puede ocurrir con la primera dosis y con distintos tipos de IECA en un mismo enfermo. 6,12,13
Se ha establecido la incidencia de edema angioneurótico asociado a IECA en un 0,1-0,5 % de los pacientes en tratamiento con estos fármacos; y en la actualidad, parece ir en aumento, probablemente en relación con el incremento de la prescripción de este grupo farmacológico.3,5,12,13,14
Como factores predisponentes para su desarrollo se han descrito: pacientes de origen africano, pacientes con historia previa de angioedema por cualquier causa, deficiencia genética de otras enzimas y la deficiencia parcial del C1 inhibidor, la estrechez de la orofaringe, la obesidad, la cirugía o traumatismo previo en la cabeza y/o cuello, la interrupción del tratamiento (incumplimiento o interrupción y posterior reinicio) y la hemodiálisis (las membranas utilizadas activan la bradicinina y se potencia el efecto de los IECA). Recientemente se ha querido involucrar a la proteína C reactiva en su mecanismo patogénico.12,13
El mecanismo desencadenante no se encuentra totalmente establecido, aunque actualmente hay evidencias de que el aumento de los niveles de bradiquinina tiene un papel importante en la fisiopatología de los ataques, junto con los factores genéticos que hacen que ciertos individuos sean más susceptibles de desarrollar angioedema por IECA.12,13,14,15
La genética puede tener un papel importante en el angioedema debido a que la ECA degrada la bradiquinina, pero, cuando esta enzima está inhibida por los IECA, esta degradación es producida por la acción aminopeptidasa plasmática P (APP), los estudios han sugerido que una variante genética en el locus XPNPEP2, es parcialmente responsable de la bajada en la actividad de la APP y por tanto de la acumulación de bradiquinina, esto podría explicar que la incidencia en la población de raza negra americana sea cuatro veces mayor que en la de raza blanca, aunque serían necesario más estudios.16
Otros estudios invocan variaciones genéticas en la enzima neprilisina como causante del aumento en los niveles de bradicinina en estos pacientes. La neprilisina es esencial para el catabolismo de los péptidos endógenos vasoactivos, como la bradiquinina. La inactivación de la neprilisina resulta en el aumento de los niveles de estas sustancias.16
El cuadro clínico cede con la retirada del IECA del perfil farmacoterapéutico del paciente, y al tratarse de un efecto de clase, habría que plantearse sustituir el IECA correspondiente por otro fármaco de diferente grupo teniendo en cuenta que el angioedema también se ha relacionado con la administración de antagonistas de la angiotensina II.6,12,13
Ante la presencia de edema angioneurótico es fundamental la evaluación de la permeabilidad de la vía respiratoria mediante laringoscopia, garantizar las medidas de soporte vital básico, tanto respiratorio como circulatorio, los pacientes deben ser examinados, en búsqueda de evidencia de compromiso respiratorio como estridor, edema lingual, disnea, disfagia y sialorrea.5,12,13
En el manejo de la vía aérea se deben considerar la intubación traqueal u otras medidas de control, como cricotiroidotomía o traqueostomía, según las condiciones del paciente y del centro donde se atiende al enfermo. Si el paciente está hemodinámicamente inestable puede ser necesario reposición de volumen y terapia vasopresora. Si el diagnóstico no es claro, se puede considerar el tratamiento con antihistamínicos y corticoides si no hay contraindicación.5,12,15
Las medidas de soporte se deben mantener hasta que el edema de la vía aérea haya sido resuelto. Los pacientes intubados debieran ser evaluados por un otorrinolaringólogo previo a su extubación. Una vez resuelto el cuadro de edema angioneurótico se puede tratar al paciente en forma ambulatoria.5,12
El angioedema inducido por IECA es infrecuente, pero estos fármacos cuentan cada vez con más indicaciones y mayor número de pacientes tratados, consecuentemente se puede asistir a un aumento en la incidencia de este evento adverso que está bien documentado, pero dada la rara frecuencia de presentación y la gravedad del cuadro clínico, exigen tener un elevado índice de sospecha ya que en la mayoría de los casos, no existe correlación temporal inmediata entre la toma del fármaco y la reacción.6,12,13
El análisis del evento mediante la farmacovigilancia, permitió clasificarlo como severo, probablemente relacionado con el consumo de enalapril. Esto genera alertas para informar al personal de salud y tomar decisiones relacionadas con los medicamentos que permitan la actuación inmediata con la finalidad de reducir la morbimortalidad.10,17
Este caso muestra que, a pesar de la seguridad ampliamente conocida de los inhibidores de la ECA, existen efectos secundarios potencialmente mortales lo que constituye un desafío para futuras investigaciones para identificar los subgrupos de pacientes con mayor riesgo de presentar angioedema, en quienes el riesgo de recibir terapia con IECA es mayor que el beneficio.