Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Minería y Geología
versão On-line ISSN 1993-8012
Min. Geol. vol.34 no.2 Moa apr.-jun. 2018
ARTÍCULO ORIGINAL
Recuperación de hidróxido de magnesio en salmueras de la Puna argentina
Magnesium hydroxide recovery from brines in the argentine Pune
Horacio R. Flores1, Silvana K. Valdez1, Agustina M. Orce1
1Universidad Nacional de Salta, Argentina.
RESUMEN
En Argentina la explotación de salmueras con contenido económico de litio genera hidróxido de magnesio como residuo de las operaciones de purificación por precipitación química. Este trabajo aborda la recuperación del magnesio de muestras de salmueras, concentradas mediante evaporación, provenientes del salar de Pozuelos (Salta). Los ensayos de precipitación se realizaron a temperatura ambiente (20 ºC) y usando como agente precipitante el óxido de calcio en cantidades estequiométricas y con distintos excesos a 2 000 mL. El avance de reacción se determinó en un reactor tipo tanque agitado discontinuo de 2,5 L de capacidad; la velocidad de agitación fue constante e igual a 200 rpm. Se tomaron muestras de 100 mL luego de transcurridos 5, 15, 30 y 60 min; inmediatamente se separaron los sólidos mediante filtración al vacío y se determinó el contenido de magnesio en los líquidos por espectrofotometría de absorción atómica. Se encontró que el grado de avance de la reacción es independiente de la concentración inicial de magnesio, pero dependiente del valor de pH alcanzado luego del agregado del agente precipitante. Después de la purificación, las salmueras con alto contenido de magnesio (> 5 000 ppm) generan pulpas con bajos grados de filtrabilidad, característica que no varía ni aún con el agregado de floculantes para facilitar la operación de filtración.
Palabras clave: salmueras; recuperación de hidróxido de magnesio; salar de Pozuelos; precipitación química; sedimentación; filtración; floculante.
ABSTRACT
Exploitation of brines in Argentina with economical content of lithium generates magnesium hydroxide as a residue of the purification operations by chemical precipitation. This paper deals with the recovery of magnesium from brine samples, from salar de Pozuelos (Salta), concentrated by evaporation. The precipitation tests were carried out at room temperature (20 ºC), using calcium oxide as precipitator agent in stoichiometric quantities and in excess of 2 000 mL. The reaction progress was determined in a reactor of 2,5 L capacity; the agitation speed was constant and equal to 200 rpm. Samples of 100 mL were taken after 5, 15, 30, and 60 minutes; the solids were immediately separated by vacuum filtration and the magnesium content in the liquids was determined by atomic absorption spectrophotometry. The reaction progress degree is independent from the initial concentration of magnesium but dependent on the pH value reached after adding the precipitating agent. Brines with high magnesium content (> 5 000 ppm) generate pulps with low degrees of filterability after purifying, a characteristic that does not vary even with the addition of flocculants to facilitate the filtration operation.
Keywords: magnetic susceptibility; weathering crust; laterites; Eastern Cuba.
1. INTRODUCCIÓN
El hidróxido de magnesio se utiliza para la precipitación de metales pesados en la industria farmacéutica y de la construcción, como agente ignífugo y aislante acústico. En Argentina la explotación de salmueras con contenido económico de litio genera hidróxido de magnesio como residuo de las operaciones de purificación por precipitación química. La industria del litio se encuentra en expansión dado el auge del consumo mundial de litio en baterías de autos eléctricos y componentes electrónicos.
La región de la Puna, en el noroeste de Argentina, posee salares ricos en litio. Las salmueras de esta región son utilizadas como materia prima para la obtención de productos refinados de litio, tales como carbonato y cloruro. Asimismo las salmueras contienen otras sustancias como: NaCl, KCl, MgCl2, MgSO4, CaCl2 y Na2B4O7, entre otras. La Tabla 1 muestra la composición de diversos salares de la Puna argentina y de Sudamérica.
Para lograr la concentración de litio adecuada para la precipitación de la sal de interés la salmuera debe someterse a sucesivas operaciones de concentración y purificación. Durante esta última etapa deben eliminarse los iones que co-precipitarían junto con el Li2CO3, tales como: Mg2+ y Ca2+.
Las salmueras pueden procesarse mediante dos métodos, a saber:
· Concentración por evaporación solar y purificación mediante precipitación química por agregado de reactivos (método tradicional).
· Purificación empleando resinas de intercambio iónico y posterior concentración por evaporación solar.
Cuando se emplea el método tradicional precipitan sales de interés comercial en las etapas intermedias, entre ellas: NaCl, KCl, Mg(OH)2 y CaSO4, entre otros. Particularmente el Mg(OH)2 tiene diversas aplicaciones, tales como: ignífugo, aislante acústico y en la industria farmacéutica, entre otras. Li y otros investigadores (2014) estudiaron específicamente el comportamiento ignífugo del Mg(OH)2, relacionando este comportamiento con la estructura del Mg(OH)2, la cual depende, como ya se mencionó, de la fuente de obtención del hidróxido y de la temperatura del sistema.
Según Delbueno y demás colaboradores (2017) en el año 2016 la Argentina exportó alrededor de 40 000 t de Li2CO3, lo que implica que se deben procesar más de cuatro millones de metros cúbicos de salmuera que contienen magnesio entre 0,1 y 0,4 g Mg2+/100g de salmuera. Esto representa una producción entre 1 1500–4 6000 toneladas de Mg(OH)2. Así mismo, las proyecciones del gobierno nacional para el año 2021 indican que la producción aumentaría a 200 000 t de Li2CO3, lo que generaría una importante cantidad de residuo sólido que puede ser aprovechado con fines comerciales.
Se han estudiado diversos métodos para eliminar magnesio de soluciones acuosas y purificar salmueras. Hamzaoui y demás investigadores (2003) estudiaron la precipitación de Mg como carbonato y oxalato. Yi, Yan y Ma (2009) trabajaron con resinas de intercambio iónico para purificar soluciones concentradas en litio. Woong-An y otros colaboradores (2012) evaluaron diferentes alternativas para recuperar Mg y B y reducir los niveles de Ca2+ y SO42- de salmueras del salar de Uyuni. Tran y demás especialistas (2016) estudiaron la recuperación de magnesio del mismo salar precipitándolo como carbonato de magnesio hidratado.
El uso de cal permite la precipitación del magnesio, sulfato y boro presentes en la salmuera. Huang (2008) utilizó el software Stabcal para predecir las condiciones en que pueden separarse de forma selectiva Mg y Ca empleando cal. Concluyó que el Mg puede precipitarse como Mg(OH)2 a pH>8,6; la concentración de sulfato puede reducirse a <1 g/L precipitándolo como yeso (CaSO4.2H2O), en un rango de valores de pH desde 2 hasta 12; mientras que los sólidos (CaO)n∙B2O3 (n=2 o 3) pueden formarse a valores de pH>11,5.
La cal es el mejor agente precipitante para eliminar el Mg de la salmuera como Mg(OH)2, incluso cuando se agrega en cantidades apenas por encima de la estequiométrica (Woong-An et al. 2012). El sólido se forma a valores de pH superiores a 8,6 y es una mezcla de yeso, Mg(OH)2, (CaO)n.B2O3 y el exceso de Ca(OH)2 agregado. De este proceso se obtiene un Mg(OH)2 muy fino y poco cristalino lo que dificulta la operación necesaria para la separación de la salmuera altamente viscosa (Baird et al. 1988). Gao y un grupo de expertos (2008) estudiaron la influencia de la fuente de magnesio sobre el comportamiento del Mg(OH)2 durante su cristalización. Para ello examinaron la difusión de amoníaco, en caliente, en soluciones de cloruro de magnesio y dodecilsulfato de magnesio.
El tamaño y la forma de las partículas influye significativamente en el proceso de filtración, especialmente en la resistencia y la compresibilidad de la torta (Bourcier et al. 2016; Beck y Andreassen 2012; Beck et al. 2009; Wakeman 2007; Häkkinen 2009). Wakeman (2007) determinó las propiedades ideales que deben cumplir las partículas para minimizar la resistencia específica de la torta, a saber: gran tamaño, forma esférica y distribución de tamaño homogénea. El hidróxido de magnesio forma un precipitado gelatinoso, lo que dificulta su separación de la salmuera.
En este trabajo se estudió la eficiencia en la recuperación de magnesio de salmueras de la Puna argentina. Se analizó la influencia del pH en el avance de la reacción. Se estudiaron, además, las operaciones de sedimentación y filtración al vacío de los sólidos obtenidos.
2. MATERIALES Y MÉTODOS
Se prepararon muestras de salmueras provenientes del salar de Pozuelos (Salta, Argentina), las cuales fueron concentradas mediante evaporación. La composición química y las propiedades fisicoquímicas de las salmueras tratadas se muestran en la Tabla 2.

Como agente precipitante se utilizó óxido de calcio calidad comercial. La reactividad de la cal se comprobó mediante el método de la sacarosa que permite determinar el calcio activo. En este caso la reactividad fue igual a 0,84.
Para los ensayos de precipitación se agregó CaO en cantidades estequiométricas y con distintos excesos a 2 000 mL de cada salmuera. Estas cantidades se establecieron teniendo en cuenta la reactividad de la cal. Los ensayos se llevaron a cabo a temperatura ambiente (20 ºC).
Para determinar el avance de reacción se utilizó un reactor tipo tanque agitado discontinuo de 2,5 L de capacidad. La velocidad de agitación fue constante e igual a 200 rpm. Se tomaron muestras de 100 mL cada una; luego de 5, 15, 30 y 60 min. Una vez tomada la muestra los sólidos se separaron inmediatamente mediante filtración al vacío y se estipuló el contenido de Mg en los líquidos a través de espectrofotometría de absorción atómica.
El avance de la reacción (h) es función de la concentración inicial de Mg presente (Mgi) y de su concentración a un tiempo t (Mgt) luego del agregado de cal según la ecuación 1.
![]() (1)
(1)
Se estudió la influencia de la concentración inicial de magnesio sobre la sedimentación empleando 500 mL de pulpa producto de la reacción, en probetas graduadas de 500 mL y 25 cm de altura. Se realizó la sedimentación con el agregado de floculante y sin este, y se compararon los resultados. Se utilizó 0,5 y 1 mL de un floculante aniónico (Paestrol 2530 medio) en concentración igual a 0,5 %. Los resultados se expresaron en función de la relación entre la altura de la torta (htorta) y la altura total de la pulpa (htotal). Esta relación es una medida de la cantidad de salmuera ocluida en el sólido.
![]() (2)
(2)
Los ensayos de filtración al vacío también se realizaron utilizando 500 mL de la pulpa. La filtración se realizó empleando una diferencia de presión constante de 400 mmHg. Se determinó el peso y la humedad de los sólidos, así como también el volumen de líquido filtrado (Vf) en función del tiempo (t), su peso, pH y contenidos de magnesio.
Para establecer las localizaciones se revisó la información contenida en trabajos previos, textos y artículos técnicos que sirvieron como guía y soporte para el estudio, generalidades geológicas del campo Tía Juana Lago y del yacimiento B6 LL 370, historias de pozos, reportes e informes.
3. RESULTADOS Y DISCUSIÓN
3.1. Precipitación: reacción química-influencia del pH
En el método tradicional, el magnesio se elimina por precipitación química mediante el agregado de cal, de acuerdo con las reacciones 3 y 4
Hidratación de cal:
![]() (3)
(3)
Precipitación del magnesio:
![]() (4)
(4)
En la práctica, el agregado de cal a las salmueras debe realizarse hasta lograr una concentración de magnesio inferior al correspondiente a la solubilidad del Mg(OH)2. En agua pura a 20 ºC esta es 4,1 mg Mg2+/L (Linke 1965), sin embargo, es de esperar que la solubilidad del hidróxido de magnesio en la salmuera difiera respecto a su solubilidad en agua por la presencia de otros iones.
Debido a que cada salmuera posee composiciones diferentes es conveniente adoptar como variable de control o indicador el valor del pH. Para ello se calculó, en un principio, en forma teórica con el valor de la constante de solubilidad en agua pura del Mg(OH)2 (Kps=5,61x10-12) (Brown, Le-May y Bursten 1998; Chang 2002), determinándose que para que precipite la totalidad del magnesio presente (como hidróxido) el valor de pH debe ser, como mínimo, igual a 10,3. En la Tabla 3 se muestra la cantidad de cal que fue agregada a cada salmuera durante los ensayos.
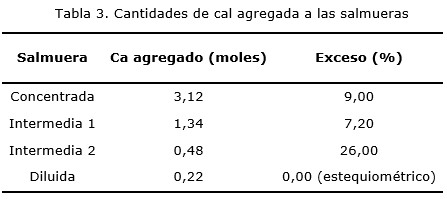
La Figura 1 muestra el grado de avance de la reacción para las salmueras tratadas.
De la Figura 1 se observa que la salmuera diluida no alcanzó la conversión total, aun cuando los reactivos se encontraban en cantidades estequiométricas. Este resultado se corresponde con el valor de pH alcanzado, menor que el calculado a partir del valor del Kps del hidróxido de magnesio en agua pura.
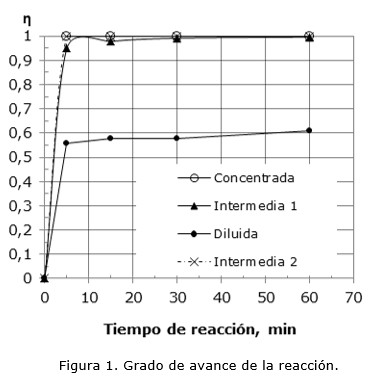
En la Figura 2 se observan los valores de pH conseguidos por las salmueras durante los ensayos de precipitación. Independientemente de la concentración inicial de magnesio, el máximo avance se alcanza con valores de pH superiores a 10. Se percibe que se llega al máximo grado de avance a los 5 min. En el caso de la salmuera Intermedia 2 se advierte que no se alcanzó el valor de pH constante, lo que implica que la reacción no alcanzó el equilibrio. Sin embargo, observando la Figura 1 se nota que esta solución se encontraba cercana al máximo avance.
Lo expuesto anteriormente difiere con lo reportado por Huang (2008), quién estudió las salmueras del salar de Uyuni y que, utilizando el software Stabcal, determinó que la máxima conversión se alcanza a pH>8,6. Esta diferencia demuestra la necesidad de realizar ensayos experimentales, ya que los softwares disponibles no pueden predecir con precisión el comportamiento de las salmueras debido a la gran concentración de iones presentes.
3.2. Sedimentación y filtración
Los ensayos de sedimentación se realizaron con las salmueras identificadas como Intermedia 1 y Concentrada. El tiempo de sedimentación fue igual a 24 h.
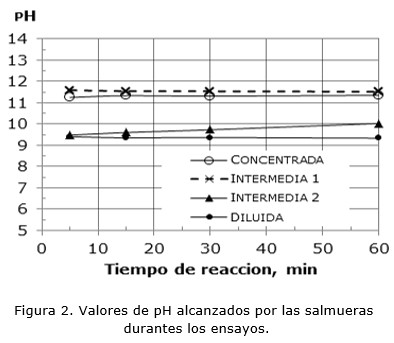
En la Figura 3 se observa que al aumentar la concentración inicial de Mg2+ aumenta también la concentración de sólidos en la pulpa. La alta concentración de sólidos dificulta la sedimentación debido a que el Mg(OH)2 forma una masa gelatinosa en lugar de un sólido cristalino. En la misma figura se advierte que la relación ht/hT (htorta/hTotal) se incrementa abruptamente cuando la concentración de Mg se encuentra entre 4 600-16 000 ppm, alcanzando valores cercanos a 1, lo que implica que el volumen de la pulpa tiene la altura máxima y no se puede separar el sólido de la solución por sedimentación.
En el caso de la filtración a presión contante, el volumen de líquido filtrado también varía de acuerdo a la concentración inicial de Mg2+. La Figura 4 muestra los resultados obtenidos de los ensayos de filtración al vacío, realizados sobre pulpas con baja, media y alta concentración de sólidos. En todas ellas se utilizó 0,5 mL de floculante. Para pulpas con baja concentración de sólidos el proceso de filtración es rápido, en menos de tres minutos se obtiene el máximo volumen de filtrado. Las pulpas obtenidas de la solución Concentrada tienen 31,7 % de sólidos, los cuales obstruyen prematuramente el filtro haciendo casi imposible la filtración, lo que implica una mínima recuperación de salmuera purificada. Debe tenerse presente que el fin último de este procesamiento es separar el sólido de la salmuera, por lo tanto a mayor concentración de sólidos en la pulpa mayor será la humedad remanente, dificultándose los procesos posteriores de secado. Debe considerarse también que la salmuera ocluida se encuentra enriquecida en litio, por lo que se origina una pérdida de este valioso recurso (Valdez et al. 2016).
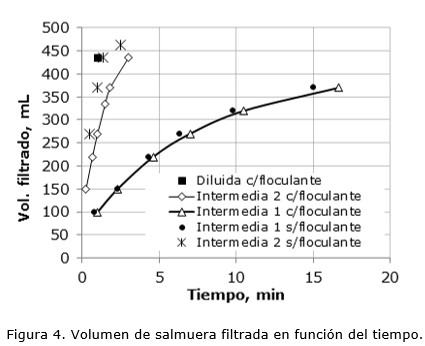
Se distingue que el agregado de floculante no contribuye con el proceso de filtración en cuanto al tiempo necesario para obtener el mismo volumen de filtrado. En lo referido a la solución Diluida el volumen filtrado obtenido fue el mismo, independientemente del uso de floculante. La solución Intermedia 2 sin floculante alcanza un mayor volumen de filtrado en menor tiempo que cuando se emplea floculante. Esto se debe a que los flóculos obstruyen el filtro obstaculizando la operación.
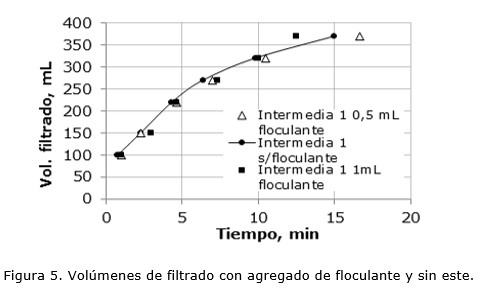
Se realizaron ensayos de filtración con la solución Intermedia 1, buscando obtener una mayor cantidad de volumen filtrado, agregando una cantidad mayor de floculante (1,0 mL); los resultados se muestran en la Figura 5.
Como se concluyó anteriormente, el agregado de floculante no contribuye con el proceso de filtrado. Como era de esperarse, a mayor concentración de magnesio inicial, mayor el tiempo necesario para obtener el mismo volumen de filtrado. La solución Intermedia 1 contiene 3,3 veces más magnesio que la solución Intermedia 2; así mismo para obtener un volumen de filtrado igual a 370 mL la solución Intermedia 2 necesita un minuto de filtrado mientras que la Intermedia 1 necesita 15 min.
4. CONCLUSIONES
La cal es un agente precipitante efectivo y económico para separar magnesio durante el proceso de obtención de carbonato de litio a partir de salmueras.
El grado de avance de la reacción entre la cal y el magnesio es independiente de la concentración inicial de magnesio en la solución. Se demostró la dependencia entre el grado de avance y el valor de pH alcanzado luego del agregado de cal, determinándose que para obtener el máximo avance el pH final de la solución debe ser ≥10. Así mismo, el exceso de cal agregado no influye sobre el valor de pH que se alcanza luego de la reacción, por lo que se recomienda que este exceso se encuentre en un rango entre 5-10 %.
De las reacciones de precipitación se obtienen pulpas cuya concentración de sólidos influye directamente en el tiempo necesario para separar el sólido del líquido y en la humedad de la torta. Salmueras con altas concentraciones de magnesio redundan, luego de la precipitación de magnesio, en pulpas con concentraciones de sólidos altas, lo que hace prácticamente imposible su filtración y la recuperación de salmuera. Este proceso de separación sólido-líquido resulta de vital importancia tanto para recuperar un subproducto de interés industrial (Mg(OH)2) como la salmuera enriquecida en litio. Cuanto menor sea la cantidad de salmuera ocluida en el sólido menor será el tiempo necesario de lavado y secado del mismo.
5. REFERENCIAS
Baird, T.; Braterman, P. S. y Cochrane, H. D. 1988: Magnesium hydroxide precipitation as studied by gel growth methods. Journal of crystal growth, 91(4): 610-616.
Beck, R. y Andreassen, J. P. 2012: Influence of crystallization conditions on crystal morphology and size of CaCO3 and their effect on pressure filtration. AIChE Journal, 58(1): 107-121.
Beck, R.; Häkkinen, A.; Malthe-Sørenssen, D. y Andreassen, J. P. 2009: The effect of crystallization conditions, crystal morphology and size on pressure filtration of L-glutamic acid and an aromatic amine. Separation and Purification technology, 66(3): 549–558.
Bourcier, D.; Féraud, J. P.; Colson, D.; Mandrick, K.; Ode, D.; Brackx, E. y Puel, F. 2016: Influence of particle size and shape properties on cake resistance and compressibility during pressure filtration. Chemical Engineering Science, 144: 176–187.
Brown, T. L.; Le-May, H. R. Jr. y Bursten, B. E. 1998: Química: la ciencia central. 3 ed. Naucalpan de Juárez: Prentice-Hall Hispanoamericana. 68 p. ISBN: 9701701690.
Chang, R. 2002: Química. 7 ed. México: McGraw-Hill. 1001 p. ISBN: 970-10-3894-0.
Delbueno, V.; Such, T.; Toledo, E. y Jerez, D. 2017: Mercado del litio. Situación actual y perspectivas. Ministerio de Minería y Energía de la Nación, Buenos Aires, Argentina. Consulta: jul 2017. Disponible en: http://scripts.minem.gob.ar/octopus/archivos.php?file=7252
Gao, Y.; Wang, H.; Su, Y.; Shen, Q. y Wang, D. 2008: Influence of magnesium source on the crystallization behaviors of magnesium hydroxide. Journal of Crystal Growth, 310(16): 3771-3778.
Häkkinen, A. 2009: The Influence of Crystallization Conditions on the Filtration Characteristics of Sulphathiazole Suspensions. Lappeenranta University of Technology, Finland. Disponible en: http://www.doria.fi/handle/10024/50669
Hamzaoui, A. H.; M’nif, A.; Hammi, H. y Rokbani, R. 2003: Contribution to the lithium recovery from brine. Desalination, 158(1-3): 221-224.
Huang, H. 2008: Stabcal Software. University of Montana. Montana Tech, USA.
Li, X.; Shi, T.; Chang, P.; Hu, H.; Xie, J. y Liu, Y. 2014: Preparation of magnesium hydroxide flame retardant from light calcined powder by ammonia circulation method. Powder Technology, 260: 98-104.
Linke, W. F. 1965: Solubilities. American Chemical Society, Washington, D.C.
Tran, K. T.; Han, K. S.; Kim, S. J.; Kim, M. J. y Tran, T. 2016: Recovery of magnesium from Uyuni salar brine as hydrated magnesium carbonate. Hydrometallurgy, 160: 106–114.
Valdez, S.; Flores, H.; Orce, A. y Kwok, L. 2016: Influence of the evaporation rate over lithium recovery from brines. World Journal of Research and Review, 3(1): 66-70.
Wakeman, R. 2007: The influence of particle properties on filtration. Separation and Purification Technology, 58(2): 234–241.
Woong-An, J.; Jun-Kang, D.; Tran, K.; Jun-Kim, M.; Lim, T. y Tran, T. 2012: Recovery of lithium from Uyuni salar brine. Hydrometallurgy, 117–118: 64–70.
Yi, W.; Yan, C. y Ma, P. 2009: Removal of calcium and magnesium from LiHCO3 solutions for preparation of high-purity Li2CO3 by ion-exchange resin. Desalination, 249(2): 729–735.
Recibido: 07/11/17
Aceptado: 09/02/18
Horacio R. Flores, Ingeniero Químico. Profesor Titular. Universidad Nacional de Salta, Argentina hrflores@unsa.edu.ar














