Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Cuban Journal of Agricultural Science
versão On-line ISSN 2079-3480
Cuban J. Agric. Sci. vol.51 no.1 Mayabeque ene.-mar. 2017
REVISIÓN
Activadores ruminales, aspectos generales y sus ventajas en la alimentación de animales rumiantes
Ruminal activators, general features and their advantages for feeding ruminants
Juana Galindo, A. Elías, E. Muñoz, Yoandra Marrero, Niurca González and Areadne Sosa
Apartado Postal 24, San José de las Lajas, C.P. 32700, Mayabeque, Cuba
RESUMEN
Se compendia información relacionada con los activadores ruminales, su mecanismo de acción y su función en los procesos fermentativos que se producen en el rumen de los animales. Se estructura en cuatro acápites: 1) particularidades del sistema digestivo de los rumiantes, 2) ecosistema microbiano ruminal, 3) manipulación de los procesos fermentativos del rumen y 4) activadores ruminales. Se presenta el rumen como el mayor de los compartimientos preestomacales de los rumiantes, con uno de los ecosistemas más complejos de la naturaleza. En este se integran bacterias, hongos, protozoos, bacteriófagos y, de manera ocasional, levaduras y productos finales de la fermentación (ácidos orgánicos, amoníaco y gases, entre otros). Los procesos fermentativos que se producen en este órgano se pueden manipular con la aplicación de diferentes estrategias, encaminadas a modificar los sitios sensibles para el desarrollo microbiano, producción de enzimas, productos finales de la acción microbiana, específicamente el patrón de fermentación, pasaje de nutrientes, entre otros. Entre las vías que se pueden emplear para manipular la fermentación ruminal se encuentra el uso de activadores ruminales. Estos incrementan la utilización digestiva de los alimentos que consumen los animales, lo que se traduce en mayor consumo voluntario, producción de leche, carne y lana.
Palabras clave: rumen, bacterias, hongos, protozoos, AGV
ABSTRACT
This paper compiles information related to ruminant activators, their action mechanism and their function in fermentative processes produced in the rumen of the animals. It is composed by four sections: 1) particularities of the digestive system of ruminants, 2) ruminal microbial ecosystem, 3) manipulation of rumen fermentative processes and 4) ruminal activators. Rumen is presented as the largest of the pre-stomach compartments of ruminants, with one of the most complex ecosystems in nature. It integrates bacteria, fungi, protozoa, bacteriophages and, occasionally, yeasts and final products of fermentation (organic acids, ammonia and gases, among others). Fermentative processes that occur in this organ can be manipulated with the application of different strategies, aimed at modifying sensitive sites for microbial development, enzyme production, final products of microbial action, specifically the fermentation pattern, nutrient passage, and some others. One of the procedures for manipulating ruminal fermentation is the use of ruminant activators. These increase the digestive utilization of food consumed by the animals, which is transformed into higher voluntary intake and milk, meat and wool production.
Key words: rumen, bacteria, fungi, protozoa, VFA
INTRODUCCIÓN
En los animales rumiantes, la mayor parte de la energía y de la proteína disponible se genera a partir de la fermentación ruminal. Los ácidos grasos volátiles proveen energía para los procesos metabólicos en estas especies. La proteína microbiana se produce a partir de la fermentación de los diferentes compuestos nitrogenados (proteína verdadera y nitrógeno no proteico) y de la energía disponible en el rumen, además de constituir la fuente proteica principal para el animal (la mayor parte de la proteína metabolizable) en condiciones normales de alimentación.
Desde hace muchos años, los nutricionistas trabajan en la manipulación de los procesos de fermentación ruminal, con el propósito de alcanzar sincronización entre los metabolismos energéticos y nitrogenados en el rumen y, consecuentemente, elevar la respuesta productiva de los animales (Di Lorenzo et al. 2015, Henry et al. 2015 y Mercadante et al. 2015).
Esta revisión tiene como objetivo recopilar la información relacionada con los activadores ruminales, el mecanismo de acción de los mismos y su función en los procesos fermentativos que se producen en el rumen de los animales.
PARTICULARIDADES DEL SISTEMA DIGESTIVO DE LOS RUMIANTES
Los rumiantes presentan características distintivas con respecto al resto de los mamíferos porque el rumen y el retículo, dos de los compartimientos preestomacales, se encuentran habitados por una de las más variadas, densas y activas poblaciones microbianas conocidas en la naturaleza (protozoos, bacterias, hongos y bacteriófagos), que desempeñan una función significativa en la degradación del alimento que consumen los animales (Galindo y Marrero 2005 y González et al. 2011).
El retículo-rumen no produce enzimas capaces de hidrolizar las uniones β 1,4 y 1,6 glucosídicas presentes en la celulosa y otros componentes que constituyen las paredes celulares de los vegetales. Sin embargo, contiene un ecosistema ruminal con el mayor complejo enzimático que se conoce, sitio principal de degradación de la celulosa, hemicelulosa y lignina presentes en los materiales fibrosos (Kung et al. 2000, Galindo et al. 2004, Masai et al. 2007 y Martínez-Anaya et al. 2008).
El rumen es el reservorio más voluminoso del sistema digestivo y representa del 70 al 75 % del tracto gastrointestinal. La comunidad microbiana que lo habita se caracteriza por su alta densidad de población, amplia diversidad y complejidad de interacciones. En este órgano se encuentran representantes de los tres dominios: bacteria, archaea y eucarya. Contiene un gran número de bacterias (más de 1011 células∙mL-1, que comprenden aproximadamente 200 especies), protozoos ciliados (104-106 células∙mL-1 distribuidos en 25 géneros), hongos anaerobios del rumen (103-105 zoosporas•mL-1 divididos en seis géneros) y bacteriófagos (107-109 partículas∙mL-1) (Mackie et al. 2002 y Kamra 2005). Los diferentes grupos microbianos pueden cambiar significativamente con el tiempo. Desde el punto de vista agrícola, entre los factores que provocan estos cambios, el más importante es la dieta del animal hospedero, aunque también influyen otros aspectos como la edad del animal, la estación del año y el uso de terapéuticos y antibióticos promotores del crecimiento (Edwards et al. 2008).
Como en cualquier otro ecosistema, las poblaciones presentes en el rumen interactúan entre sí. Un ejemplo de ello es la importante relación entre microorganismos celulolíticos y no celulolíticos en la degradación de los forrajes. Los productos de la hidrólisis de la celulosa por Ruminococcus flavefaciens y Fibrobacter succinogenes sirven de sustrato para el crecimiento de Selenomonas ruminantium. A su vez, la desaparición de estos productos estimula la degradación de la fibra por las dos primeras (Sawanon y Kobayashi 2006). Durante la digestión de la fibra, F. succinogenes y R. flavefaciens producen succinato, que se convierte a propionato por S. ruminantium. Otro caso de relación positiva es la que se establece entre algunos protozoos y arqueas metanogénicas. Los metanógenos se adhieren a los entodiniomorfos, cuando el H2 es limitante, y les suministran la vitamina B12 que estos no son capaces de sintetizar (Tokura et al. 1997). También se observan relaciones de competencia entre las especies por los sustratos que necesitan. Un ejemplo de ello es la reducción en la colonización de las paredes celulares de las plantas por hongos con la presencia de Ruminococcus albus y R. flavefaciens (Dehority y Tirabasso 2000).
EL ECOSISTEMA MICROBIANO RUMINAL
Las bacterias constituyen la mayor y más diversa comunidad microbiana presente en el rumen, donde realizan varias de las funciones vitales. Entre ellas se encuentran especies con tipos morfológicos y agrupaciones variadas. De acuerdo a la utilización de sustratos y productos finales que producen, las bacterias del rumen se clasifican en celulolíticas, hemicelulolíticas (Koike y Kobayashi 2001), amilolíticas, proteolíticas, fermentadoras de azúcares, bacterias que utilizan los ácidos, metanogénicas (Whitford et al. 2001, Cheng et al. 2009), lipolíticas, pectinolíticas y bacterias sintetizadoras de vitaminas y de aminoácidos como fuente de energía (Edwards et al. 2004 y Stevenson y Weimer 2007). También se presentan en cantidades diferentes según la especie animal y la dieta que consumen (Sun et al. 2008, Welkie et al. 2010 y Yang et al. 2010).
Los protozoos son organismos que presentan un tamaño relativamente grande (entre 15 y 200 micras). Son anaerobios estrictos y comúnmente se dividen en dos grupos: holotricos y entodiniomorfos. Los holotricos tienen la superficie del cuerpo cubierta de cilios y su forma es ovalada o redondeada. Son móviles y utilizan carbohidratos no estructurales, fundamentalmente solubles. Los entodiniomorfos son más complejos, en cuanto a su morfología, y más específicos en sus requerimientos nutritivos (Kamra 2005).
Los protozoos representan hasta 40 % del nitrógeno microbiano total y son responsables de 25 % de la actividad celulolítica en el rumen (Jouany 1996, Michalowski et al. 2001 y Béra-Maillet et al. 2005). Se consideran como estabilizadores del pH, debido a que engolfan gránulos de almidón que provienen de la dieta y de esta forma, suprimen el daño potencial de la fermentación amilolítica bacteriana a ácido láctico y previenen desórdenes nutricionales de la acidosis láctica (Belzecki y Michalowski 2002). Disminuyen la eficiencia de utilización de la proteína mediante la ingestión de bacterias, zoosporas de hongos, proteínas de las plantas y aminoácidos libres, que consume el hospedero (Williams y Coleman 1992, Koenig et al. 2000, Nhan et al. 2001 y Santra y Karim 2002). Por estas y otras características, los protozoos afectan la velocidad de crecimiento del animal, la digestibilidad de la ración y la calidad y cantidad de la proteína microbiana disponible a nivel intestinal.
Los hongos anaerobios del rumen pertenecen al orden de los Neocallimastigales, de la división Neocallimastigomycota. Hasta la fecha se han descrito seis géneros, con más de 20 especies (James et al. 2006 y Chen et al. 2007).
Estos microorganismos tienen gran habilidad para colonizar paredes celulares lignificadas y debilitar los tejidos fibrosos de las plantas (Edwards et al. 2008). Poseen una potente batería enzimática (celulasas, xilanasas y esterasas), que les permite la degradación de los componentes estructurales de la pared celular de las plantas y la fermentación de los monosacáridos resultantes (Srinivasan et al. 2001 y Rezaeian et al. 2005). Por utilizar sustratos que son menos accesibles a las bacterias y protozoos, desempeñan una función estratégica en la digestión de alimentos fibrosos y son tan importantes en la digestión de forrajes de baja calidad (Lee et al. 2000).
El ecosistema ruminal se integra además, por productos finales de la fermentación microbiana que se produce en el órgano, entre ellos los ácidos grasos volátiles (AGV) y otros ácidos, amoníaco, gases y otros.
MANIPULACIÓN DE LOS PROCESOS FERMENTATIVOS DEL RUMEN
Manipular la fermentación ruminal no es más que utilizar un conjunto de estrategias con el propósito de activar o modificar los sitios sensibles de desarrollo microbiano, producción de enzimas y productos finales de la acción microbiana, específicamente el patrón de fermentación y el pasaje de nutrientes, entre otros. Este concepto ha sido descrito en Cuba por Marty (1972), como alternativa para los países cuya base alimentaria para el ganado está compuesta por alimentos fibrosos de baja calidad. Desde entonces, este concepto se ha ampliado y en la actualidad se puede emplear para modificar la fermentación microbiana ruminal, en dependencia del propósito que se desee (Galindo y Marrero 2005 y Edwards et al. 2008).
Los aspectos fundamentales que se deben considerar para la modulación en la fermentación ruminal son los siguientes:
- Establecer una fermentación eficiente mediante la optimización del crecimiento microbiano, al incrementar la eficiencia de síntesis de proteína microbiana ruminal (Pierre et al. 2013), maximización de la digestión de la fibra, producción de AGCC, estimulación de la producción de propionato, reducción de la producción de metano (Abdalla et al. 2008, 2012 y Abecia et al. 2012), control de la producción de lactato y del pH ruminal (Sosa et al. 2007 y Galindo et al. 2009).
- Lograr un metabolismo y balance de nutrientes eficiente.
- Considerar la nutrición de los microorganismos del rumen y la del animal hospedero.
- Garantizar el aporte de proteína de sobrepaso, que provee de aminoácidos esenciales al animal.
- Suministrar almidón de sobrepaso, que provee suministro de glucosa adicional
- Suministrar lípidos, que contienen ácidos grasos de cadena larga para la síntesis de tejidos y grasa de la leche.
Una de las prácticas más acertadas y relativamente fáciles de realizar en materia de manipulación, es balancear la dieta considerando los requerimientos nutricionales del animal y de los microorganismos que habitan en el rumen (Elías 2000 y Zebeli et al. 2010). Para manipular la fermentación microbiana ruminal a partir de la dieta que se suministra, se pueden utilizar dos vías: optimizar la fermentación mediante el empleo de diferentes métodos de manejo de la ración y modificar el alimento antes de su suministro a los animales.
En Cuba, el Instituto de Ciencia Animal desde hace más de 40 años trabaja en diferentes técnicas para lograr mayor eficiencia en la fermentación ruminal, pero no es hasta 1996 que se conduce un proyecto que integra todas las investigaciones con el concepto de Manipulación de la Fermentación Ruminal. Los resultados obtenidos son útiles en la integración de tecnologías aplicadas a los sistemas productivos (Galindo y Marrero 2005). A partir de este concepto se evaluaron de manera exitosa los activadores ruminales.
LOS ACTIVADORES RUMINALES
Los activadores ruminales son productos capaces de manipular los procesos fermentativos que se producen en el rumen e incrementar la utilización digestiva de los alimentos que consumen los animales, lo que se traduce en incremento del consumo voluntario, producción de leche, carne y lana (Carro y Ranilla 2002, Díaz et al. 2005, 2009, 2011 y Galindo y Marrero 2005).
Los activadores se pueden elaborar en forma líquida, sólida, granulada, sólida compacta o como bloques multinutricionales (BMN). Se caracterizan porque se deben suministrar en pequeñas cantidades y formularlos de manera que los animales regulen su consumo durante
24 horas. Es decir, no deben consumirlos una sola vez, ya que las pequeñas dosis que arriban al rumen en cada momento del día son capaces de activar la flora microbiana que vive en ese reservorio. Esto garantiza que el rumen se mantenga como una gran cámara de fermentación continua.
La cámara de fermentación continua es un sistema o procedimiento en el que ingresan constantemente los alimentos frescos, solución nutritiva y saliva, que se mezclan con la masa en proceso de fermentación, en el que se produce flujo de salida constante.
En sentido general, el ecosistema ruminal se garantiza por el aporte regular de nutrientes para los microorganismos y el animal hospedero, procedentes de la ingestión de alimentos; la eliminación continua de productos finales del metabolismo (por absorción directa a través de las paredes del rumen o por pasaje hacia las partes bajas del tracto gastrointestinal y por eructación) y la atmósfera relativamente constante de gases situados al nivel del saco dorsal.
Uno de los principios en los que se sustenta la tecnología de los activadores ruminales consiste en garantizar que en cada momento del día exista en el rumen los nutrientes necesarios para la síntesis de proteína microbiana. Si en un momento determinado arriban al rumen alimentos, se rompe el equilibrio microbiano y, consecuentemente, se producen desórdenes y pérdida de nutrientes por excreción. La alimentación, una vez al día, produce grandes disminuciones en el pH y en los conteos de protozoos y bacterias ruminales, el que será más o menos drástico en dependencia del tipo de dieta que reciben los animales. Por el contrario, el suministro de pequeñas cantidades varias veces al día, produce variaciones más pequeñas, ya que el rumen se asemejará más al modelo de fermentación continua antes explicado.
VENTAJAS DEL USO DE LOS ACTIVADORES RUMINALES
Los activadores ruminales incrementan la población de bacterias viables totales, celulolíticas y hongos celulolíticos en el rumen; estimulan la función digestiva del rumen, por lo que incrementan el consumo y la digestibilidad de pastos y otros alimentos fibrosos de baja calidad; mantienen el pH del rumen en rangos óptimos para la celulolisis ruminal; incrementan la concentración de amoníaco (NH3) y la concentración de ácidos grasos de cadena corta en el rumen (AGCC); aumentan la producción de leche y el estado reproductivo de los animales y mejoran la ganancia de peso vivo en el ganado, así como su estado físico y de salud.
En el Instituto de Ciencia Animal de Cuba se han realizado numerosas investigaciones relacionadas con el uso de los activadores ruminales, entre ellos se destacan los denominados suplementos nitrogenados activadores (SNA). Estos consisten en formulaciones que abarcan diferentes relaciones de nitrógeno no proteico (NNP) y proteína verdadera (PV), así como la adición de pre-mezclas de vitaminas y minerales. Estos suplementos nitrogenados se utilizaron, primeramente, para activar las poblaciones microbianas ruminales de animales que consumieron forraje de caña de azúcar. La tabla 1 presenta diferentes formulaciones de SNA.
Los SNA se han utilizado en dietas de bajo valor proteico, como son las dietas basado en caña de azúcar (Muñoz et al. 1986 y Galindo et al. 2004) en las que se reducen los grupos más importantes de bacterias celulolíticas del rumen, y casi desaparecen los microorganismos que deben degradar la celulosa. En tales circunstancias la suplementación nitrogenada, ya sea en forma de proteína verdadera o NNP, incrementa la población y actividad de los microorganismos ruminales debido, principalmente, al hecho de que el primer factor que limita la acción de los microorganismos y su actividad, es el bajo valor nutritivo de los alimentos que consumen los animales. Cuando desaparece esta limitante, se observa una alta proliferación de microorganismos y consecuentemente, se obtiene una mayor degradabilidad ruminal de la materia seca, fibra detergente neutro y fibra detergente ácido.
En sentido general se ha demostrado que para ser eficaces, los suplementos manipuladores del rumen, deben proporcionar de forma continua los niveles adecuados de nitrógeno amoniacal para el crecimiento constante de los microorganismos. Al incluir altas concentraciones de sal-urea y melaza-urea, se suprime el consumo rápido de estos suplementos.
En este sentido, la mayor respuesta a la suplementación nitrogenada se obtiene cuando se formulan suplementos que combinan el NNP con la proteína verdadera. Ésta proporciona los aminoácidos que se requieren para la síntesis de Novo de la proteína en el rumen y contribuye a la actividad enzimática debido a la naturaleza proteica de las enzimas.
La tabla 2 muestra el efecto de tres formulaciones: SNA-100; SNA-85 y SNA-70 en la representación de diferentes grupos morfológicos de bacterias del rumen.
Para conocer el efecto de estos activadores ruminales en la población microbiana del rumen, específicamente bacterias y hongos celulolíticos, así como la actividad de sus enzimas, Galindo y Marrero (2005), Sosa et al. (2010) y Galindo et al. (2011) realizaron diferentes trabajos. En la tabla 3 se resumen algunos de los resultados obtenidos.
Muñoz et al. (1979), estudiaron el efecto de un activador (SNA) en la producción de leche en vacas que pastaban pangola (Digitaria decumbens), de 21 y 28 d de rebrote en secano, con suplementación de heno o no. Se alcanzaron producciones de leche entre 7.7- 8.9 L vaca.d-1. El peso vivo promedio de las vacas fue de 460 kg. El activador tuvo mejor efecto productivo en los animales que pastaban pangola a los 28 d de edad con respecto a los 21 d. Esto demuestra su potencial en alimentos de peor calidad. Igualmente se encontraron mayores consumos voluntarios del activador.
En otro grupo de trabajos desarrollados por Muñoz et al. (1984, 1985, 1986, 1991) se demostró el efecto de los activadores ruminales obtenidos a partir de diferentes relaciones NNP/PV en la producción de leche de vacas alimentadas en pastoreo con diferentes pastos tropicales, así como con caña de azúcar, sola o suplementada con heno y ensilaje de gramíneas.
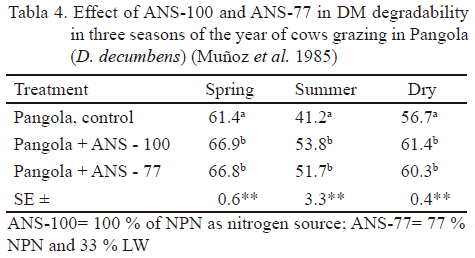
La tabla 4 muestra la degradabilidad de la MS de dos activadores ruminales, denominados SNA-77 y SNA-100 en tres épocas del año González et al. (1989, 1990) demostraron la función de los activadores ruminales en la cinética de degradación de la MS, la FDN, velocidad de recambio ruminal y tiempo de retención de las partículas en el rumen de vacas en dietas de caña de azúcar con suplementación o no de otra fuente fibrosa. Se demostró que los animales son capaces de autorregular el consumo voluntario del activador durante el día. Esto coloca al rumen en mejores condiciones de degradar los materiales fibrosos, manteniendo su propiedad de sistema de fermentación continuo.
El activador ruminal denominado Granulado Jordán (Jordán 2001) también mostró ventajas importantes, cuando se utilizó en sistemas de ceba vacuna en pastos con riego y fertilizantes. Entre 124 y 145 d de ceba se obtuvieron GMD de 0,.982 y 1.029 kg/animal.d-1, con rendimientos en canal de 52-57 % (figura 1). Sin embargo, con esta misma tecnología en sistemas de bajos insumos con pastoreo de Panicum maximum y Cynodon nlemfuensis (50/50), las ganancias fueron de 0.900 y 1.12 kg/animal.d-1 en períodos de ceba de 228 y 160 d, respectivamente. El consumo del activador fue 1.32 y 1.46 kg/animal.d-1. El consumo de este producto, en comparación con el consumo de soya, duplicó la población de bacterias y hongos celulolíticos ruminales. La actividad celulolítica y la actividad específica del complejo de enzimas celulasas se quintuplicaron y, consecuentemente, se dispuso de mayor concentración de azúcares reductores en el líquido ruminal.
Los bloques multinutricionales (BMN) fueron estudiados por Mejías et al. (2000) en dos proyectos de investigación. Estos autores encontraron incrementos en la producción de leche de vaca, así como mejoras en el perfil metabólico y respuesta reproductiva, debido al aporte sistemático de minerales que reciben los animales que lo consumen.
Los BMN permiten a los rumiantes un suministro balanceado y sincronizado de nutrientes. Además, la tecnología de los bloques implica ingredientes baratos, como los subproductos agroindustriales, que son además de fácil implementación. Estos productos se utilizan en diferentes especies de rumiantes con resultados satisfactorios, en cuanto al aprovechamiento de los forrajes y mejoras en el comportamiento productivo de los animales (Mejías et al. 2000).
INGREDIENTES QUE SE PUEDEN UTILIZAR PARA LA FORMULACIÓN DE LOS ACTIVADORES RUMINALES Y SU COMPOSICIÓN QUÍMICA
La tabla 5 muestra algunos de los ingredientes que se pueden utilizar para la formulación de los activadores ruminales. Es importante destacar la importancia de incorporar a la mezcla un producto de baja palatabilidad, cuya función es regular el consumo voluntario. En este caso, se pueden usar sulfatos o sal común.
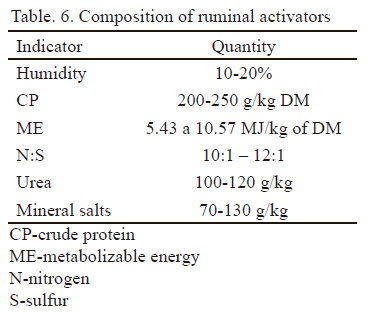
En la tabla 6 se presenta la composición de los activadores ruminales. Se destaca de gran importancia la relación nitrógeno/azufre, que es adecuada para garantizar la síntesis de aminoácidos azufrados por los microorganismos del rumen.
La tecnología de los activadores ruminales del Instituto de Ciencia Animal se transfirió de manera exitosa a la República Oriental del Uruguay. Además, en diferentes empresas cubanas se ejecutan nuevas formulaciones que cumplen con los principios para las que se diseñaron.
Se concluye que la utilización de los activadores ruminales, como estrategia manipuladora de la fermentación ruminal, es adecuada y contribuye al funcionamiento estable del rumen, por lo que se debe esperar mayor utilización digestiva de los alimentos que consumen los animales y consecuentemente, mayor productividad.
REFERENCIAS
Abdalla, A. L., Filho, J. C. da S., Godoi, A. R. de, Carmo, C. de A. & Eduardo, J. L. de P. 2008. “Utilização de subprodutos da indústria de biodiesel na alimentação de ruminantes”. Revista Brasileira de Zootecnia, 37(SPE): 260–268, ISSN: 1516-3598, DOI: 10.1590/S1516-35982008001300030.
Abdalla, A. L., Louvandini, H., Sallam, S. M. A. H., Bueno, I. C. da S., Tsai, S. M. & Figueira, A. V. de O. 2012. “In vitro evaluation, in vivo quantification, and microbial diversity studies of nutritional strategies for reducing enteric methane production”. Tropical Animal Health and Production, 44(5): 953–964, ISSN: 0049-4747, 1573-7438, DOI: 10.1007/s11250-011-9992-0.
Abecia, L., Toral, P. G., Martín-García, A. I., Martínez, G., Tomkins, N. W., Molina-Alcaide, E., Newbold, C. J. & Yáñez-Ruiz, D. R. 2012. “Effect of bromochloromethane on methane emission, rumen fermentation pattern, milk yield, and fatty acid profile in lactating dairy goats”. Journal of Dairy Science, 95(4): 2027–2036, ISSN: 0022-0302, DOI: 10.3168/jds.2011-4831.
Belzecki, G. & Michalowski, T. 2002. “The role of the ciliate Eudiplodinium maggii in starch digestion in the rumen”. Reproduction Nutrition Development, 42(1): 78–78, ISSN: 1297-9708, 0003-388X.
Béra-Maillet, C., Devillard, E., Cezette, M., Jouany, J.-P. & Forano, E. 2005. “Xylanases and carboxymethylcellulases of the rumen protozoa Polyplastron multivesiculatum, Eudiplodinium maggii and Entodinium sp.”. FEMS Microbiology Letters, 244(1): 149–156, ISSN: 0378-1097, DOI: 10.1016/j.femsle.2005.01.035.
Carro, M. D. & Ranilla, M. J. 2002. “Los aditivos antibióticos promotores del crecimiento de los animales: situación actual y posibles alternativas”. Exopol: circular, 90(7), Available: <http://ecaths1.s3.amazonaws.com/zootecniageneral2/1641923393.Los%20Aditivos%20Antibi%C3%B3ticos%20y%20PromotoresR.doc>, [Consulted: May 13, 2017].
Chen, Y.-C., Tsai, S.-D., Cheng, H.-L., Chien, C.-Y., Hu, C.-Y. & Cheng, T.-Y. 2007. “Caecomyces sympodialis sp. nov., a new rumen fungus isolated from Bos indicus”. Mycologia, 99(1): 125–130, ISSN: 0027-5514.
Cheng, Y. F., Mao, S. Y., Liu, J. X. & Zhu, W. Y. 2009. “Molecular diversity analysis of rumen methanogenic Archaea from goat in eastern China by DGGE methods using different primer pairs”. Letters in Applied Microbiology, 48(5): 585–592, ISSN: 1472-765X, DOI: 10.1111/j.1472-765X.2009.02583.x.
Dehority, B. A. & Tirabasso, P. A. 2000. “Antibiosis between Ruminal Bacteria and Ruminal Fungi”. Applied and Environmental Microbiology, 66(7): 2921–2927, ISSN: 0099-2240, 1098-5336, DOI: 10.1128/AEM.66.7.2921-2927.2000.
Di Lorenzo, N., Rostoll, L., Ardanaz, S., Guevara-Ballesteros, R., García-Ascolani, M. & Ruiz-Moreno, M. 2015. “Manipulación de la fermentación ruminal para mejorar la productividad en ganado bovino”. In: XVII Congreso Bienal AMENA, Marianna, FL, USA: University of Florida - North Florida Research and Education Center, Available: <http://www.engormix.com/MA-avicultura/eventos/xvii-congreso-bienal-amena-t2288-conferencias.htm>, [Consulted: May 13, 2017].
Díaz, A., Castillo, E., Martín, P. C. & Hernández, J. L. 2005. “Comportamiento productivo de añojos Cebú en pastoreo de asociación de glycine (Neonotonia wightii) y pasto natural, suplementados con un activador de la fermentación ruminal”. Cuban Journal of Agricultural Science, 39(3), ISSN: 2079-3480, Available: <http://repositoriodigital.academica.mx/jspui/handle/987654321/386841>, [Consulted: May 13, 2017].
Díaz, A., Castillo, E., Martín, P. C. & Hernández, J. L. 2009. “Ceba de toros mestizos lecheros, en silvopastoreo con leucaena, acceso a banco de biomasa y suplemento activador del rumen”. Cuban Journal of Agricultural Science, 43(3): 235–238, ISSN: 2079-3480.
Díaz, A., Castillo, E., Martín, P. & Hernández, J. L. 2011. “Preceba de machos bovinos mestizos lecheros en pastoreo con leguminosas herbáceas, banco de biomasa y suplemento activador del rumen”. Cuban Journal of Agricultural Science, 45(1): 25–28, ISSN: 2079-3480.
Edwards, J. E., Huws, S. A., Kim, E. J., Lee, M. R. F., Kingston-Smith, A. H. & Scollan, N. D. 2008. “Advances in microbial ecosystem concepts and their consequences for ruminant agriculture”. Animal: An International Journal of Animal Bioscience, 2(5): 653–660, ISSN: 1751-7311, DOI: 10.1017/S1751731108002164.
Edwards, J. E., McEwan, N. R., Travis, A. J. & Wallace, R. J. 2004. “16S rDNA library-based analysis of ruminal bacterial diversity”. Antonie van Leeuwenhoek, 86(3): 263–281, ISSN: 0003-6072, 1572-9699, DOI: 10.1023/B:ANTO.0000047942.69033.24.
Elías, A. 2000. “Efectos de las fuentes de energía en algunos de los productos finales de la fermentación ruminal”. Cuban Journal of Agricultural Science, 34(4): 321, ISSN: 2079-3480.
Galindo, J., González, N., Sosa, A., Ruíz, T., Torres, V., Aldana, A., Díaz, H., Moreira, O., Sarduy, L. & Noda, A. 2011. “Efecto de Tithonia diversifolia (Hemsl.) Gray (Botón de oro) en la población de protozoos y metanógenos ruminales en condiciones in vitro”. Cuban Journal of Agricultural Science, 45(1): 33–37, ISSN: 2079-3480.
Galindo, J. & Marrero, Y. 2005. “Manipulación de la fermentación microbiana ruminal”. Cuban Journal of Agricultural Science, 39(Suppl. 1): 439–450, ISSN: 2079-3480.
Galindo, J., Marrero, Y., González, N. & Aldama, A. I. 2004. “Caracterización de la actividad celulolítica en el líquido de rumen filtrado”. Cuban Journal of Agricultural Science, 38(3): 259, ISSN: 2079-3480.
Galindo, J., Marrero, Y., Ruiz, T. E., González, N., Díaz, A., Aldama, A. I., Moreira, O., Hernández, J. L., Torres, V. & Sarduy, L. 2009. “Efecto de una mezcla múltiple de leguminosas herbáceas y Leucaena leucocephala en la población microbiana y productos fermentativos del rumen de añojos mestizos de Cebú”. Cuban Journal of Agricultural Science, 43(3), ISSN: 2079-3480, Available: <http://repositoriodigital.academica.mx/jspui/handle/987654321/386592>, [Consulted: May 13, 2017].
González, N., Galindo, J., Aldana, A. I., Moreira, O. & Sarduy, L. 2011. “Effect of four mulberry (Morus alba Linn.) varieties on microbial population and fermentative products with rumen liquid from river buffaloes (Bubalus bubalis) under in vitro conditions”. Cuban Journal of Agricultural Science, 45(4), ISSN: 2079-3480, Available: <http://cjascience.com/index.php/CJAS/article/view/99>, [Consulted: May 13, 2017].
González, R., Muñoz, E., Alfonso, F., González, R. M. & Enrique, A. V. 1989. “Caña de azucar como forraje para la produccion de leche. I. Efecto de la inclusion de forraje de pasto estrella (Cynodon nlemfuensis) en el consumo y digestibilidad del alimento.”. Cuban Journal of Agricultural Science, 23(2): 131–136, ISSN: 2079-3480.
González, R., Muñoz, E., Ruiz, R., Cairo, J. G. & González, M. R. 1990. “Caña de azúcar como forraje para la producción de leche. II. Efecto de la inclusión de heno de pasto estrella (Cynodon nlemfuensis) en el consumo de alimentos”. Cuban Journal of Agricultural Science, 24(2): 151–155, ISSN: 2079-3480.
Henry, D. D., Ruiz-Moreno, M., Ciriaco, F. M., Kohmann, M., Mercadante, V. R. G., Lamb, G. C. & DiLorenzo, N. 2015. “Effects of chitosan on nutrient digestibility, methane emissions, and in vitro fermentation in beef cattle”. Journal of Animal Science, 93(7): 3539–3550, ISSN: 1525-3163, DOI: 10.2527/jas.2014-8844.
James, T. Y., Letcher, P. M., Longcore, J. E., Mozley-Standridge, S. E., Porter, D., Powell, M. J., Griffith, G. W. & Vilgalys, R. 2006. “Chytridiomycota: 14 clades of flagellated fungi”. Mycologia, 98(6): 860–871, ISSN: 0027-5514.
Jordán, H. 2001. Suplemento Granulado como activador ruminal. no. CU 22660 A1. A23K 1/18, ONPI.
Jouany J. P 1996. “Effect of rumen protozoa on nitrogen utilization by ruminants”. The Journal of nutrition, 126(Suppl. 4): 1335S–46S, ISSN: 0022-3166.
Kamra, D. N. 2005. “Rumen microbial ecosystem”. Current Science, 89(1): 124–135, ISSN: 0011-3891.
Koenig, K. M., Newbold, C. J., McIntosh, F. M. & Rode, L. M. 2000. “Effects of protozoa on bacterial nitrogen recycling in the rumen”. Journal of Animal Science, 78(9): 2431–2445, ISSN: 0021-8812.
Koike, S. & Kobayashi, Y. 2001. “Development and use of competitive PCR assays for the rumen cellulolytic bacteria: Fibrobacter succinogenes, Ruminococcus albus and Ruminococcus flavefaciens”. FEMS Microbiology Letters, 204(2): 361–366, ISSN: 0378-1097, DOI: 10.1111/j.1574-6968.2001.tb10911.x.
Kung, L., Treacher, R. J., Nauman, G. A., Smagala, A. M., Endres, K. M. & Cohen, M. A. 2000. “The Effect of Treating Forages with Fibrolytic Enzymes on its Nutritive Value and Lactation Performance of Dairy Cows1”. Journal of Dairy Science, 83(1): 115–122, ISSN: 0022-0302, DOI: 10.3168/jds.S0022-0302(00)74862-4.
Lee, S. S., Ha, J. K. & Cheng, K.-J. 2000. “Relative Contributions of Bacteria, Protozoa, and Fungi to In vitro Degradation of Orchard Grass Cell Walls and Their Interactions”. Applied and Environmental Microbiology, 66(9): 3807–3813, ISSN: 0099-2240, 1098-5336, DOI: 10.1128/AEM.66.9.3807-3813.2000.
Mackie, R. L., Mc Sweeney, C. S. & Klieve, A. V. 2002. “Microbial ecology of ovine rumen”. In: Freer, M. & Dove, H. (eds.), Sheep nutrition, Wallingford, Oxon, UK; New York, NY, USA: CABI Publishing - CSIRO Publishing, ISBN: 978-0-85199-877-0, Available: <http://dx.doi.org/10.1079/9780851995953.0000>, [Consulted: May 13, 2017].
Martínez-Anaya, C., Balcázar-López, E., Dantán-González, E. & Folch-Mallol, J. L. 2008. “Celulasas fúngicas: Aspectos biológicos y aplicaciones en la industria energética”. Revista Latinoamericana de Microbiología, 50(3–4): 119–131, ISSN: 0187-4640.
Marty, R. J. 1972. “Manipulación de la fermentación ruminal”. Cuban Journal of Agricultural Science, 6(2): 163–176, ISSN: 2079-3480.
Masai, E., Katayama, Y. & Fukuda, M. 2007. “Genetic and Biochemical Investigations on Bacterial Catabolic Pathways for Lignin-Derived Aromatic Compounds”. Bioscience, Biotechnology, and Biochemistry, 71(1): 1–15, ISSN: 0916-8451, 1347-6947, DOI: 10.1271/bbb.60437.
Mejías, R., García-López, R. & Rodríguez, J. 2000. “Nivel de urea en bloques multi nutricionales (BMN) en el consumo de heno por carneros estabulados”. Cuban Journal of Agricultural Science, 34(1): 27–30, ISSN: 2079-3480.
Mercadante, V. R. G., Waters, K. M., Marquezini, G. H. L., Henry, D. D., Ciriaco, F. M., Arthington, J. D., DiLorenzo, N. & Lamb, G. C. 2015. “Effects of anti-phospholipase A antibody supplementation on dry matter intake feed efficiency, acute phase response, and blood differentials of steers fed forage- and grain-based diets”. Journal of Animal Science, 93(2): 776–785, ISSN: 1525-3163, DOI: 10.2527/jas.2014-7958.
Michalowski, T., Rybicka, K. & Kasperowicz, A. 2001. “Ability of the rumen ciliate Epidinium ecaudatum to digest and use crystalline cellulose and xylan for in vitro growth”. Acta Protozoologica, 40(3): 203–210, ISSN: 0065-1583.
Muñoz, E., Elias, A. & Suárez, J. 1979. “Suplementos nitrogenados y heno para vacas lecheras en pastoreo de pangola durante la época de lluvias”. Cuban Journal of Agricultural Science, 13(3): 253–261, ISSN: 2079-3480.
Muñoz, E., Elías, A. & Suárez, J. 1985. “Utilización de suplementos con alto contenido de NNP para raciones forrajeras. 3. Efecto en la digestibilidad in situ del pasto pangola (Digitaria decumbens Stent)”. Cuban Journal of Agricultural Science, 19(2): 145–152, ISSN: 2079-3480.
Muñoz, E., Elías, A. & Suárez, J. D. 1984. “Utilización de suplementos con alto contenido de NNP en raciones forrajeras. 1. Efecto en la digestibilidad in situ del forraje de pasto estrella (Cynodon nlemfuensis)”. Cuban Journal of Agricultural Science, 18(1): 27–32, ISSN: 2079-3480.
Muñoz, E., Elías, A. & Suárez, J. D. 1986. “Utilización de suplementos con alto contenido de NNP para raciones forrajeras. 4. Efecto en la digestión in situ de la materia seca y orgánica del ensilado de pastos”. Cuban Journal of Agricultural Science, 20(2): 137–141, ISSN: 2079-3480.
Muñoz, E., Elías, A. & Suárez, J. D. 1991. “Utilización de suplementos con alto contenido de NNP para raciones forrajeras. 5. Efecto de la proteína natural en el comportamiento productivo de las vacas lecheras en pasto de secano”. Cuban Journal of Agricultural Science, 25(1): 19–25, ISSN: 2079-3480.
Nhan, N. T. H., Van Hon, N., Ngu, N. T., Von, N. T., Preston, T. R. & Leng, R. A. 2001. “Practical Application of Defaunation of Cattle on Farms in Vietnam: Response of Young Cattle Fed Rice Straw and Grass to a Single Drench of Groundnut Oil”. Asian-Australasian Journal of Animal Sciences, Asian-Australasian Journal of Animal Sciences, 14(4): 485–490, ISSN: 1011-2367, DOI: 2001.14.4.485.
Pierre, G., Benjamin, H. & Makkar, H. P. S. 2013. Mitigación de las emisiones de gases de efecto invernadero en la producción ganadera. Una revisión de las opciones técnicas para la reducción de las emisiones de gases diferentes al CO2. (ser. FAO Producción y Sanidad Animal, no. ser. 117), Roma, Italy: FAO, 251 p., Available: <http://www.fao.org/docrep/019/i3288s/i3288s.pdf>, [Consulted: May 13, 2017].
Pinos-Rodríguez, J. M., González, S., Mendoza, G., García, J. C., Miranda, L., de la Cruz, G. A. & de Lerma, V. 2005. “Efecto de enzimas fibrolíticas exógenas en la degradación in vitro de ingredientes alimenticios, y en la producción de leche de vacas Holstein”. Interciencia, 30(12): 752–757, ISSN: 0378-1844.
Rezaeian, M., Beakes, G. W. & Chaudhry, A. S. 2005. “Relative fibrolytic activities of anaerobic rumen fungi on untreated and sodium hydroxide treated barley straw in in vitro culture”. Anaerobe, 11(3): 163–175, ISSN: 1075-9964, DOI: 10.1016/j.anaerobe.2004.10.008.
Santra, A. & Karim, S. A. 2002. “Influence of ciliate protozoa on biochemical changes and hydrolytic enzyme profile in the rumen ecosystem”. Journal of Applied Microbiology, 92(5): 801–811, ISSN: 1365-2672, DOI: 10.1046/j.1365-2672.2002.01583.x.
Sawanon, S. & Kobayashi, Y. 2006. “Synergistic fibrolysis in the rumen by cellulolytic Ruminococcus flavefaciens and non-cellulolytic Selenomonas ruminantium: Evidence in defined cultures”. Animal Science Journal, 77(2): 208–214, ISSN: 1740-0929, DOI: 10.1111/j.1740-0929.2006.00339.x.
Sosa, A., Galindo, J. & Bocourt, R. 2007. “Metanogénesis ruminal: aspectos generales y manipulación para su control”. Cuban Journal of Agricultural Science, 41(2): 105–114, ISSN: 2079-3480.
Sosa, A., Galindo, J., Bocourt, R., Rodríguez, R., Albelo, N. & Oramas, A. 2010. “Efecto de Aspergillus oryzae en la fermentación ruminal de Pennisetum purpureum vc. Cuba CT-115 mediante la técnica de producción de gas in vitro”. Cuban Journal of Agricultural Science, 44(2): 151–155, ISSN: 2079-3480.
Srinivasan, K., Murakami, M., Nakashimada, Y. & Nishio, N. 2001. “Efficient production of cellulolytic and xylanolytic enzymes by the rumen anaerobic fungus, Neocallimastix frontalis, in a repeated batch culture”. Journal of Bioscience and Bioengineering, 91(2): 153–158, ISSN: 1389-1723, DOI: 10.1016/S1389-1723(01)80058-X.
Stevenson, D. M. & Weimer, P. J. 2007. “Dominance of Prevotella and low abundance of classical ruminal bacterial species in the bovine rumen revealed by relative quantification real-time PCR”. Applied Microbiology and Biotechnology, 75(1): 165–174, ISSN: 0175-7598, 1432-0614, DOI: 10.1007/s00253-006-0802-y.
Sun, Y. Z., Mao, S. Y., Yao, W. & Zhu, W. Y. 2008. “DGGE and 16Ss rDNA analysis reveals a highly diverse and rapidly colonizing bacterial community on different substrates in the rumen of goats”. Animal, 2(3): 391–398, ISSN: 1751-7311, 1751-732X, DOI: 10.1017/S1751731107001231.
Tokura, M., Ushida, K., Miyazaki, K. & Kojima, Y. 1997. “Methanogens associated with rumen ciliates”. FEMS Microbiology Ecology, 22(2): 137–143, ISSN: 0168-6496, DOI: 10.1111/j.1574-6941.1997.tb00365.x.
Welkie, D. G., Stevenson, D. M. & Weimer, P. J. 2010. “ARISA analysis of ruminal bacterial community dynamics in lactating dairy cows during the feeding cycle”. Anaerobe, 16(2): 94–100, ISSN: 1075-9964, DOI: 10.1016/j.anaerobe.2009.07.002.
Whitford, M. F., Teather, R. M. & Forster, R. J. 2001. “Phylogenetic analysis of methanogens from the bovine rumen”. BMC Microbiology, 1(1): 5, ISSN: 1471-2180, DOI: 10.1186/1471-2180-1-5.
Williams, A. G. & Coleman, G. S. 1992. The Rumen Protozoa. New York, USA: Springer, ISBN: 978-1-4612-7664-7.
Yang, W. Z., Benchaar, C., Ametaj, B. N. & Beauchemin, K. A. 2010. “Dose response to eugenol supplementation in growing beef cattle: Ruminal fermentation and intestinal digestion”. Animal Feed Science and Technology, 158(1–2): 57–64, ISSN: 0377-8401, DOI: 10.1016/j.anifeedsci.2010.03.019.
Zebeli, Q., Mansmann, D., Steingass, H. & Ametaj, B. N. 2010. “Balancing diets for physically effective fibre and ruminally degradable starch: A key to lower the risk of sub-acute rumen acidosis and improve productivity of dairy cattle”. Livestock Science, 127(1): 1–10, ISSN: 1871-1413, DOI: 10.1016/j.livsci.2009.09.003.
Recibido: 14/4/2015
Aceptado: 8/5/2017
Juana Galindo. Apartado Postal 24, San José de las Lajas, C.P. 32700, Mayabeque, Cuba. Email: jgalindo@ica.co.cu














