Introducción
El termino inmovilización en la biotecnología se refiere al confinamiento de células, enzimas u otros organismos de manera que se encuentren localizadas dentro de cierta región, manteniendo propiedades biológicas para ser utilizadas tanto en la degradación como en la obtención de un producto determinado. Una gran variedad de procesos que son llevados a cabo mediante el uso de soportes de inmovilización. En los últimos años, la biotecnología ha tenido importantes avances en la aplicación de estos. Por ejemplo, los procesos industriales para la obtención de productos químicos, alimentarios y farmacéuticos, así como en el área ambiental
Los trabajos realizados sobre inmovilización de microrganismos y enzimas han generado gran interés en la comunidad científica, debido a sus ventajas técnicas y económicas con respecto a los procesos tradicionales. Entre las principales ventajas que presentan los sistemas biotecnológicos, que utilizan células inmovilizadas, se encuentran su facilidad para el manejo de una mayor densidad celular, un mejor control en sistemas continuos y la posible recuperación de la biomasa para su posterior reutilización.
De igual manera, los procesos de inmovilización de enzimas, tanto de forma nativa como de complejos enzimáticos presentes en los organismos, han sido un punto de estudio de varias investigaciones científicas. Las enzimas o "biocatalizadores" son un descubrimiento notable en el campo de la tecnología de bioprocesos. La biocatálisis ha sido ampliamente aceptada en diversos sectores debido a su facilidad de producción, especificidad de sustrato y factibilidad para su reúso (Kawaguti et al., 2006; Datta et al., 2012). Sin embargo, el uso de enzimas en su forma nativa es un proceso generalmente costoso, además existe la posibilidad de un bajo funcionamiento en cuanto a su estabilidad, recuperación y reutilizaciones (Hartmann, 2013).
El primer informe sobre la inmovilización de enzimas se remonta a 1916. Nelson y Griffin demostraron que la enzima invertasa, adsorbida físicamente en el carbón, retiene completamente su actividad catalítica (Nelson J, 1916). Desde entonces, la inmovilización de enzimas se ha estudiado durante casi 100 años (Krishna et al., 2018). La primera enzima inmovilizada utilizada industrialmente fue la aminoacilasa, adsorbida físicamente en el polímero DEAE-Sephadex y utilizada para la producción industrial de L-metionina por Tanabe Seiyaku Co. en 1969 (Liese K et al., 2001).
Actualmente, la inmovilización de enzimas y de microorganismos se utiliza en infinidad de procesos industriales. Algunos ejemplos son: en la industria farmacéutica para la obtención del ácido 6-aminopenicilánico (APA) que se emplea como núcleo para la producción de antibióticos semisintéticos, especialmente ampicilina y amoxicilina (Min, 2016); en la industria alimenticia para la producción de fructuosa a partir del almidón (Faber, 2004; Hartmann, 2013). A diferencia de la industria farmacéutica y algunos casos de la industria química, los objetivos en la industria alimentaria son producir cantidades muy grandes de productos a bajo costo, por lo que, la enzima inmovilizada, debe tener una buena estabilidad operativa que permita realizar una gran cantidad de ciclos (Basso, 2019).
En el campo de la biorremediación y la protección del medio ambiente, los métodos de inmovilización de células y enzimas también han desempeñado un papel primordial (Stadimair et al., 2018, 2019). Por citar un ejemplo, en la producción de biocombustibles se han empleado para disminuir la carga ambiental y obtener biocombustibles de excelente calidad y menos emisión de gases nocivos como el CO2 (Raman, 2011; Chapman, 2018). También ha sido utilizada en la industria textil para la eliminación de colorantes, cuyos residuales son muy tóxicos al ser vertidos en los cuerpos de aguas (Darwesh, 2019). En cuanto a los contaminantes emergentes presentes en las aguas residuales de la industria farmacéutica, varios autores han expuesto resultados satisfactorios en cuanto a estabilidad, factibilidad de reutilización y la capacidad de degradación de las enzimas inmovilizadas en la reducción de antibióticos, disruptores endocrinos y metales, entre otros. La comunidad científica ha prestado gran atención a estos contaminantes, en los últimos años, debido a los daños potenciales que provocan a la salud humana y animal, así como a ecosistemas cercanos a los cuerpos de agua (Carmalin et al., 2018; Bilal et al., 2019; Faird et al., 2020).
En este artículo se exponen las principales técnicas utilizadas en la inmovilización, características de los soportes y propiedades de estos que influyen en el proceso de inmovilización.
Métodos más usados en la inmovilización.
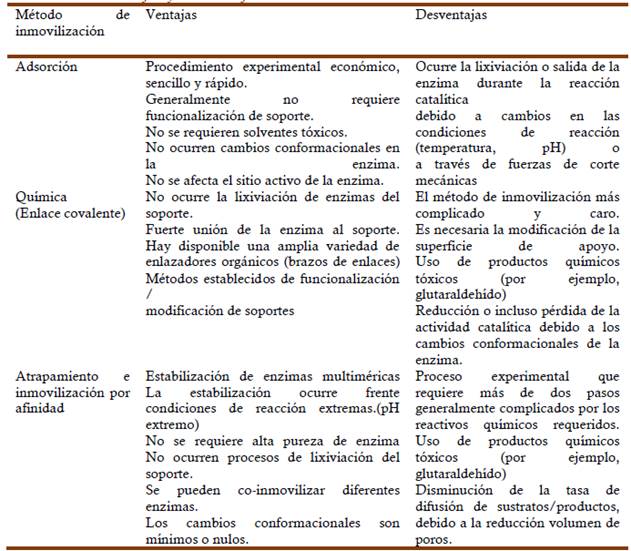
Adsorción.
Durante los procesos de adsorción, la enzima se une a un soporte mediante interacciones iónicas por fuerzas de Van der Waals y por puentes de hidrógeno. Durante este proceso las moléculas de enzima se adhieren a la superficie del soporte mediante una combinación de interacciones hidrofóbicas y la formación de varios enlaces salinos por la molécula de enzima. Esto se logra embebiendo el material de soporte en una suspensión de la enzima, logrando una interacción directa entre los dos compuestos (Spahn C, 2008; Cordeiro et al., 2011).
Este método logra fuertes vínculos entre el material de soporte y la enzima, aunque varios factores pueden afectar estas interacciones. La temperatura, el pH, las condiciones fisiológicas y la adición de sustratos no degradables pueden debilitar este enlace. Soportes como las fibras de coco, que presentan una excelente capacidad de retención de agua y altas propiedades de intercambio catiónico; caolín con alta retención de enzimas por acetilación química y materiales micro/mesoporosos, que tienen una gran área superficial ideal para reacciones de reducción y oxidación; permiten que las enzimas adsorbidas tengan una gran resistencia a la proteólisis y una fuerte agregación debido a su interacción hidrófoba con las interfaces (Karagulyan et al., 2008; Huang et al., 2011; Mitchell et al., 2011).
Varios estudios de adsorción se han centrado en la inmovilización de enzimas en silicatos como principales portadores. Soportes porosos como las silicas mesoporosas del tipo material MCM-41 han sido utilizadas para adsorber la enzima lacasa, mejorando su estabilidad térmica, de pH y su capacidad operativa (Wang et al., 2008). Se plantea que una opción para la mejora en el proceso de adsorción es la modificación previa de los grupos funcionales, lo que aumenta su efectividad. Estudios realizados en este sentido muestran que, al modificar, previamente, enzimas con glutaraldehído, mejoraron los procesos de adsorción y la funcionalidad enzimática.
Varios autores reportan la inmovilización de la enzima ureasa, adsorbida sobre 1,4 butenodiol diglicidil éter. Estos estudios evidenciaron mayor estabilidad frente pH y la capacidad para retener más del 50% de la actividad de la enzima en condiciones de deshidratación. Demostrandose, una vez más,que la inmovilización es un método adecuado de utilización de materiales biocompatibles con el ambiente, económicos, duraderos y eficientes en sus funciones (Mishra et al., 2011; Pontón et al., 2011).
Unión Covalente.
La unión covalente de una enzima a un soporte es quizás el método de inmovilización más interesante desde el punto de vista industrial. La metodología de unión covalente se basa en la activación de grupos químicos del soporte para que reaccionen con nucleófilos de las proteínas. Entre los 20 aminoácidos diferentes que pueden encontrarse en la estructura de las enzimas, los más empleados para la formación del soporte son lisina, cisteína, tirosina, histidina y en menor cuantía arginina, ácido aspártico y glutámico. El resto de aminoácidos debidos a su carácter hidrófobo, no se encuentran expuestos hacia el exterior de la superficie proteica y no pueden intervenir en la unión covalente. No obstante, la reacción depende de la presencia de diferentes grupos funcionales como son: grupo carboxilo, amino, indol, sulfhídrilo, tiol, imidazol e hidroxilo. Por otro lado, una mayor actividad específica y una mejor estabilidad puede lograrse si se utilizan superficies modificadas por péptidos para lograr la unión enzimática (Fu et al., 2001). Los grupos amina expuestos en los residuos de lisina reaccionan fácilmente con soportes que llevan ésteres activos, siendo los más comunes los ésteres de N-hidroxi-succinimida (NHS), para formar enlaces amida estables. Sin embargo, cuando se usan ésteres de NHS pueden no ser muy favorable ya que los mismos son inestables en condiciones acuosas y, por tanto, la unión de proteínas en tampones acuosos competirá con la hidrólisis del éster, lo que posiblemente resulte en un modesto rendimiento de inmovilización (Abolpour et al., 2013).
El soporte óptimo para la inmovilización por formación de enlaces covalentes debe contener brazos espaciadores cortos y una alta densidad de grupos reactivos. Estas características son necesarias para la fijación multipunto de la enzima, aportando su rigidez (Fernández, 2012). Se han empleado muchos soportes para la inmovilización enzimática a través de la formación de enlaces covalentes, entre ellos soportes a base de sílice como caolinita o nanopartículas de sílice mesoporosa (Liu et al., 2008; Salis et al., 2009). Liu et al. (2008) utilizaron nanopartículas de sílice silanizadas y activadas con glutaraldehído en el soporte, estos materiales mejoraron las estabilidades térmicas y operativas de la enzima, como lo mostró la retención del 61% de la actividad residual después de 4h a 60 °C y la retención del 55% de la actividad después de 10 ciclos de operación. Sin embargo, otros estudios mostraron una alta estabilidad y la retención de más del 70% de la actividad de la enzima lacasa al ser inmovilizada en esferas magnéticas mesopososas de sílice. En este sentido, las esferas magnéticas fueron tratadas con glutaraldehído mostrando una disminución en el proceso de inmovilización, ya que, en la superficie del soporte, dos grupos -COH del glutaraldehído se unieron a los grupos aminos de la superficie del material de soporte (Zhu et al.,2007). Los procesos de unión covalente pueden ocurrir de diferentes maneras y dependerá del balance entre el material que se utilice como soporte y la enzima o microorganismo a inmovilizar.
Muchas veces las interacciones físicas entre las enzimas y la sílice no son lo suficientemente fuertes para mantener las enzimas dentro de los poros. La lixiviación de la enzima es una limitante de este material para ser usado como material de soporte, por lo que si se requiere un enlace covalente y evitar este lixiviado enzimático, se debe modificar químicamente la superficie de apoyo.
La modificación de superficies de sílice es un método bien establecido y una técnica ampliamente usada en esta inmovilización. Este método se describe en la literatura ofreciéndose numerosos protocolos (Yiu et al., 2005; Zhou et al., 2012). La ventaja de la modificación de superficies es que las moléculas de enzima están fuertemente fijadas, por lo que la desorción de la enzima de los soportes de sílice no ocurre con facilidad (Hartmann, 2010).
Xu (2011) comparó la inmovilización de la lipasa pancreática porcina (PPL) en SBA-15 modificada con (3-aminopropil)-trietoxisilano y demostró que la PPL, anclada químicamente, mostraba una mejor unión enzimática, así como, una mejor actividad en comparación con la PPL adsorbida físicamente. Además, la PPL inmovilizada covalentemente mostró una estabilidad mejorada frente a los cambios de temperatura y pH del medio y mejor capacidad de reutilización.
Hay dos vías generales para introducir grupos orgánicos en un soporte de sílice, es decir, modificación in situ durante la síntesis, denominada co-condensación o posmodificación, también conocido como injerto. La co-condensación permite la modificación de sílices mesoporosas por copolimerización de tetraalcoxisilanos [(RO)4]Si (típicamente, tetraetilortosilicato (TEOS) o tetrametilortosilicato (TMOS)) con trialcoxiorganosilanos terminales del tipo (R´0)3SiR en presencia de un tensoactivo. Esta técnica de modificación proporciona una carga superior y más homogénea de la superficie con grupos organosilanos en comparación a materiales funcionalizados mediante injerto. Sin embargo, el método de co-condensación tiene varias deficiencias: la cantidad de trialcoxiorganosilanos incorporados en los materiales de sílice es generalmente menor de lo que cabría esperar de su concentración inicial en el medio de reacción. El aumento de la concentración de trialcoxiorganosilanos en el medio puede resultar en la formación de productos con una estructura muy desordenada, lo que conlleva a una superficie reducida y un menor grado de carga orgánica. Además, el alcoxisilano funcionalizado debe hidrolizarse en una tasa similar a la del alcoxisilano no funcionalizado, de lo contrario se formará un gel heterogéneo y, por lo tanto, el grupo funcional no se distribuirán uniformemente. El injerto se logra mediante la unión covalente de organotrialcoxisilanos u otras especies de silano reactivo como tricloroorganosilanos o sililaminas con la superficie libre de silanol grupos en el soporte de sílice (ordenado o desordenado). Al utilizar las especies de organosilanos adecuadas, grupos funcionales como cloruro, alquilo, tiol, ciano/isociano, grupos vinilo/alilo, organofosfina, fenilo, alcoxi o amino se puede unir a la superficie de los portadores de sílice. De esta manera, los restos funcionales de las enzimas pueden reaccionar con un soporte de sílice.
Los grupos funcionales de las enzimas más comúnmente utilizadas y la ruta más popular para la inmovilización covalente de enzimas en soportes de sílice porosa es la funcionalización de la superficie del material con grupos amino (principalmente a través de (3-aminopropil) trietoxisilano, APTES) seguido de la reacción con glutaraldehído (GA) para proporcionar un enlazador adecuado (Fig. 1). Los grupos aldehído de la superficie del soporte de sílice reaccionan posteriormente con los grupos aminos de la enzima formando enlaces de imina. En algunos protocolos de inmovilización, las uniones de imina se redujeron aún más mediante el uso de NaBH4.Otros organosilanos disponibles comercialmente, pueden ser utilizados en la modificación de la superficie, el 3-(glicidoxipropil)-imetoxisilano y 3- (mercaptopropil)-trietoxisilano, lo que aportan los grupos epoxi o grupos tiol, respectivamente. Las sílices modificadas con 3-(mercaptopropil)-trietoxisilano pueden reaccionar además con grupos tiol de residuos de cisteína, lo que da como resultado la formación de enlaces disulfuro.
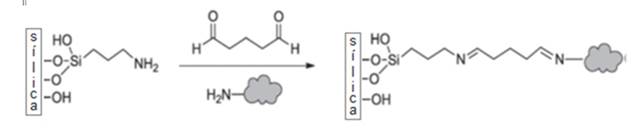
Fig 1. Inmovilización enzimática covalente, sílice mesoporosa modificada con (3-aminopropill) triethoxysilane, reaccionando con Glutaraldehidos y el N-terminal de la enzima.
Una de las principales ventajas de la unión covalente de enzimas en sílice es que el biocatalizador resultante puede ser utilizado en disolventes polares y el agua. Mientras que las enzimas adsorbidas físicamente, solo se pueden utilizar en disolventes orgánicos o con reactivos hidrófobos puros para evitar la lixiviación. La desventaja más marcada de la inmovilización covalente de enzimas es la menor actividad específica de los biocatalizadores resultantes en comparación con las enzimas libres en solución (Jung et al., 2010; Petkova et al., 2012).
Atrapamiento
El atrapamiento se basa en la retención de las enzimas por enlaces covalente o no covalente dentro de geles o fibras (Datta et al., 2013). Se ha logrado una encapsulación eficiente con vehículos híbridos de alginato-gelatina-calcio que evitan la fuga de enzimas y proporcionaron una mayor estabilidad mecánica (Shen et al., 2011). El atrapamiento en estructuras nanoestructuradas como las nanofibras electrohiladas y materiales novedosos, como nanopartículas de sílice, oro, magnética y de poliacrilamidacon; ha revolucionado el campo de la inmovilización enzimática. Estos soportes están basados en la utilización de nano estructuras, mayor campo de investigación para la inmovilización, pues ofrecen grandes posibilidades con amplias aplicaciones en la química, los biosensores y la obtención de biocombustibles (Wang et al. 2009; Wen et al.2011).
El atrapamiento por materiales como la sílice mesoporosa es atribuido principalmente a su alta superficie, distribución uniforme de poros, tamaño de poro y alta capacidad de adsorción (Ispas et al., 2009). Se han utilizado matrices sol-gel con polímeros supramoleculares de calixareno para atrapar la lipasa de Candida rugosa, teniendo en cuenta su capacidad de unión y transporte selectiva (Erdemir et al., 2011). Se ha reportado que las lipasas k-carrageninas son altamente termoestables y muy tolerantes a los solventes orgánicos (Jegannathan et al., 2010).
Inmovilización por afinidad
La inmovilidad por afinidad se basa, fundamentalmente, en la especificidad de la enzima con su soporte en diferentes condiciones fisiológicas.
El aumento de la afinidad enzima/soporte es lograda y aumentada mediante dos técnicas. Un primer caso donde la matriz está acoplada previamente a un ligando afin a la enzima o un segundo caso en el que la enzima se conjuga a una entidad que desarrolla afinidad hacia la matriz (Sardar et al. 2000).
La bioafinidad de capas es una variante de esta técnica que aumenta exponencialmente la capacidad de unión a enzimas y su reutilización debido a la presencia de enlaces de hidrógeno, fuerzas de Van der Waals, etc. (Haider y Husain 2008).
Cuando se pretende realizar un proceso de inmovilización de una enzima se deben tener en cuenta muchos factores. No basta con tener un material adsorbente y que se conozca las propiedades de degradación o de obtención de producto que pueda tener la enzima que se requiere inmovilizar. Las condiciones de pH, temperatura, la técnica de inmovilización, las condiciones de degradación y los solventes a utilizar deben ser seleccionadas de manera eficiente para el propósito que se persigue. El proceso debe ser simple, barato y que no requiera ciclos de regeneración a corto plazo. La eficiencia de inmovilización de la enzima debe ser lo más elevado posible y evitar su saturación en periodos cortos de tiempo.
Materiales utilizados como soportes en la inmovilización.
Muchos son los materiales que se utilizan como soportes de inmovilización. Su selección viene dada, principalmente, por el medio en que serán empleados y por el tipo de material biológico que será adherido a él.
Las características de la matriz son de suma importancia para determinar el éxito. Entre las características de lo soporte ideales se incluyen:
Deben ser de bajo costo y ecológico.
Deben ser totalmente inertes después de la inmovilización y no bloquear la reacción deseada.
Tener resistencia térmica y mecánica, permitiendo que la enzima inmovilizada se use en diversas condiciones operativas.
Ser muy estables.
Ser de fácil regeneración después de la vida útil.
Mejorar la especificidad de la enzima.
Contener una gran cantidad de enzima.
Tener un rango adecuado de porosidad y tamaño de poro. Cuando los poros son pequeños apenas excluirá la proteína, el diámetro del poro debe estar en un rango apropiado.
El soporte debe poder cambiar el pH óptimo para la enzima.
Debe tener propiedades de adsorción antimicrobianas y no específicas.
Sobre la base de su composición química, las matrices de soporte se clasifican en dos categorías principales. Los materiales de soporte inorgánico y los materiales de soporte orgánico que pueden subdividirse en naturales y sintéticos.
Polímeros Naturales.
El alginato es un polisacárido aniónico derivado de la pared celular de las algas pardas. Está constituido, además, de sales de calcio, magnesio y sodio proveniente del ácido algínico y se ha utilizado ampliamente para la inmovilización en forma de perlas de alginato, geles de alginato-poliacrilamida y perlas de calcio-alginato. El enrejado de alginato con iones divalentes de Ca2+ Y glutaraldehído han mostrado una gran estabilidad en la inmovilización de enzimas. (Flores-Maltos et al., 2011).
La quitina y el quitosano son polímeros naturales muy usados como soportes para la inmovilización (Coello, 2019; Hernández, 2019). El quitosano se ha utilizado en combinación con alginato; las enzimas recubiertas de quitosano, sufren menos el efecto de lixiviación en comparación con el alginato debido a las interacciones iónicas entre la enzima y el soporte (Betigeri et al., 2002). Del mismo modo, un compuesto quitosano-arcilla mostró resultados favorables en el atrapamiento de enzima al tener grupos hidroxilo y amino, que enlazan fácilmente con las enzimas, junto a una alta porosidad. El quitosano en forma de perlas mostró también excelentes resultados al permitir la inmovilización del doble de enzimas (Chang et al., 2007).
Chern (2005), demostró que la unión de la quitina al dominio de quitinasa A1 de Bacillus circulans, tuvo una alta afinidad por lo que se empleó en la retención de D-hidaninasa.
Colágeno: Las propiedades del colágeno lo convierten en un buen sistema de soporte, es de naturaleza proteica y presenta buena capacidad para la retención de agua y una buena porosidad.
Durante la inmovilización, se forma un enlace covalente entre las cadenas laterales del colágeno y la enzima, lo que mantiene firmemente la enzima sobre el soporte. El colágeno es un polímero natural que se ha utilizado con éxito en la inmovilización de la enzima tanasa empleando glutaraldehído como agente de retención (Katwa et al., 1981). Las fibras de colágeno-Fe3 demostraron ser una excelente matriz de soporte para la inmovilización de catalasa al mantener una actividad significativa, incluso, después de 26 reutilizaciones (Chen et al., 2011).
Gelatina
La gelatina es un material hidrocoloide, rico en aminoácidos, y puede adsorber hasta diez veces su peso en agua. Se ha utilizado como sistema de vehículo mixto con poliacrilamida, donde la reticulación con acetato de cromo (III), resultó mejor que el sulfato de cromo (III) y el sulfato de potasio y cromo (III) (Emregul et al., 2006). De igual manera, el alginato de calcio con gelatina forma una plantilla para la deposición de fosfato de calcio que ha mostrado excelentes resultados en la inmovilización de enzimas y la gelatina en combinación con poliéster mostró una eficiencia de carga del 75%, en comparación con otros estudios que tenían una eficiencia de carga del 50% de la enzima (Shen et al., 2011; Ates, 2010).
Celulosa
La celulosa es el polímero natural más abundante y ha sido ampliamente utilizado para inmovilizar lacasa, glucoamilasa, a-amilasa, tirosinasa, lipasa entre otras enzimas (Mislovicova et al., 2004; Bryjak et al., 2007; Namdeo et al., 2009; Labus et al., 2011; Huang et al., 2011; Klein et al., 2011).
Los soportes celulósicos modificados han mostrado una gran capacidad de almacenamiento. En la degradación de almidón la enzima α-amilasa se inmovilizó en nanopartículas magnéticas recubiertas con dialdehído de celulosa que resultó en la formación de un nuevo sistema de degradación de almidón (Namdeo y Bajpai, 2009). Del mismo modo, se obtuvo un aumento de la tolerancia y la viabilidad de la enzima inmovilizándola sobre una película de celulosa líquida iónica activada con glutaraldehído (Klein et al., 2011).
Pectina
La Pectina es un polisacárido estructural de las plantas presente en la pared celular. Es un gelificante con buena capacidad de retención de agua. En la medicina se ha utilizado en el tratamiento de las lesiones cutáneas e inmovilizando la enzima papaína junto al glicerol (Ceniceros et al., 2003). Pectina-quitina y pectina-alginato de calcio, han sido estudiadas por su capacidad de formar complejos polielectrolitos altamente estables donde las enzimas quedan bien atrapadas. Mantienen una resistencia térmica y se evita la desnaturalización, además las propiedades catalíticas de las enzimas inmovilizadas fueron significativamente mayores (Gómez et al., 2006; Satar et al., 2008).
Polímeros sintéticos como soportes
Las resinas/polímeros de intercambio iónico son soportes insolubles con superficie porosa que han demostrado ser excelentes materiales para la retención de enzimas. Las resinas amberlite y celulósica son matrices renovables de gran superficie que se han utilizado en la inmovilización de una gran variedad de enzimas como las amilasas (Kumari et al., 2011). Algunos polímeros sintéticos utilizados como soportes enzimáticos se indican a continuación:
- cloruro de polivinilo, mostró excelentes resultados en la inmovilización de las enzimas glucosiltransferasa y alcohol deshidrogenasa e inhibiendo la inactivación térmica de la enzima (Shinde et al, 2018).
- micropartículas de poliuretano derivadas de alcohol polivinílico han sido empleadas en la inmovilización de enzimas de Aspergillus para producciones industriales. (Gonzalez et al., 2010).
- Epoxi modificado con ácido fumárico/metacrilado utilizado en aplicaciones industriales para la degradación de olefinas (Mohammadikish et al., 2019).
- Polianilina es un polímero semiflexible que se ha utilizado como soporte mediante uniones covalentes de las enzimas amilasa activadas (Xiangli et al., 2010; Ashly et al., 2011).
Materiales inorgánicos como soporte.
Una gran cantidad de materiales de naturaleza inorgánica pueden ser empleados como materiales de soporte en los procesos de inmovilización. El vidrio, los geles de sílice, alúmina, óxidos metálicos, zirconia y muchos otros son ampliamente utilizados ya que presentan una resistencia térmica y mecánica. Estos materiales también ofrecen resistencia a la degradación por los microorganismos al no funcionar como sustratos para el crecimiento o mantenimiento de hongos y bacterias. Las características fundamentales de los soportes inorgánicos son la rigidez y la porosidad. Estos soportes también tienen la característica no variar el diámetro y el volumen de sus poros, manteniendo un volumen y una forma fija. (Sirisha et al.,2016).
Sílice
Los soportes inorgánicos a base de sílice como el dióxido de silicio y el tetraóxido de silicio se utilizan, generalmente, para la inmovilización de enzimas. Existen polímeros que presentan los grupos SiO4 rígidos pero los grupos SiO2 son flexibles, además de esto presentan sitios hidrófilos como hidrófobos que le confieren propiedades de adsorción muy complejas.
Los soportes inorgánicos a base de sílice necesitan modificaciones y activación adecuada. Estas modificaciones, generalmente, se logran por tratamiento químico permitiendo la introducción de grupos aminos y la activación se logra por varios métodos de inmovilización. Un ejemplo clásico es la inmovilización de la enzima penicilina G amidasa, unida primero a dextrano e inmovilizada en gel de sílice con amino. Los resultados mostraronque se lograba una elevada estabilidad térmica, sirviendo de base para futuras inmovilizaciones (Burteau et., 1989).
De igual manera los trabajos de Dezott en 1995, mostraron las bases para la inmovilización en sílice activada. En este caso, la enzima peroxidasa eliminaba de manera más efectiva la contaminación por clorolignina del efluente de eucalipto. (Dezott et al., 1995).
Otros informes mostraron resultados muy favorables en la inmovilización de la enzima α-amilasa en nanopartículas de sílice. El biocomposito obtenido es introducido en la fabricación de detergentes (Soleimani et al., 2011).
En cuanto a la inmovilización de compuestos de naturaleza no proteica, también se ha reportado el rendimiento de inmovilización en este tipo de soportes. Sustancias con actividad antimicrobiana como los aceites esenciales fueron inmovilizadas en sílice amorfa. Se evaluó la actividad antimicrobiana de los compuestos una vez inmovilizados, resultando en un aumento de su actividad. (Ruiz et al., 2017).
Zeolita
Uno de los soportes microporosos de silíceo más utilizado es la zeolita, la cual presenta una gran superficie específicas que le aporta buenas propiedades para la inmovilización de enzimas y microorganismos.
Las zeolitas o 'tamices moleculares' son sólidos cristalinos microporosos con estructuras bien definidas y de alta selectividad según la forma. Son ampliamente utilizadas en procesos de adsorción molecular. Tienen una amplia aplicación en campos tan diversos como la petroquímica, procesos de intercambio iónico, separación de gases, etc.
Las zeolitas son una familia de materiales porosos muy importantes, académica e industrialmente. Sin embargo, el reducido tamaño de poro de estos materiales (generalmente inferior a 1,2 nm), supone una importante limitación para la difusión de moléculas voluminosas involucradas en procesos tan importantes como el craqueo de catalítico u otros en química fina o industria farmacéutica, donde necesariamente se requiere una porosidad en el rango del mesoporo (García et al.,2002; Zhang et al., 2018; Taghizadeh et al., 2020).
Disímiles son los reportes de trabajos relacionados con la inmovilización enzimáticas que han mostrado su utilización. Xing (2000) comprobó las excelentes propiedades para la inmovilización de α-quimotripsina en zeolitas microporosas usando diferentes solventes orgánicos en el proceso de atrapamiento. De igual manera, Chang y Chu (2007), demostraron que las zeolitas Y tenían mejores propiedades para la inmovilización de lisozima, aumentando la actividad de la enzima en comparación con otros soportes. Se considera que la superficie heterogénea de las zeolitas con múltiples sitios de adsorción es adecuada para modular las interacciones de la enzima y el soporte. (Datta et al., 2013)
Cerámica
Los materiales cerámicos están formados por fases cristalinas y/o vitrieas. En general los componentes de estos materiales, fases cristalinas y/o vitrieas, están constituidos por elementos metálicos y no metálicos. Los enlaces en las diferentes fases pueden tener naturaleza iónica o covalente. Estos materiales son empleados ampliamente en procesos de inmovilización. Reportes relacionados con la inmovilización de la enzima lipasa de Candida antartica sobre cerámica señalan que este soporte inerte podría ser empleado para realizar reacciones hidrolíticas y sintéticas; limitando la inhibición por retroalimentación (Weinberger et al. 2018; Mulinar et al., 2020). Otro ejemplo de material cerámico es la toyonita, cuya estructura de poros variable se puede modificar utilizando diferentes recubrimientos orgánicos (Kamori et al., 2000).
Vidrio
Las perlas de vidrio son uno de los soportes inorgánicos más utilizados. Su naturaleza porosa estándar y su dureza las convierten en un excelente material de soporte. Se han utilizado para inmovilizar varias enzimas como la α-amilasa. En este proceso, se encontró que las perlas de vidrio se funcionaban con grupos amino que contienen cloruro. De manera similar, la ureasa, cuando se inmovilizó en electrodos de pH de vidrio, sirvió como biosensor para monitorear la urea en muestras de sangre a niveles tan bajos como 52 mg/mL (Sahney et al., 2005). En una investigación más reciente la inmovilización de β-galactosidasa, en perlas de vidrio, para la producción de galacto-oligosacáridos mostró un aumento en la producción comparada; con la enzima libre. Adicionalmente se evidenció un aumento en la resistencia a los cambios bruscos de pH y temperatura. (Eskandarloo et al., 2018)
Carbón activado
Tanto el carbón activado natural como el modificado con ácido clorhídrico han mostrado excelentes propiedades para la retención de enzimas. La inmovilización de proteasa ácida y lipasas ácidas en partículas de carbón activado mesoporoso mostraron una eficiencia catalítica significativamente elevada. Mostrando que podían reutilizarse después de durante 21 ciclos de reacción. Estos estudios mostraron además el eficiente uso del área superficial del carbón activado para los procesos de atrapamiento enzimático (Kumar et al., 2010; Ramani et al., 2012; Daoud et al., 2010). Otros estudios mostraron excelentes resultados en la producción de bio-hidrógeno cuando se emplearon microorganismos inmovilizados sobre carbón activado. (Zhang et al., 2017)
Factores que influyen en la inmovilización.
Como se ha definido, la inmovilización exitosa de enzimas u otros materiales biológicos sobre soportes y las propiedades del biocatalizador resultante están determinadas en gran medida por varios factores. Estos incluyen en las condiciones experimentales, como el pH y la temperatura de la solución tampón; las propiedades del material, el tamaño de la enzima y las propiedades fisicoquímicas de los materiales de soportes, su porosidad y tamaño, morfología, tamaño de partícula, composición y otras. Específicamente en el caso de las enzimas, la presencia de grupos polares (grupos amino de lisina y/o grupos ácido de ácido glutámico), regiones superficiales apolares o residuos de azúcar influyen en gran medida en la inmovilización (Nair et al., 2018). En este caso abordaremos tres propiedades de los materiales de soportes que influyen significativamente en los procesos de inmovilización.
Tamaño de poro
Numerosos estudios han mostrado que la carga y la actividad de la enzima dependen, claramente, del tamaño de los poros del soporte. Por lo tanto, no todos los materiales porosos son aplicables para la inmovilización enzimática. Los portadores con diámetros de poro demasiado pequeños para acomodar moléculas enzimáticas, como las zeolitas microporosas, no proporcionan un soporte estable, debido a que las moléculas enzimáticas se adsorberán en la superficie externa y no estarán protegidas (Hartmann et al., 2010; Hartmann et al., 2013) Por el contrario, si los poros son mucho más grandes que las moléculas de la enzima, estas últimas no se pueden proteger y retener como en poros más pequeños. En el caso de la adsorción física, es posible que ocurra una lixiviación de la enzima.
Los materiales porosos a menudo se asocian con una gran superficie específica, sin embargo, no es una garantía para la obtención de altas cargas enzimáticas. Por ejemplo, aunque los materiales MCM-41 poseen una superficie muy grande, a menudo, para estos materiales se ha informado de una carga enzimática baja y tasas de inmovilización lentas. Dado que el tamaño de los poros de MCM-41 es típicamente de alrededor de 4 nm, están restringidos a la inmovilización de enzimas con tamaños relativamente pequeños. Por lo tanto, para alcanzar una alta carga de enzimática y una alta retención de actividad, se debe encontrar un compromiso entre el tamaño de los poros del soporte y el sitio de la enzima (Wang et al., 2005; Schlipf et al., 2013).
Tamaño de partícula y morfología
La morfología y el tamaño de las partículas del soporte tienen una fuerte influencia en la capacidad de inmovilización. Además, con respecto a las aplicaciones industriales a gran escala, estas propiedades del soporte a menudo influyen en la selección del sistema de reacción y la configuración del reactor. Por ejemplo, para un reactor de lecho fijo se requieren partículas de gran tamaño para reducir la caída de presión (Cao, 2005).
Lei et al., 2004 estudiaron la influencia de la morfología del soporte en el comportamiento de inmovilización de la lisozima. Se demostró que la cantidad de enzima que penetra a los poros aumenta con la disminución del tamaño de partícula de las sílices mesoporosas, lo que llevó a una mejora en la adsorción de enzimas. Por otro lado, Zhou et al., 2009 investigaron la influencia que ejerce la morfología de las partículas en la inmovilización de lipasa proveniente de Candida rugosa. Se observó que la inmovilización sobre sílice, en forma de vesícula, da como resultado una mayor estabilidad térmica y reutilización; en comparación con la inmovilización en la sílice en forma de varilla.
Otras investigaciones comparan tres tipos de soportes de sílice mesoporosa con diferentes tamaños de partículas (40 nm, 300 nm y 1000 nm) pero con el mismo tamaño de poro. En estos estudios las silices fueron utilizadas para la inmovilización de lipasas. Los resultandos mostraron que, aunque la carga de enzima fue similar, la actividad fue superior en las lipasas inmovilizadas en las esferas de 300 nm (Popat et al., 2011; Gustafsson et al., 2012).
Superficie química.
La naturaleza química de la superficie desempeña un papel muy importante en la unión de la enzima. La misma influye directamente en las fuerzas de interacción entre las biomoléculas y el soporte de inmovilización.
La hidrofobicidad o hidrofilicidad del soporte puede tener una fuerte influencia sobre el comportamiento de inmovilización y la actividad catalítica de las enzimas inmovilizadas. La mayoría de las enzimas tienen carácter hidrófilo y, por tanto, se adsorben más bien en soportes hidrófilos con una superficie polar. Sörensen et al., (2010), inmovilizaron lipasas de Thermomyces lanuginosus en superficies de soporte hidrófilos e hidrófobas. La actividad específica de la lipasa inmovilizada sobre el soporte hidrófilo fue superior a la enzima inmovilizada en soporte hidrófobo, así como su estabilidad en el almacenamiento.
Conclusiones.
Con un gran número de reportes científicos y una amplia gama de aplicaciones, la inmovilización de enzimas y productos biológicos es una de las técnicas más prometedoras para el desarrollo de los procesos biotecnológicos, altamente eficientes y económicamente competentes en el campo del monitoreo ambiental, biotransformación, diagnóstico, industrias farmacéuticas y alimentarias.
Constantemente se desarrollan nuevas estrategias de funcionalización de superficies que incluyen el uso de líquidos iónicos, soluciones metálicas, fabricación de geles y nanopartículas que logran modificar las propiedades del soporte.
Durante la revisión concienzuda de la bibliografía se encontraron solo reportes de estudios preliminares de la inmovilización de dos enzimas sobre un mismo soporte o el uso de una sola enzima en la eliminación de varios sustratos. Serían de interés investigaciones enfocadas en estos dos aspectos, las que contribuirían a un uso más eficiente de estos biomateriales. Por otro lado, deben divulgarse más las aplicaciones industriales en todo tipo soportes especialmente los materiales porosos como las zeolitas.
Las estrategias basadas en enzimas están reemplazando cada vez más los métodos químicos convencionales, tanto en laboratorios como en industrias, las mismas presentan una alta eficiencia y excelentes rendimientos. Sin embargo, la comercialización de enzimas inmovilizadas todavía se encuentra a un ritmo menor debido a sus costos y problemas de almacenamiento. La investigación debe centrarse en superar las limitaciones actuales relacionadas con las técnicas de inmovilización expresadas en nuestra revisión, a fin de ampliar el horizonte de aplicación integral.