Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Centro Azúcar
versão On-line ISSN 2223-4861
cen. az. vol.44 no.3 Santa Clara july.-set. 2017
ARTICULO
Estudio de la adsorción de ácidos orgánicos en ceniza de bagazo de caña de azúcar
Research of the adsorption of organic acids in sugarcane bagasse ash
Julio Omar Prieto García1*, Alfredo Curbelo Sánchez2, Yailet Albernas Carvajal2, Esnaider Rodríguez Suárez3, Juan Ribalta Quesada1 y Ariel Perez Leiva1
1 Departamento Licenciatura en Química. Facultad de Química y Farmacia. Universidad Central "Marta Abreu" de las Villas. Carretera a Camajuaní km 5 ½, Santa Clara, Villa Clara, Cuba.
2 Departamento de Ingeniería Química. Facultad de Química y Farmacia. Universidad Central "Marta Abreu" de las Villas. Carretera a Camajuaní km 5 ½, Santa Clara, Villa Clara, Cuba.
3 Departamento de Química. Facultad de Ciencias. Universidad Eduardo Mondlane. Avenida de Francia. Maputo, Mozambique.
*Autor para la correspondencia: Julio O. Prieto, Email: omarpg@uclv.edu.cu
RESUMEN
Se realiza un estudio de la adsorción de los ácidos acético, benzoico, butanóico, fumárico, maléico y succínico en ceniza de bagazo de caña de azúcar. El material adsorbente se caracteriza a través de parámetros físicos como densidad aparente, densidad aparente por aprisionamiento, densidad picnométrica, compresibilidad, porosidad, área superficial y tortuosidad. La muestra se analiza por Difracción de rayos X, Análisis térmico y Análisis infrarrojo cualitativo. Se determinan las isotermas para el proceso de sorción donde se aprecia que el modelo de Freundlich se ajusta para el ácido benzoico. El ácido acético se ajusta el modelo de Langmuir y Toth. El ácido succínico se ajusta al modelo de Bunauer- Emmett- Teller (BET). Los ácidos, butírico, maléico y fumárico se ajustan al modelo de Langmuir. Se establece que el modelo de primer orden se ajusta a la cinética de adsorción de los ácidos acético y benzoico, mientras que el resto de los ácidos se ajustan a un modelo de seudo segundo orden y para el caso de butanóico, succínico y maléico es posible la ocurrencia de procesos de quimisorción.
Palabras claves: ácidos carboxílicos, adsorción, cinética, termodinámica
ABSTRACT
In this research a study of the adsorption of acetic, benzoic, butanoic, fumaric, maleic and succinic acids on sugarcane baggase ash is made. The adsorber material is characterized through physical criteria such as apparent and pictometric density, compressibility, porosity, superficial area and tortuosity. The sample has been examined by X-rays Diffraction, thermal analysis, IR-quality analysis. The isotherm for the sorption process is determined, where it is shown that the Freundlich model is adjusted to benzoic acid, the Langmuir and Toth model to acetic acid, Bunauer- Emmett- Teller (BET) model to succinic acid and the butiric, maleic and fumaric acids are adjusted to Langmoir model. It is established that the first-order model is adjusted to the adsorption kinetics of the acetic and benzoic acids; while the rest of the acids are adjusted to a second-order model, in the case of the butanoic, succinic and maleic acids it is possible the occurrence of chemisorption processes.
Key words: carboxylic acid, adsorption, kinetics, thermodynamic
INTRODUCCIÓN
De los compuestos orgánicos que presentan acidez apreciable, los ácidos carboxílicos son los más importantes. Estos se caracterizan por la presencia del grupo carboxilo unido a un grupo alquilo o arilo. Son moléculas polares que pueden formar puentes de hidrógeno entre sí y con otros tipos de moléculas, esta asociación conlleva a que tengan una temperatura de ebullición mayor de lo común para un compuesto orgánico y justifica la solubilidad en agua sobre todo los de baja masa molecular, ya que al aumentar el tamaño de la cadena disminuye. Presentan un grupo de derivados funcionales entre los que se encuentran halogenuros de ácido, ésteres y amidas (Solomons y Frihle, 2016).
Las cenizas de bagazo de caña, poseen un conjunto de propiedades superficiales que se exigen a los adsorbentes y soportes de catalizadores: gran superficie específica, alta estabilidad térmica, capacidad de adsorción y homogeneidad en la distribución de centros, como se deduce de la estructura cristalina. Por tanto, estos materiales ofrecen una amplia gama de posibilidades para adsorbentes y el diseño o preparación de catalizadores (Tongpoothorn et al., 2011) (Pei-Sin et al., 2014) (Agouborde, 2008) (Gutiérrez-Segura et al., 2012), (Gregg y Sing, 1982), (Sing et al., 1985).
En la actualidad se está llevando a cabo una labor en el área de los sistemas mesoporosos y se ha adquirido un conocimiento bastante preciso sobre la estructura, los mecanismos de formación, el control de la morfología y las aplicaciones prácticas. Estos materiales mesoporosos atraen su atención por sus potenciales usos como adsorbentes y catalizadores, o soportes de catalizadores, pues una fase metálica puede ser soportada o incorporada a su red (Hernández-Morales et al., 2012).
En el presente trabajo se analiza el problema de establecer la relación entre la estructura de algunos ácidos dicarboxílicos y su adsorción en ceniza de bagazo de caña de azúcar. Es por ello que tiene como objetivo fundamental determinar los parámetros cinéticos-termodinámicos que rigen la adsorción de ácidos carboxílicos en soluciones modélicas acuosas en ceniza de bagazo de caña de azúcar.
MATERIALES Y MÉTODOS
2.1. Comportamiento químico.
En este análisis se determina la composición química del material.
Análisis infrarrojo cualitativo.
Para este análisis se utiliza el espectrofotómetro IR modelo WQF-510 y pastillas de KBr al 0,2 %.
2.1.1. Análisis térmico diferencial.
Para el análisis térmico se utiliza el derivatógrafo Q–1500D de firma MOM, termopares Pt (Pt / Rh), crisoles de cerámica, como referencia (atmósfera estática) crisol vacío. Termogravimetría(TG) = 100 mg, Análisis Térmico Diferencial(ATD) = 250 μV, velocidad de calentamiento de 10 oC / min y la velocidad del papel de 2,5 mm/min. La temperatura de trabajo es de 1000 oC y la masa de la muestra 100 mg.
2.1.2. Análisis por difracción de rayos X.
Se realizaen un difractómetro modelo X’PERT marca Philips, con radiación Kα1 (1,5106 Ǻ) de cobre con tensión de 40 kV y corriente de 40 mA radiación, velocidad del girómetro de 0,25 o/ min.
Propiedades físicas.
Hay una serie de parámetros físicos importantes en la determinación de los sólidos como son la densidad picnométrica, densidad aparente, densidad aparente por aprisionamiento o densidad granular, porosidad, compresibilidad, velocidad de flujo y tortuosidad.
Se emplean los ácidos acético, benzoico, butanóico, fumárico, maléico y succínico.
Los modelos empíricos evaluados en este trabajo se describen a continuación (Azizian, 2004), (Ejikeme et al., 2011), (Foo y Hameed, 2010).
Modelo de Dixon:
Modelo de Nicol:
Modelo de Fleming:
Modelo de La Brooy:
También se evalúan los siguientes modelos teóricos:
Modelo de pseudo primer orden:
Modelo de pseudo segundo orden:
Modelo de Elovich:
Modelo de difusión intrapartícula
Donde:
V: Velocidad de adsorción (mg / s · L).
C: Concentración en solución (mg / L)
q: Masa del adsorbato en la ceniza (mg / g)
t: Tiempo transcurrido desde el inicio de la experiencia (s).
Co: concentración inicial en solución (mg / L)
q+: Carga máxima de la ceniza. (mg /g)
k1...k10, K, n, Kads, C: son constantes características.
qe: capacidad de adsorción en el equilibrio (g/mg)
qt: capacidad de adsorción en el tiempo (g/mg)
α: velocidad inicial de sorción (mg/g · min)
β: constante de sorción (g/mg)
2.2. Termodinámica de la adsorción
Para la realización del estudio termodinámico se prepararan soluciones (40 mililitros) de cada ácido estudiado, de diferentes concentraciones, determinadas por valoraciones potenciométricas. Se ponen en contacto con 1 gramo del material utilizado como sorbente por el tiempo determinado en el estudio cinético a la temperatura de 25ºC. Posteriormente se separan por filtración y se determina la concentración de equilibrio.
Desde el punto de vista termodinámico se expresan los modelos utilizados.
Isoterma de Langmuir
Isoterma de Freundlich
Modelo de BET
Modelo de Langmuir-Freundlich
Modelo de Toth.
Modelo de Dubinin-Radushkevich
Modelo de Redlich.
para n = 1;1,5; 2 permite alcanzar los parámetros del modelo.
Modelo Combinado
Donde
KL = Constante de Langmuir
Ct = Concentración del fluido (mg/L)
KF =Constante de Freunlich
KB = Constante de BET
Ce = Concentración en el equilibrio (mg/L)
Co = Concentración inicial (mg/L)
KL-F= Constante de Langmuir-Freunlich
KT = Constante de Toth
qt = Capacidad de adsorción (mg/g)
qm = capacidad de adsorción máxima (mg/g)
βe = Coeficiente relativo a la energía de adsorción
E = Potencial de Polany (J/mol)
b = Constante
αγ = Constante
bγ = Constante
n = Coeficiente
bc = Constante
Del análisis del coeficiente de correlación lineal R2, obtenido a través de los gráficos se delimita cuáles datos se ajustan mejor a las isotermas descritas.
RESULTADOS Y DISCUSIÓN
La caracterización de la ceniza de bagazo de caña empleada se lleva a efecto a través de los diferentes parámetros físicos obtenidos como las densidades aparente, aparente por aprisionamiento y picnométrica, 0,212 g/ml, 0,259 g/ml y 0,5503 g/ml, respectivamente.
El factor de compresibilidad es del 18,2% que da una medida del bajo nivel de compactación del material. El valor de la porosidad es 61,5% lo que corresponde con una rugosidad y capilaridad media.
La superficie activa del adsorbente medida al emplear azul de metileno responde a 560 cm2/g y 610 cm2/g correspondiente a la adsorción del catión o de la molécula del colorante, respectivamente.
La tortuosidad corresponde a un valor de 1,79, valor de consideración dentro de los sólidos porosos, lo cual justifica su elevada capacidad de sorción.
3.1. Análisis químico:
Del análisis químico resulta la siguiente composición para 1 gramo del producto:
Ca 0,0970 g, Na 0,0014 g, Mg 0,0035 g, K 0,0006 g, Al 0,0003 g y SiO2 0,8140 g. El por ciento de componentes solubles en agua es 3,94 y de componentes orgánicos es 6,33.
3.2. Análisis térmico diferencial:
Pico endotérmico amplio a 550oC correspondiente a la desorción de las moléculas de agua de constitución.
Análisis de rayos-X:
Del referido análisis resulta la siguiente composición de fases: NaCl, CaF2, CaCO3, Al2O3, Fe2O3, Cr2O3, SiO2 (cuarzo) y CuFeS4
Análisis infrarrojo cualitativo:
Se realiza en pastilla prensada de bromuro de potasio donde se obtienen las siguientes bandas:
450-500cm-1 Oscilación Metal-Oxigeno, vibración simétrica.
617.81cm-1 Oscilación Metal-O-Metal vibración simétrica.
789cm-1 Oscilación Metal-O-Metal vibración simétrica.
1452,89cm-1 Oscilación Metal-O-Metal vibración asimétrica.
3500cm-1 (no señalado) Agua que puede ser adsorbida, absorbida o de constitución
3.3. Estudio cinético
El estudio cinético muestra que el proceso de adsorción puede ocurrir en tiempos variables en dependencia de los ácidos que puede ser desde 2 horas como el ácido acético hasta 10 minutos como el caso de los ácidos dicarboxílicos insaturados.
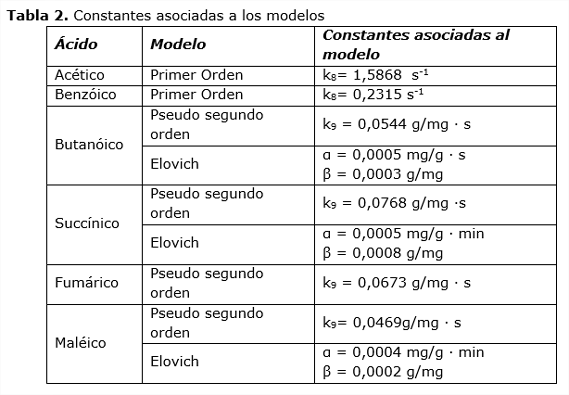
Seguidamente se muestran los resultados cinéticos obtenidos al aplicar los modelos empíricos y teóricos correspondientes al estudio en las condiciones antes referidas.
A continuación se muestran los valores de cada una de las constantes de los modelos que se ajustan al proceso:
En términos generales la cinética de pseudo primer orden responde a la interacción de la molécula orgánica a través del carbono con baja densidad de carga negativa al sitio básico de adsorción del material. En cambio el ácido butanóico responde a la interacción del carbono del grupo carboxilato y del carbono vecino a este por la presencia de una densidad parcial de carga positiva para responder a un modelo cinético de pseudo segundo orden, que pondera a la interacción de dos puntos de la molécula orgánica al adsorbente. En cuanto a los ácidos fumárico y maléico la interacción de los dos carbonos de los grupos carboxilatos con dos sitios básicos del adsorbente explica el modelo cinético de pseudo segundo orden. Es de señalar la posible interacción de tipo químico de los ácidos succínico, maléico y butanóico.
3.4. Estudio termodinámico.
El estudio consiste en la determinación de la isoterma de adsorción donde se establecen las relaciones más generales en concordancia con los modelos utilizados.
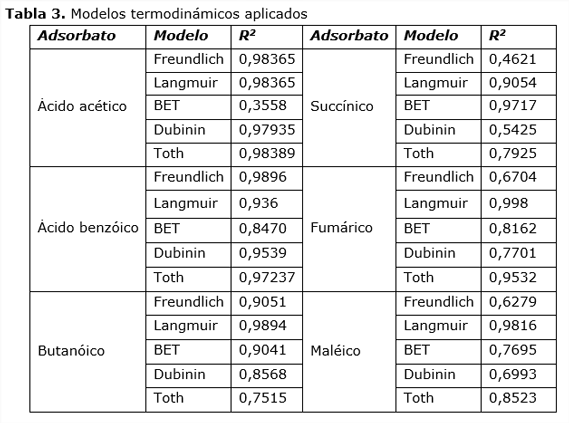
A continuación se muestran los coeficientes de correlación bilineales para los diferentes modelos termodinámicos.
Para el ácido benzóico el modelo de Freudlich se ajusta con un coeficiente de correlación lineal de 0,9896. Se determinan los valores de n y K, siendo 1,9 y 0,00711 L/mg, respectivamente. El valor de n permite afirmar que el adsorbente es de calidad elevada.
Para el ácido fumárico el modelo de Langmuir permite calcular el peso de la monocapa 0,00044 mol/g de adsorbente y el valor de la constante K que es 9205,05 L/mol.
El análisis para el ácido maléico, al aplicar el modelo de Langmuir la masa de la monocapa es 0,0004 mol/g y la constante 5017,07 L/mol .El modelo de Langmuir ajustado a la adsorción del ácido butírico permite obtener la masa de la monocapa, 0,00083 mol/g y la constante del proceso 248,52 L/mol.
En cuanto a la isoterma del BET aplicable a la adsorción del ácido succínico se obtiene el valor de KB=8,83*109 y qm= 1,13*10-14 mol/g.
Los ácidos fumárico y maléico no forman multicapa debido a la nube Π que poseen y que provoca repulsión entre las moléculas. Las diferencias de los valores de los parámetros cinéticos responden a la isomería geométrica. La posibilidad de formación de puentes de hidrogeno intramoleculares en el isómero cis puede contribuir a la diferencia de los valores de los parámetros cinéticos. El ácido succínico responde al modelo de BET ya que al tener sitios básicos el adsorbente ocurre en el ácido una pérdida del ion hidroxónio al quedar el anión carboxílico con un enlace tricéntrico y una baja densidad de carga negativa en el carbono, lo cual provoca atracción a los sitios de adsorción. Esta molécula adsorbida puede con el grupo carboxilo interactuar con otra molécula a través de puentes de hidrógeno y así sucesivamente para formar una multicapa. Los ácidos acético, benzoico y butánico responden a una atracción del carbono del grupo carboxilato sobre los sitios básicos del adsorbente, lo cual explica el ajuste a los modelos de Frendlich, Langmuir y Toth, respectivamente.
CONCLUSIONES
En el presente trabajo se han estudiado algunas propiedades químicas y físicas de la puzolana en cuestión, así como su empleo como sorbente. Los resultados han permitido concluir:
1. El producto obtenido por la ignición de residuos sólidos de la industria azucarera es poco soluble en agua. Posee un color gris con morfología porosa. Material con compresibilidad y superficie específica dentro de los límites de los sólidos porosos. Se destaca su baja densidad aparente.
2. Se establece que el modelo de primer orden se ajusta a la cinética de adsorción de los ácidos acético y benzóico, mientras que el resto de los ácidos se ajustan a un modelo de seudo segundo orden. Para el caso de butanóico, succínico y maléico es posible la ocurrencia de procesos de quimiosorción.
3. Se determinan las isotermas para el proceso de sorción donde se aprecia que el modelo de Freundlich se ajusta para el ácido benzoico, los modelos de Langmuir y Toth para el acido acético y BET para el acido succínico. Los ácidos butírico, maléico y fumárico se ajustan al modelo de Langmuir.
REFERENCIAS
Azizian, S., Kinetic Models of Sorption a Theoretical Analysis., Journal Colloid and Interface Science, Vol. 276, 2004, pp. 47-52.
Agouborde, L.I., Remoción de metales pesados por medio de adsorbentes no convencionales., Tesis presentada en opción al grado científico de Máster en Ciencias de Recursos Naturales, Universidad de la Frontera, Temuco, Chile, 2008.
Ejikeme, P.M., Okoye, A.I. y Onukwuli, O.D., Kinetics and isotherm studies of Cu (II) and Pb (II) ions removal from simulated waste water by Gambeya albida seed shell activated carbon., The African Review of Physics, Vol. 6:0017, 2011, pp. 143-152.
Foo, K.Y., y Hameed, B., Review. Insights into the modeling of adsorption isotherm systems., Chemical Engineering Journal, Vol. 156, 2010, pp. 2-10.
Gregg, S.J., Sing, K.S.W., Adsorption, surface area, and porosity., Publisher: London; Academic Press, 1982, pp. 234-236.
Gutiérrez-Segura, E., Solache-Ríos, M., Colín-Cruz, A. and Fall, C., Adsorption of cadmium by Na and Fe modified zeolitic tuffs and carbonaceous material from pyrolyzed sewage sludge., J. Environ. Manage. Vol. 97, 2012, pp. 6-13.
Hernández-Morales, V., Nava, R., Acosta-Silva, Y.J., Macías-Sánchez, S.A., Pérez-Bueno, J.J. y Pawelec, B. Adsorption of lead (II) on SBA-15 mesoporous molecular sieve functionalized with -NH2 groups., Micropor. Mesopor. Mat. Vol. 160, 2012, pp. 133-142.
Pei-Sin, K., Siew-Ling, L., Sie-Tiong, H., Yung-Tse, H., y Siew-Teng, O., Removal of hazardous heavy metals from aqueous environment by low-cost adsorption materials., Environmental Chemistry Letters, Vol. 12, No.1, 2014, pp. 15-25.
Sing, K.S.W., Everett, D.H., Haul, R.A.W., Moscou, L., Pierotti, R.A., Rouquerol, J., Siemieniewska, T., Reporting physic sorption data for gas/solid systems with special reference to the determination of surface area and porosity (recommendations 1984)., Pure Appl Chem, Vol. 57, 1985, pp. 603–619.
Solomons, T.H., and Frihle, C.B., Organic Chemistry., Publisher: John Wiley & Sons, Inc., Edtion: 12th, 2016, pp. 765-766.
Tongpoothorn, W., Sriuttha, M., Homchan, P., Chanthai, S., Ruangviriyacha, C., Preparation of activated carbon derived from Jatropha curcas fruit shell by simple thermochemical activation and characterization of their physicochemical properties., Chem Eng Res Des, Vol. 89, No. 3, 2011, pp. 335-340.
Recibido: Octubre 20, 2016
Revisado: Noviembre 27, 2016
Aceptado: Marzo 17, 2017