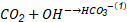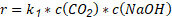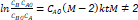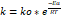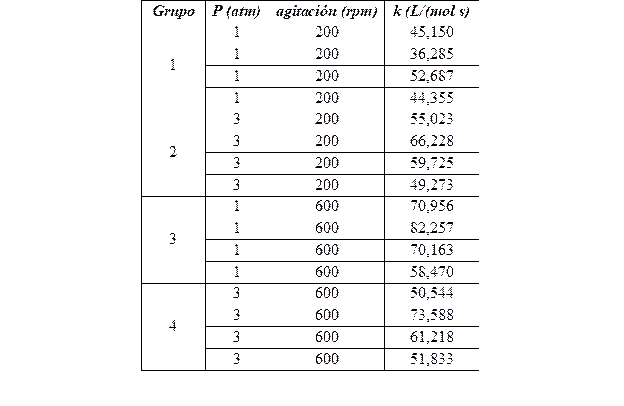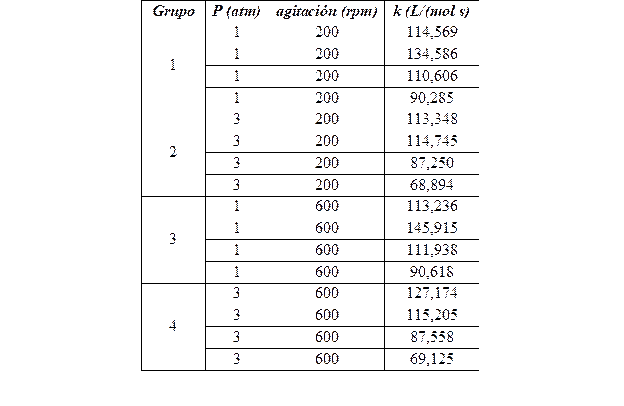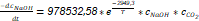INTRODUCCIÓN
El agua aprovechable para el uso humano y el mantenimiento de los ecosistemas es una cifra realmente baja, y solo alcanza el 0,7 % del volumen total (200 mil km3 entre superficial y subterránea) según Duque, (2018). De aquí se deriva la importancia en el cuidado y control que debe tenerse de la contaminación que puede producirse en los cuerpos receptores.
El uso desmedido de ciertos recursos, la ausencia de una protección o debido control generalizado en el ambiente o la incapacidad de los procesos e instalaciones existentes para ello, ha traído como consecuencia un incremento en la contaminación de la biosfera terrestre (Romero y col., 2016).
En el caso de las aguas residuales industriales, un pH de vertido superior a 9 está prohibido habitualmente, tal como lo regula la norma cubana, NC. 27, (2012). Por todo ello, en multitud de ocasiones es necesario regular el pH del agua en cuestión. Dicha regulación irá en función de las características del agua y siempre se tratará mediante reacciones de neutralización, o ácido-base.
La industria textil utiliza grandes cantidades de agua en etapas, como el pretratamiento, el blanqueo, el teñido y el estampado, que demandan aproximadamente de 100 a 200 L de agua de alta calidad por kilogramo de producto textil y, en consecuencia, generan gran volumen de agua residual de tintura. Buscar un método efectivo para tratar y reutilizar las aguas residuales de la industria textil es un gran desafío (Hua y col., 2019).
Las etiquetas ecológicas para los productos textiles y las restricciones más estrictas sobre las descargas de aguas residuales están obligando a los procesadores húmedos de textiles a reutilizar el agua y los productos químicos del proceso.
Las aguas residuales alcalinas son un subproducto de muchas industrias textiles. Por lo tanto, deben neutralizarse antes de enviarlas a una planta de tratamiento biológico o descargarlas en una alcantarilla según lo reportado por Yaseen y Scholz, (2019). Se requiere un ajuste del pH mediante la adición de productos ácidos como HCl, H2SO4, HNO3, H3PO4 o CO2. El reactivo de neutralización (ácido) utilizado debe satisfacer esencialmente características económicas y técnicas. Se recomienda que sea compatible con los compuestos del efluente, para mejorar las condiciones para los tratamientos posteriores y no implicar una no conformidad con las normas. De hecho, el dióxido de carbono se usa cada vez más para neutralizar las aguas de proceso alcalinas en muchas industrias. Es necesario determinar la cinética de la reacción de neutralización entre las aguas residuales textiles y el dióxido de carbono para poder concebir un sistema de tratamiento que esté en concordancia con la rapidez de la reacción, con lo que el proceso será más eficiente.
Se puede concebir la rapidez de reacción como una multiplicación de dos funciones de variables independientes (temperatura y composición). La función de la temperatura se describe como constante de velocidad (k), aquí se incluye la reactividad de las moléculas, que depende de la temperatura y la presencia del catalizador. Existen relaciones simples entre las concentraciones y la rapidez de reacción, como la ley de potencias, que se obtienen del ajuste de los datos experimentales; en estas relaciones, los órdenes de reacción pueden o no coincidir con los coeficientes estequiométricos. Tienen la ventaja de que son fáciles de determinar, pero solo son confiables dentro del intervalo donde se obtuvieron los datos experimentales de acuerdo con Villarreal y Cuevas-García, (2021).
En la literatura, según varios autores (Pohoreckl y Moniuk, 1988), (Haubrock y col., 2007), la cinética de la reacción, Ecuación 1, generalmente se describe usando una reacción irreversible de segundo orden que aparece representada en la Ecuación 2.
Donde:
k1: constante específica de velocidad de reacción (L/mol s).
r: velocidad de reacción (mol/L s).
c (CO2): concentración de dióxido de carbono para diferentes tiempos (mol/L).
c (NaOH): concentración de NaOH para diferentes tiempos (mol/L).
Todos los posibles efectos de no idealidades se agrupan en la constante de velocidad de reacción k1. Este enfoque es suficiente para representar los datos experimentales de un solo estudio específico.
La composición de las aguas residuales de la industria textil varía de país a país, dependiendo del proceso, el equipo utilizado en la fábrica, tipo de tejido producido, productos químicos aplicados, el peso de la tela, época del año. El sector textil es uno de los grandes contribuyentes al deterioro del entorno. Los principales impactos ambientales relacionados con esta industria tienen que ver con las aguas residuales que genera y con la carga química que las mismas contienen, (Córdova y col., 2020).
Por todo lo anterior, esta investigación tiene como propósito definir la ley de velocidad para la reacción entre las aguas residuales textiles y el dióxido de carbono en la UB “Desembarco del Granma”.
MATERIALES Y MÉTODOS
2.1. Materiales empleados
Se empleó agua residual, obtenida por muestreo en la planta de tratamiento de residuales líquidos de la textilera “Desembarco del Granma”. Las muestras fueron compuestas, tomándose a intervalos de 1 hora durante 8 horas de trabajo. Al agua se le realizó una caracterización de parámetros físicos y químicos. Los procedimientos analíticos utilizados para ello, así como la simbología y unidades de medición, se corresponden con lo establecido por Baird y Eaton, (2017). Para realizar los ensayos de neutralización se empleó CO2 (g) suministrado por la Empresa Gases Industriales de Cuba.
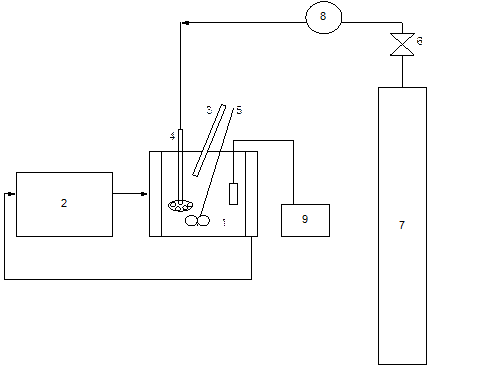
Se estudió la reacción de neutralización entre las aguas residuales textiles y el dióxido de carbono. Se realizaron experimentos en un reactor discontinuo enchaquetado de vidrio (1), con un volumen de 2 litros, al cual se acopló un termostato (mlw-U15) (2), con el objetivo de regular la temperatura de la reacción de forma que garantizara las condiciones isotérmicas para cada experimento. Mediante un termómetro (3) introducido en el reactor se verificó el valor de la temperatura en cada ensayo. Se empleó un difusor (4) para burbujear el gas y un agitador de paletas (5). Estos dispositivos permiten lograr un mejor mezclado de los reaccionantes (Castillo, 2013) y la difusión del CO2 de forma que se disminuyan los defectos de mezclado, aguas muertas, vórtice. A través de una válvula (6) se controló el paso del CO2, almacenado en un cilindro (7) hacia el reactor. La medición de la presión se llevó a cabo utilizando un manómetro GENEBRE (8) con una escala comprendida entre 0 y 600 kPa. Se midió el pH de la disolución mediante un pH-metro “HANNA” (9). En la Figura 1 se muestra un esquema de esta instalación.
2.2 Método usado para determinar la expresión cinética
Los métodos de obtención de datos cinéticos pueden ser químicos, físicos o de extracción de muestras. En este estudio se realiza el seguimiento y medición del pH como propiedad característica de fácil medición. En el diseño experimental se consideraron como variables independientes la temperatura, la presión y la agitación. El valor mínimo de temperatura seleccionado fue 30 °C porque las aguas residuales ingresan a la planta de tratamiento con valores entre 35 y 40 °C y los valores de temperatura promedios anuales de la localidad no sobrepasan los 30°C. Se consideró como valor máximo 50 °C teniendo en cuenta que la solubilidad del CO2 (g) disminuye al aumentar la temperatura de acuerdo con Speight, (2002). La presión debe ser menor de 520 kPa para que el CO2 se encuentre en estado gaseoso a la temperatura de trabajo según Perry, (1992) y pueda ser burbujeado al reactor. Se seleccionó el intervalo entre 100 y 300 kPa porque presiones elevadas implican un equipamiento más costoso.
Para obtener la expresión cinética existen diversos métodos; así se cuenta con: el método integral, el análisis diferencial y la regresión no lineal de acuerdo con lo reportado por Herrera, (2020). El método integral es el más rápido de todos para determinar la ley de velocidad si el orden de reacción está entre cero, uno o dos, el método también es útil para determinar los demás parámetros cinéticos de la ecuación de Arrhenius.
Para realizar el análisis de los datos obtenidos experimentalmente, con el objetivo de hallar la expresión de la ley de velocidad, se utilizó el método integral de análisis de datos cinéticos. Se empleó la Ecuación 3, para la elección de la misma se tuvo en cuenta la relación de alimentación, así como la estequiometría.
Donde:
CAO: concentración inicial de NaOH (mol/L) (determinada a partir de medición de pH del agua residual a la entrada de la planta de tratamiento).
CBO: concentración inicial de CO2 (mol/L).
CA: concentración de NaOH para diferentes tiempos (mol/L).
CB: concentración de CO2 para diferentes tiempos (mol/L).
M: relación de alimentación.
k: constante específica de velocidad de reacción (L/mol s).
t: tiempo (s).
Al aplicar el método integral se obtuvieron los diferentes valores de k para los distintos tiempos. Este procedimiento se llevó a cabo tanto para la temperatura de 30 °C como para 50 °C. Se despejó k de la ecuación 3 y se determinaron varios valores de la misma.
Para determinar la energía de activación y el factor de colisión se utilizó la Ecuación 4 (ecuación de Arrhenius). Se siguió la metodología propuesta por Levenspiel, (2004) y Matos, (1986).
Donde:
ko: factor de colisión (L/(mol s)).
Ea: energía de activación (J/mol).
T: Temperatura (K).
R: constante universal de los gases (J/(molK)).
2.3. Procesamiento estadístico
Se realizaron pruebas de hipótesis no paramétricas (muestras independientes) con el objetivo de comprobar que las constantes específicas de velocidad solo dependen de la temperatura. Se consideraron cuatro grupos para cada valor de temperatura (30 y 50°C). La estructura de los grupos se muestra en la Tabla 1.
RESULTADOS Y DISCUSIÓN
3.1 Caracterización del agua residual
Se realizó la caracterización del agua residual y se muestran los resultados en la Tabla 2.
Tabla 2 Características de las aguas residuales de la textilera “Desembarco del Granma” utilizadas en los experimentos
| Parámetros | Valor |
|---|---|
| pH | 9,0 |
| Conductividad Eléctrica (μs/cm2) | 1 235 |
| Temperatura ( ºC) | 35 |
| Sólidos sedimentables (mg/L) | 1 |
| DBO5 (mg/L) | 250 |
| DQO de reflujo (mg/L) | 424 |
| Nitrógeno total (mg/L) | 63 |
| Fósforo total | 0,28 |
| SST(mg/L) | 25 |
| SSV (mg/L) | 7 |
| SSF(mg/L) | 18 |
| n-Hexano (mg/L) | 8 |
Se obtuvo un pH de 9, básico. Este valor está dado fundamentalmente por la presencia de NaOH en las aguas residuales, debido al uso de esta sustancia en los procesos de blanqueo y mercerizado que se llevan a cabo en la textilera. El mercerizado es el tratamiento de los hilos y tejidos de algodón y poliéster con una solución de sosa cáustica para que resulten brillantes y más resistentes. Además, el tintado del algodón se realiza con un pH de entre 9,5 y 11, este pH se consigue con Na2CO3 y/o NaOH. Los valores de DQO de reflujo y DBO5 fueron 424 y 250 (mg/L) respectivamente. Los mismos se asocian a la presencia de sustancias como los compuestos azoicos presentes en los colorantes y que no se fijan totalmente al tejido. Los resultados obtenidos relacionados con la generación de gran cantidad de efluentes contaminados por colorantes, auxiliares químicos y sólidos suspendidos en el teñido han sido reportados también por otros autores, Morillo, (2012) y (Hussain y col., 2018).
3.2. Determinación de las constantes específicas de velocidad
En las Tabla 3 y Tabla 4 se muestran los valores de las constantes específicas de velocidad para la temperatura de 30°C y 50°C, respectivamente. Las mismas fueron determinadas considerando los valores de pH y mediante el empleo de la Ecuación 3.
La constante de velocidad k es el término dependiente de la temperatura dentro de la ley de velocidad, pero puede implicar una dependencia en otros factores asociados a la reacción como catalizadores, el solvente, fuerza iónica, entre otros, sin embargo muchas veces se puede despreciar la influencia de estos factores obteniendo buenos resultados para muchos datos experimentales al aplicar la ecuación de Arrhenius. En el estudio realizado no se emplearon catalizadores.
3.3. Validación estadística de las constantes específicas de velocidad
Al realizar las dos pruebas de hipótesis no paramétricas para los valores de las constantes de velocidad específica de la reacción (k) hallados experimentalmente para la temperatura 30°C y 50°C se obtuvieron los valores de sigma de 0,171 y 0,76 respectivamente. La hipótesis nula considerada en cada caso es que no existía diferencia significativa entre los valores de k a una misma temperatura y la hipótesis alternativa es que sí había diferencias entre los valores de k. Como los valores de sigma, utilizando el test de Kruskal-Wallis, son superiores a 0,05, se acepta la hipótesis nula por lo que no existen diferencias significativas entre los cuatro grupos considerados para cada temperatura.
Se determinó el valor promedio de las constantes de velocidad específica para las temperaturas, de 30°C y 50°C, los cuales son 57,98 y 105,94 L/(mol s) respectivamente.
Se realizó una prueba de hipótesis no paramétrica para los valores de las constantes de velocidad específica de la reacción (k) obtenidos experimentalmente para las temperaturas de 50 y 30 °C. Se obtuvo un nivel de significación inferior a 0,05 (0,001) por lo que se rechaza la hipótesis nula que plantea que la distribución de las k es la misma entre las categorías de temperatura. Este resultado concuerda con lo expresado en la ecuación de Arrhenius, (Levenspiel, 2004), ya que un aumento de temperatura incrementa la energía de las partículas, la efectividad de los choques y como consecuencia la velocidad de la reacción. El factor de colisión obtenido tiene un valor de 978532,58 L/ (mol s)
Se calculó la energía de activación, cuyo valor es 24,5 kJ/mol, próximo al reportado por Himmelblau y Babb, (1958) (21,9 kJ/mol) para la reacción entre el dióxido de carbono y el hidroxilo (1) y en el orden del reflejado por otros autores, (Pohoreckl y Moniuk, 1988). Se corrobora que la reacción entre el CO2 y las aguas residuales de la textilera puede ser considerada como una reacción irreversible de segundo orden, cuya expresión completa de la ley de velocidad se muestra en la Ecuación 5.
CONCLUSIONES
El agua residual de la textilera “Desembarco del Granma” presenta un pH superior al neutro, por lo que antes del proceso biológico al que será sometida, se precisa de un ajuste del pH mediante la adición de CO2. Esto posibilitará un proceso tecnológico más compatible tanto desde el punto de vista técnico como ambiental.
Las constantes de velocidad específica para las temperaturas de 30°C y 50°C determinadas son 57,98 y 105,94 L/ (mol s) respectivamente para la reacción de neutralización del agua residual textil con CO2.
La reacción entre el agua residual de la textilera “Desembarco del Granma” y el CO2 es de segundo orden y presenta un valor de energía de activación de 24,5 kJ/mol.