INTRODUCCIÓN
Las garrapatas son artrópodos ectoparásitos que pueden transmitir agentes patógenos causantes de enfermedades a los humanos y animales que infestan. 1 Esta capacidad vectorial de las garrapatas es especie específica, de ahí la importancia de la clasificación taxonómica precisa de las especies de garrapatas. 2
Las especies Rhipicephalus microplus sensu lato (s. l.) y Amblyomma cajennense s. l. son las principales que parasitan rumiantes en Cuba. 3,4 Diferentes estudios morfológicos, 5) moleculares 6 y de entrecruzamiento entre individuos de diversas áreas geográficas 7,8 han sugerido que el taxón Amblyomma cajennense que antes era considerado como una sola especie, es un complejo formado por 6 especies. 5,9) Según las características de un ejemplar cubano conservado en la colección nacional de garrapatas del museo de Georgia, Estados Unidos se determinó que A. mixtum era la única especie del complejo presente en la isla de Cuba. 9 Sin embargo, otro estudio donde se evaluó la preferencia de hábitat de las especies de este complejo, según las condiciones de humedad y temperatura, sugirió que pudiera haber un solapamiento de los nichos para A. mixtum y A. cajennense en Cuba. 10 Después de estos informes, no han existido otros trabajos que hayan sustentado científicamente la posición taxonómica de los ejemplares del complejo A. cajennense presentes en Cuba.
La especie Rhipicephalus microplus, conocida como la garrapata del bovino, presenta similitudes morfológicas con otras especies que pertenecen a un complejo denominado R. microplus del cual forman parte R. annulatus, R. australis y R. microplus dividida en 3 clados (A, B y C). 11 El clado A o sensu stricto (s. s.) agrupa a individuos del sur de América, África y el sur de Asia; el clado B agrupa a individuos de China y el clado C incluye individuos del Norte de la India, Malasia, 12 Bangladesh, Pakistán y Myanmar. 13 El Laboratorio Nacional de Parasitología (LNP) de Cuba posee las únicas colonias de garrapatas R. microplus del país establecidas a partir de aislamientos en la provincia de Ciego de Ávila.
El objetivo de este trabajo fue la clasificación taxonómica precisa de 4 aislamientos cubanos de garrapatas del complejo Amblyomma cajennense y de los ejemplares de las 2 colonias de garrapatas R. microplus establecidas en el LNP usando las claves morfológicas descritas para cada especie y análisis filogenéticos basados en secuencias de ADN de genes mitocondriales y nucleares.
MÉTODOS
Especímenes de garrapatas
Se realizaron 4 aislamientos de garrapatas pertenecientes al complejo Amblyomma cajennense en localidades del occidente y centro del país (figura 1). En el municipio Artemisa (22°48′49″N 82°45′48″O) y en la Isla de la Juventud (21°45′N 82°51′O) se colectaron ninfas alimentadas en caballos (Equus ferus caballus). En el municipio de Jatibonico (21°56′47″N 79°10′03″O) en la provincia de Sancti Spíritus se colectaron hembras repletas, alimentadas en carneros (Ovis orientalis aries) y en el municipio de la Ciénaga de Zapata (22°20′00″N 81°37′00″O) de la provincia de Matanzas se colectaron ninfas alimentadas en perros (Canis lupus familiaris). Todos los ejemplares colectados se mantuvieron en condiciones controladas (28 °C de temperatura y 80 % ± 5 % de humedad relativa) en el laboratorio de Salud Animal del CIGB hasta que alcanzaron el estado adulto usado para la clasificación. En el caso de las hembras repletas colectadas se pusieron a ovopositar y para la obtención de adultos, todos los estadios inmaduros fueron alimentados en conejos (Oryctolagus cuniculus) según la metodología establecida en nuestro laboratorio. 14
Las colonias de garrapatas del LNP se nombraron de acuerdo a las localidades donde se colectaron los especímenes usados para el establecimiento de dichas colonias en Cayo Coco (CC) al norte de la provincia de Ciego de Ávila (22º30′32.45′′N 78º24′25.1′′ O) y la localidad de Manga Larga (ML) en el municipio Bolivia de la provincia de Ciego de Ávila (22º04′30′′N 78º21′1′′O). El estudio de estas colonias se realizó usando adultos no alimentados recolectados de bovinos artificialmente infestados con larvas alrededor del día 15 después de la infestación (figura 1).
Secuencias de genes provenientes de especímenes de garrapatas R. microplus de una colonia mantenida en el LNP de la cepa mexicana de referencia Media Joya (MJ) se incluyeron en los análisis filogenéticos. Esta cepa perteneció a la especie R. microplus s. s. o clado A y fue amablemente proporcionada por el Centro Nacional de Servicios de Verificación de Sanidad Animal (CENAPA) de México. Esta cepa se aisló originalmente en el Instituto Nacional de Silvicultura, Agricultura y Ganadería (INIFAP) de Jiutepec en Morelos en el año 2001 a partir de ganado bovino infestado en el municipio de Tapalpa en el estado de Jalisco, México (19º 57′ 0"N, 103º 46’ 0"W). 15

Fig. 1 Mapa de Cuba. Las flechas negras indican las localidades en las que se llevaron a cabo los muestreos de especímenes de garrapatas del complejo Amblyomma cajennense y las rojas las localidades de los aislamientos a partir de los cuales se establecieron las colonias de garrapatas en el LNP. 1) Municipio de Artemisa en la provincia de Artemisa (22º 48′ 49′′ N 82º 45′ 48′′ O); 2) Localidad de Nueva Gerona en el Municipio Especial Isla de la Juventud (21º 53′ 05′′ N 82º 48′ 04′′ O);3) Municipio Ciénaga de Zapata en la provincia de Matanzas (22º 20′ 00′′ N 81º 37′ 00′′ O) y 4) Municipio Jatibonicoen la provincia de Sancti Spíritus (21º 56′ 47′′ N 79º 10′ 03′′ O); I) Cayo Coco al norte de la provincia de Ciego de Ávila (22º 30′ 32.45′′ N 78º 24′ 25.1′′ O) y II) Localidad de Manga Larga en el municipio Bolivia de la provincia de Ciego de Ávila (22º 04′ 30′′ N 78º 21′ 1′′ O).
Análisis morfológico
Se realizó a partir de 40 ejemplares adultos no alimentados de ambos sexos, 20 hembras y 20 machos de cada aislamiento y de cada colonia. Para los especímenes del complejo A. cajennense se analizaron las principales estructuras de valor taxonómico según la descripción de Nava et al.9) y para los especímenes del complejo R. microplus las claves taxonómicas descritas por Walker 16. Las características de coloración y ornamentación de los escudos se observaron bajo estereoscopio (Kyowa Optical, Model SDZ-8) y se tomaron fotografías con una cámara (Power Shot A640, Canon, Japón) acoplada al mismo. La caracterización y medición de las estructuras con valor taxonómico se realizó a partir de fotografías obtenidas mediante un microscopio electrónico de barrido (SEM, de sus siglas en inglés scanning electron microscope, TESCAN MIRA-3 FE) en el CEA y procesadas mediante el programa Digital Micrograph™ (Version 2.32.888.0).
Antes de ser observadas por SEM, las garrapatas se fijaron durante 20 min a 4 ºC en 3 % de solución de glutaraldehído. Luego se lavaron 3 veces con solución salina tamponada con fosfato (PBS-NaCl 135 mM, 8 mM Na2HPO4, KCL 3 mM, KH2PO4 1,5 mM, pH 7,2) y se sumergieron en 1 % de tetróxido de osmio (OsO4) durante 20 min a 4 ºC. Posteriormente, se lavaron 3 veces con PBS y se deshidrataron en concentraciones crecientes de etanol desde el 50 al 99 % durante 10 min en cada una, a 4 ºC. Posteriormente, se secaron a -62 ºC y 1,2 Pa durante 18 h en una liofilizadora (modelo FD-10 V) y por último se recubrieron con una capa de oro de alrededor de 10 nm utilizando un juego de reactivos Desk Sputter Coater DSR1. Las mediciones de las estructuras de las garrapatas se compararon utilizando una prueba t de Student realizada en Prism (versión 6.0 para Windows; software GraphPad).
Análisis molecular
Se procedió a la extracción del ADN genómico individual de 5 adultos no alimentados de cada población estudiada mediante el juego de reactivos DNeasy Blood & Tissue (Qiagen, EE. UU.) siguiendo las instrucciones del fabricante. A partir de los ADN purificados de especímenes del género Amblyomma se amplificaron por PCR fragmentos de los genes mitocondriales codificantes de 16S rRNA y COXI y secuencias nucleares de ITS2. Para los especímenes de las colonias de R. microplus se amplificaron fragmentos de los genes mitocondriales codificantes de 12S rRNA, 16S rRNA y COXI y secuencias nucleares de ITS2. En todos los casos se utilizó un termociclador (Minicycler ™, MJ Research, Inc., EE. UU.) y el reactivo GoTaq® Green Master Mix (Promega, EE. UU.) y oligonucleótidos específicos. 11,13,17-20 Los productos de PCR se purificaron utilizando el juego de reactivos para extracción de ADN del gel (QIAquick, Qiagen, Alemania) y se secuenciaron utilizando los servicios de la compañía coreana Macrogen (Corea del Sur).
Análisis filogenéticos
Los alineamientos de secuencia y las inferencias filogenéticas se realizaron utilizando Clustalw 21 y MEGA 7.0, 22 respectivamente. Los árboles filogenéticos se construyeron utilizando el método de máxima verosimilitud (ML), con 1000 simulaciones y basado en el modelo de sustitución de nucleótidos de 3 parámetros de Tamura 23 para todas las secuencias y el modelo Tamura-Nei 24 para las secuencias COXI del género Amblyomma. Las secuencias incluidas en los análisis se seleccionaron solo si estaban avaladas por validaciones morfológicas de las especies de acuerdo con las reevaluaciones más recientes de cada complejo. 9,11-13 Secuencias de las especies A. mixtum y R. sanguineus se usaron como grupos externos para el análisis de los complejos R. microplus y A. cajennense, respectivamente.
RESULTADOS Y DISCUSIÓN
Los especímenes de los 4 aislamientos de garrapatas del género Amblyomma presentaron similares características morfológicas, por lo tanto, se ha mostrado solo una fotografía representativa para cada estructura analizada (figura 2). En todos los ejemplares se observó el cuerpo con un contorno redondo y las escápulas redondeadas. A continuación, se describen las características morfológicas de los especímenes machos:
En los machos se observó un escudo ornamentado, liso, de apariencia brillante con manchas marrón delimitadas por franjas claras que ocupaban toda la superficie dorsal del idiosoma (figura 2 A).
Se observaron manchas cervicales grandes y alargadas y manchas anteroaccesorias grandes y bien diferenciadas. Las ramas de las manchas limitantes anchas y las ramas posteriores no fusionadas posteriormente. La primera, segunda y tercera manchas laterales fusionadas, pero bien diferenciadas y la última orientada horizontalmente. Se distinguieron las manchas posteroaccesorias pequeñas y la posteromedial alargada y más estrecha en la región basal que las regiones adyacentes claras, así como la franja marginal estrecha y de color marrón (figura 2 A).
Los surcos cervicales se mostraron pronunciados, cortos y en forma de coma ortográfica (figura 3 A-C). El surco marginal se mostró completo y delimitaba todos los festones hasta el nivel de las coxas IV y continuaba como una línea de puntos hasta el nivel de los ojos (figura 3 A). Ojos simples y aplanados (figura 2).
La punteaduras eran poco profundas y grandes, moderadamente distribuidas hacia el extremo posterior del escudo, más pronunciadas y numerosas hacia las franjas claras (figura 3 A).
Se observó la presencia de 11 festones más largos que anchos, con pocas y pequeñas punteaduras. El festón central de color marrón claro sin machas, la mitad interna de los festones 1, 2 y 5 de color marrón oscuro y los festones 3 y 4 con el borde interno del mismo color, pero más fino (figura 2 A y figura 3 A).
La base del capítulo subrectangular se mostró con un margen posterior ligeramente cóncavo y cornuas redondeadas (figura 3 C).
Los palpos estaban divididos en 4 segmentos con setas. En el segmento I se observó un espolón ventral pequeño y romo que se proyectaba posteriormente. En el hipostoma se observó una fórmula dental 3/3 en 6-7 filas y un ápice con finos y numerosos dentículos (figura 3 E-G). En la vista ventral, se distinguió la coxa I con espolones externos más largos que los internos, las coxas II-III con un espolón corto y redondeado que sobresalía del borde en forma de cresta y la coxa IV con un espolón interno largo y recto que no llegaba al nivel del ano. Los trocánteres se mostraron sin espolones (figura 3 E).
Las placas espiraculares en forma de coma se mostraron con un proceso caudal tan ancho como el festón adyacente y posterior al último par de coxas (figura 3 E- I). La apertura genital en forma de U al nivel de la coxa II (figura 3 K).
A continuación, se describen las características morfológicas de los especímenes hembras:
En las hembras el escudo ornamentado ocupaba alrededor de un tercio del largo total del cuerpo con manchas cervicales alargadas pero sin llegar a fusionarse con las manchas limitantes, las que se fusionaban a su vez con las manchas oculares y estas últimas con las accesorias.
El área posteromedial del escudo presentaba un gran parche posterior claro con manchas color marrón pequeñas hacia la parte posterior del escudo y más grandes hacia la región central. Se mostraron punteaduras distribuidas uniformemente y más pronunciadas hacia los extremos laterales incluyendo las escápulas (figura 2 B).
Se distinguieron surcos cervicales lineales y pronunciados dispuestos de forma oblicua, orientados desde el exterior hacia el interior (figura 3 B-D), el surco marginal completo, que delimitaba todos los festones (figura 3 B). Los ojos simples y aplanados (figura 2 B). Notum piloso con setas gruesas, largas y abundantes distribuidas de forma dispersa y con 3 surcos estrechos, poco profundos y lisos. El surco medial alcanzaba el festón central y los laterales terminaban entre los festones 2 y 3 (figura 2 B).
Se observó la presencia de 11 festones más largos que anchos, cada uno con 2 hileras de setas (figura 3 B). La base del capítulo subrectangular en su vista dorsal se observó con un margen posterior ligeramente cóncavo y cornuas redondeadas como en los machos.
Las placas porosas ovaladas se mostraron con el borde anterior poco definido y poco delimitado (figura 3 D).
Los palpos se distinguieron con 4 segmentos y setas. En el segmento I, una pequeña espuela ventral roma proyectada posteriormente. Se mostró un hipostoma con una fórmula dental 3/3 dispuestos en 7-8 filas y un ápice con finos y numerosos dentículos (figura 3 H).
La coxa I mostró un espolón externo aproximadamente 2 veces más largo que el interno y las coxas II-III con bordes en forma de cresta, la coxa IV con un pequeño espolón interno redondeado y un trocánter sin espinas (figura 3 F).
Las placas espiraculares en forma de coma, posteriores al último par de coxas y con un pequeño proceso caudal tan ancho como el festón adyacente (figura 3 F-J). La abertura genital localizada entre la coxa II y la III en forma de U con 2 solapas laterales estrechas (figura 3 F-L).

Fig. 2 Características morfológicas de los especímenes de garrapatas cubanas del complejo Amblyomma cajennense. Vista dorsal A) de un macho y B) una hembra al esteroscopio.
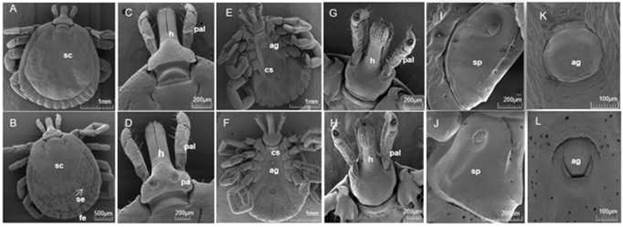
Fig. 3 Imágenes de SEM de machos y hembras: A) vista dorsal de un macho, B) vista dorsal de una hembra, C) capítulo dorsal de un macho, D) capítulo dorsal de una hembra, E) vista ventral de un macho, F) vista ventral de una hembra, G) vista ventral del capítulo de un macho, H) vista ventral del capítulo de una hembra,I) placa espiracular de un macho, J) placa espiracular de una hembra, K) apertura genital de unmacho, L) apertura genital de una hembra. sc) scutum, se) setas, fe) festones, h) hipostoma, pal) palpo, pa) área porosa, ag) apertura genital, cs) espolón coxal, sp) placa espiracular.
A pesar de las similitudes morfológicas entre las especies del complejo A. cajennense, hay caracteres o combinaciones de ellos que han permitido diferenciar una especie de otra. 25 La apertura genital en forma de U de las hembras de estas poblaciones permitió diferenciarlas de A. cajennense s. s. A. tonelliae y A. interandinum que tienen una abertura genital en forma de V 9 (figura 3 F-L). La especie A. patinoi también podría descartarse porque incluso si tiene abertura genital en forma de U, las solapas laterales son cortas y abultadas y el cuerpo es de forma ovalada en lugar de solapas laterales estrechas y el cuerpo redondeado como en las hembras de los aislados cubanos. Además, la combinación de estas características en la apertura genital con setas largas y gruesas densamente distribuidas en el notum posterior es típicamente atribuido a la especie A. mixtum.9,25,26
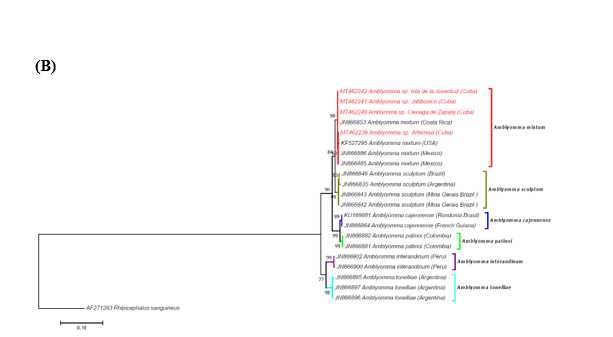
Según la estructura de las filogenias obtenidas, las 4 poblaciones cubanas se agruparon en el clado de A. mixtum junto con las poblaciones de garrapatas de Colombia, México, Estados Unidos, Ecuador y Costa Rica con una confiabilidad del análisis de las secuencias 16S RNAr, ITS2 y COXI del 98 %, 84 % y 99 %, respectivamente (figura 4).
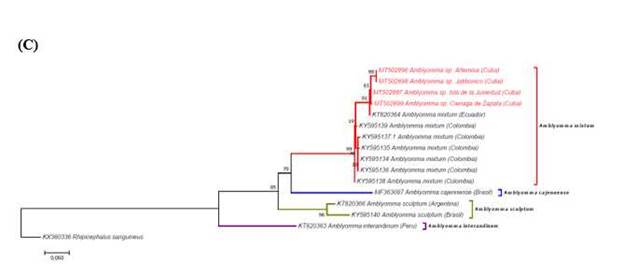
Fig. 4 Análisis filogenéticos inferidos a partir de las secuencias de ARNr 16S (A), ITS2 (B) y COX I (C) mediante el método de máxima verosimilitud basado en el modelo del parámetro 3 de Tamura 23 para A) y B) y de Tamura-Nei 24 para C) usando el software Mega 7. 22 El porcentaje de árboles en los que los taxones que aparecen agrupados fueron asociados se muestran junto a las ramas. Los árboles están dibujados a escala, con las longitudes de las ramas medidas en el número de sustituciones por sitio. La barra representa 0,05 sustituciones por sitio para A) y C) y 0,1 para B). Las secuencias generadas en el presente estudio aparecen resaltadas en rojo. Los nombres de las especies están precedidos por los números de acceso al GenBank y seguidos por la región de colecta. Cada especie del complejo A. cajennense9 aparece con un color diferente. Rhipicephalus sanguineus s.l. se utilizó como grupo externo en todos los casos.
Los especímenes de las colonias CC y ML mostraron características morfológicas similares que coincidían con las características distintivas de la especie R. microplus.27 Por tanto, cada carácter analizado se mostró sólo con una fotografía representativa si era coincidente para ambas colonias (figura 5). Todos los especímenes presentaron un contorno corporal ovalado sin festones con un escudo no ornamentado para ambos sexos y con los ojos presentes a ambos lados del escudo al nivel de las coxas II (figura 5 A y F). Aparato bucal corto y anterior, con el hipostoma más largo que los palpos para ambos sexos (figura 5 B y G).
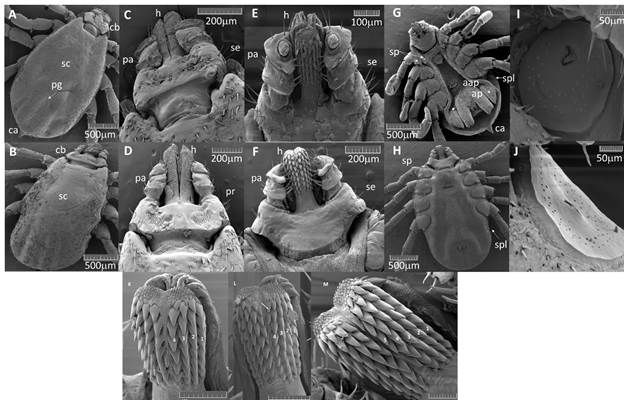
Fig. 5 Microscopía electrónica de barrido (SEM) de especímenes de garrapatas R. microplus cubanas. Rasgos distintivos de los machos: A) vista dorsal del escudo (sc), la flecha señala el surco posteromedial (pg), se indican además la base del capítulo (cb) y el apéndice caudal (ca). B) vista dorsal del capítulo. C) vista ventral del capítulo; el hipostoma (h), los palpos (pa) y las setas (se) se indican en las proyecciones del capítulo. D) vista ventral; las flechas indican las espuelas (sp), las placas adanales accesorias (aap), las placas adanales (ap) y las placas espiraculares (spl). E) ampliación de una placa espiracular. Rasgos distintivos de las hembras. F) vista dorsal, se indican el escudo (sc) y la base del capítulo (cb). G) vista dorsal del capítulo. Las flechas señalan las áreas porosas (pr). Se indican el hipostoma (h) y los palpos (pa). H) vista ventral del capítulo. Se indican el hipostoma (h), los palpos (pa) y las setas (se). I) vista ventral. Las flechas señalan las espuelas (sp) y las placas espiraculares (spl). J) ampliación de una placa espiracular. K) hipostoma con dentición 4/4 presente en la mayoría de las garrapatas hembras de la colonia ML. L) hipostoma con dentición 4,5 / 4,5 encontrada en 2 garrapatas hembras de la colonia ML, la flecha indica la dentición 0,5. M) Hipostoma con dentición 5/5 observada en una hembra de la colonia ML.
Machos
Gnatosoma
En la vista dorsal se observa la base del capítulo hexagonal con un borde posterior recto, cornua corta triangular y pocas setas en sus márgenes laterales y transversalmente a lo largo de la superficie dorsal (figura 5 A y B). En la vista ventral se observan los márgenes internos de los artículos palpales cortos y esencialmente derechos. Artículos palpales I, II y III con protuberancias ventrales y setas (figura 5 C). Hipostoma con dentición 4/4 y de 6 a 8 dentículos por fila. Corona bien definida con dentículos diminutos (figura 5 C).
Idiosoma
En la vista dorsal se observa un escudo con escápulas subtriangulares y fuertes. Surcos cervicales anchos y poco profundos. Surco posteromedial profundo con un par de surcos paramediales más anchos, pero más cortos. Apéndice caudal estrecho (figura 5 A y D). Abundantes y largas setas en el escudo ausentes en los surcos y depresiones (figura 5 A). En la vista ventral se observa la coxa I triangular con 2 espolones posteriores: el espolón interior romo y delgado y el externo más puntiagudo con un proceso anterior alargado, curvado dorsalmente y extendiéndose mucho más allá de la escápula visible dorsalmente (figura 5 D). Coxas II y III con espuelas internas y externas ampliamente redondeadas. Coxa 4 con un pequeño espolón (figura 5 D). Apertura genital al nivel de las coxas II y apertura anal posterior a las coxas IV a una distancia alrededor de dos tercios del espacio total entre el último par de coxas y el margen posterior del cuerpo. Surco anal ausente en todas las muestras (figura 5 D). Placas adanales largas a ambos lados del ano con espuelas afiladas hacia el final y un segundo espolón externo y posterior. Placas adanales accesorias con un solo espolón interno (figura 5 D). Placas espiraculares subcirculares y ubicadas detrás del último par de coxas (figura 5 D y E).
Hembras
Gnatosoma
En la vista dorsal se observan los capítulos de base hexagonal con un borde posterior recto y cornua indistinta. Pocas setas cortas solo en los márgenes laterales. Los ángulos laterales de la base del capítulo ligeramente puntiagudos. Áreas porosas en forma de riñón separadas entre sí por una distancia aproximadamente de 1 a 1,5 veces la distancia del eje mayor de un área porosa (figura 5 F y G). Margen interno dorsal del artículo II del palpo con una hendidura mediana que se continúa transversalmente como un suave surco.
En la vista ventral se observan los márgenes internos del artículo palpal I ligeramente cóncavos y cortos sin protuberancias. Márgenes internos de los artículos palpares II y III con protuberancias claras (figura 5 H). Hipostoma con dentición 4/4 para las hembras de la colonia CC y para la mayoría de las de la colonia ML. Sin embargo, se encontraron hembras de ML con dentición 4.5 / 4.5 o 5/5 (figura 5 K, L, M). Corona bien definida con dentículos diminutos.
Idiosoma
En la vista dorsal se observa un escudo con contornos suaves ocupando solo 1/3 del cuerpo con márgenes anterolaterales rectos y posterolaterales sinuosos. Ángulo posterior redondeado y relativamente ancho. Escápulas subtriangulares (figura 5 F y G). Setas largas y escasas, generalmente a lo largo de los márgenes anterolaterales hasta el nivel de los ojos, pero ausentes en los surcos cervicales del escudo medio (figura 5 F y G). Setas abundantes de medianas a largas en el aloescudo. Surcos medianos y posterolaterales bien definidos y alargados. Los últimos, confluentes con depresiones poco profundas en cada lado que se extienden a los surcos cervicales (figura 5 F). La vista ventral muestra la coxa I triangular con 2 espolones redondeados más pequeños que los de los machos. En las coxas II, III y IV solo espuelas externas (figura 5 I). La apertura genital al nivel de las coxas II con largas setas en la superficie anterior (figura 5 I). Apertura anal posterior a las coxas IV. Placas espiraculares subcirculares detrás del último par de coxas (figura 5 I y J).
Todas estas características morfológicas encontradas en los especímenes de las colonias CC y ML fueron útiles para clasificarlas como pertenecientes al complejo R. microplus ya que son distintivas de las especies miembros de este complejo. 13,27-29 Sin embargo, la gran variabilidad en los caracteres morfológicos que existe entre individuos dentro de la misma especie en este complejo dificulta la clasificación taxonómica precisa de estos especímenes. 16,27,30-32
Las historias evolutivas inferidas de los análisis de las secuencias de ARNr 12S, ARNr 16S y COXI, permitieron clasificar a los especímenes de las colonias CC y ML como pertenecientes al clado A o s. s. del complejo R. microplus junto a la cepa mexicana de referencia MJ y a aislamientos de Argentina, Bolivia, Brasil, Mozambique, Costa Rica, Panamá, Paraguay, Perú, Tanzania, Estados Unidos, Uruguay y Sudáfrica con una confiabilidad del 69 %, 93 % y 98 %, respectivamente (figura 6). Estas filogenias basadas en secuencias de genes mitocondriales identificaron congruentemente los 5 clados previamente incluidos en el complejo R. microplus como filogenéticamente bien delimitados y apoyaron moderadamente el clado A como hermano del clado R. australis. Por su parte, el análisis basado en las secuencias nucleares de ITS2 no pudo sustentar la división de la especie R. microplus en los clados A, B y C aunque se ha planteado su utilidad para apoyar la monofilia del subgénero Boophilus y las relaciones entre especies del género Rhipicephalus (figura 6). 11 Estos resultados han concordado con informes anteriores que apuntaban a que los genes mitocondriales 16S y COXI eran los mejores marcadores para resolver las relaciones de filogenia entre los 5 clados descritos dentro del complejo R. microplus.11-13
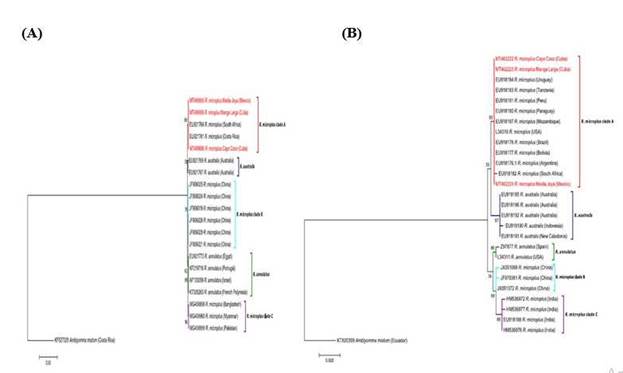

Fig. 6 Análisis filogenéticos basados en las secuencias de 12S ARNr (A), 16S ARNr (B), COX I (C) e ITS2 (D) mediante el método de máxima verosimilitud y el modelo de 3 parámetros de Tamura. 23 El porcentaje de árboles en los que los taxones que aparecen asociados fueron agrupados se muestra junto a las ramas. Los árboles están dibujados a escala, con las longitudes de las ramas medidas en el número de sustituciones por sitio. La barra representa 0,5 sustituciones por sitio para A y C, 0,02 para B y 0,1 para D. Los datos de secuencia generados en el presente estudio aparecen resaltados en rojo. Los nombres de las especies están precedidos por los números de acceso al GenBank y seguidos por el lugar de colecta. Cada clado aparece con un color diferente. Secuencias de la especie Amblyomma mixtum se usaron como grupo externo en todos los análisis.
Conclusiones
Estos resultados permitieron una identificación inequívoca de todos los especímenes cubanos pertenecientes a los complejos A. cajennense y R. microplus. Las 4 poblaciones del complejo A. cajennense pertenecen a la especie A. mixtum y los especímenes de las colonias del LNP fueron clasificados dentro del clado A o s. s. del complejo R. microplus. Este trabajo ha constituido la primera caracterización molecular de garrapatas de estas especies en Cuba y ha confirmado la presencia de A. mixtum en el país.