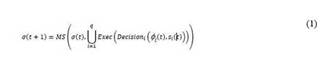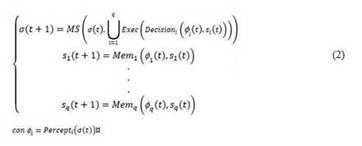INTRODUCCIÓN
Cada vez aparecen más soluciones para problemas de salud basados en la sinergia entre medicina y tecnología. Hay numerosas investigaciones que se han apoyado en la utilización de dispositivos hardware que puedan ser embebidos en el cuerpo humano para lograr esta sinergia. 1 El sistema neurorregulador humano ha constituido uno de los elementos más sensibles e importantes para el correcto funcionamiento del cuerpo humano. 2 En este sentido, se ha desarrollado suficiente información que ha permitido abordarlo para resolver las dificultades o problemas que pudiera presentar 3 y así proponer mejoras en su funcionamiento. 4
El grupo de investigación ha llevado más de 20 años trabajando en un modelo del sistema neurorregulador humano. 5 Una de las posibilidades que ha brindado este modelo ha sido la construcción de sistemas artificiales capaces de comportarse como este sistema neurorregulador. Tanto así que ya en la actualidad se tiene un modelo de sistema neurorregulador que ha sido ampliamente validado y respaldado por artículos en revistas científicas de alto impacto y tesis doctorales 5-10 y que ha permitido crear simuladores útiles en terapias de rehabilitación. 11
Este modelo ha sido expresado utilizando la teoría de sistemas multiagente (MAS), donde cada agente representa un componente autónomo con capacidad de entenderse y colaborar con otros agentes para resolver un problema común. 8 Como forma de validación del modelo propuesto, nuestro grupo de investigación se ha centrado en el sistema neurorregulador del tracto urinario inferior (LUT). El LUT es un subsistema lo suficientemente complejo como para representar toda la naturaleza de este sistema neurorregulador humano, al tiempo que es lo suficientemente accesible como para poder estudiar y comprender de manera efectiva cada uno de los centros que lo componen. 12
El objetivo a largo plazo de esta línea de investigación ha sido crear un procesador hardware (SoC) capaz de emular el comportamiento de este sistema neurorregulador humano a nivel de centro nervioso. Este procesador constituirá el germen para desarrollar reguladores hardware que puedan ser implantados en el cuerpo humano con capacidad para actuar a nivel de centro nervioso.
La presente investigación se propuso como objetivo el estudio y diseño hardware de un procesador con una estructura genérica de centro nervioso, aunque para su validación se haya emulado el comportamiento de uno de los centros del sistema neurorregulador del LUT: el centro nervioso córtico-diencefálico. Esta concreción ha ayudado a entender el diseño y, sobre todo, a proponer experimentos que lo validen. A pesar de ello, con el diseño que se propuso, se ha intentado ser lo más general posible, de forma que el mismo procesador pueda ser configurado y programado para comportarse como cualquiera de los 9 centros que intervienen en la regulación del LUT. 13
El primer problema al que se enfrentó el equipo fue que, a pesar de que ya existía un modelo de caja blanca del LUT y de que se pudieran encontrar trabajos sobre sistemas artificiales basados en el modelo que fueran capaces de operar juntamente con el sistema biológico para asistirlo, corregir disfunciones, ayudarlo en su funcionamiento e incluso para suplantar algunas de sus funciones, 14 lo cierto fue que estos trabajos no fueron concebidos para hacerlo de forma embebida en el cuerpo humano. El análisis de los requerimientos de la presente propuesta y su comparación con el modelo teórico existente llevaron a la conclusión de que era necesario incorporar a este modelo una serie de requisitos adicionales, fundamentalmente operativos, que asegurasen su viabilidad. Estos requisitos incluyeron aspectos como la miniaturización, la velocidad de operación, la robustez, el tiempo de reacción, la seguridad, el consumo o la temperatura de trabajo. Por esta razón, el objetivo general de este trabajo ha sido la creación de un nuevo modelo del sistema neurorregulador que incluyera el modelo teórico existente, pero enriquecido con un nuevo modelo arquitectural que contemplara los requerimientos operativos identificados.
MÉTODOS
Sistemas biológicos y modelos bioinspirados
Son muchos los trabajos que han destacado la necesidad de un profundo entendimiento acerca de los sistemas biológicos y de cómo las señales neuronales son procesadas. 15,16 Estos trabajos han estado motivados por el deseo de aplicar este conocimiento en mejorar las técnicas de procesamiento de información para crear sistemas bioinspirados 17 que expongan un funcionamiento similar y compatible con los sistemas neurorreguladores. Por el momento no ha sido posible simular el sistema neurológico completo y su actividad prolongada en el tiempo debido a los requerimientos computacionales y de memoria 18 y al extraordinario paralelismo del sistema biológico. 19
De ahí que sean utilizados modelos para simplificar la complejidad de las conexiones y requerimientos computacionales, pero sin dejar de representar toda la complejidad del comportamiento biológico. 20 La utilización de modelos ha permitido manipular las diferentes dimensiones en las que se expresa un sistema altamente complejo, como la escala temporal o frecuencia de las señales, lo cual ha permitido superar las barreras y restricciones físicas 21 y así comprobar que los modelos se corresponden con los sistemas observados. Una vez se han analizado y comprendido los sistemas y estos se encuentran expresados en modelos fiables y comprobados, se puede comenzar a construir soluciones hardware para su implementación. 22
Para la caracterización de sistemas complejos, paralelos, asíncronos y que muestren comportamientos inteligentes ha sido necesario utilizar herramientas con una capacidad expresiva suficiente como son los sistemas multiagente (MAS). 23 El control cooperativo que realizan los MAS ha recibido gran atención desde diferentes campos como la mecánica, la biología y la ingeniería. 24 El uso de agentes en el modelado de sistemas biológicos ha permitido diseñar con bastante exactitud complejos aspectos de la información, tales como contenido, procedencia, destino, condiciones del intercambio y acciones que cada entidad realiza sobre ella. 25 Es por ello que los MAS han sido una herramienta idónea para el modelado de sistemas biológicos.
Ahora bien, la conversión de esos modelos en hardware que pudiera utilizarse en el cuerpo humano no ha sido una cuestión trivial. Además de ser capaz de ofrecer una funcionalidad concreta, ha sido necesario que posea una serie de características relacionadas con la parte física como son la velocidad de computación, el consumo energético, el coste del propio hardware y por supuesto la validez a nivel biológico por ejemplo con el control de temperatura máximo que puede generar el dispositivo. 26 Esta adecuada caracterización ha sido esencial para permitir que un dispositivo pueda interferir en la actividad biológica de forma eficiente y segura 27 contribuyendo a la corrección de disfunciones a nivel hormonal, 28 a nivel de señales transmisoras neuronales 29 o incluso en nivel de subsistemas neurorreguladores completes. 30
Los modelos de los sistemas neuronales planteados suelen ser altamente complejos y por ello los dispositivos FPGA son idóneos para su implementación, prueba y validación, 31 ya que además de implementar los modelos, pueden parametrizar las características del hardware producido para ajustar su funcionamiento al del sistema biológico. Sin embargo, esto ha ofrecido importantes retos, dado que el diseño debe realizarse bajo fuertes restricciones, entre ellas, el número limitado de operaciones y componentes, 32) así como la disponibilidad de memoria que ha de ser optimizada, 33 siendo necesario no solo tener bien modelado y caracterizado el sistema regulador a implementar sino también hacer un correcto diseño hardware para que no se vea comprometido el modelo. 34
Modelo teórico del tracto urinario inferior
En Pérez FM, et al.6 y Chamizo JMG, et al. (35 se puede encontrar una extensa y detallada descripción del modelo del tracto urinario inferior (LUT) en el que se basa este trabajo. En este caso se abordaron aspectos más estructurales del modelo debido a que son los que más han tenido influencia en el diseño arquitectural de la propuesta.
El modelo teórico divide el LUT en un sistema mecánico (MS), que incluye los distintos órganos y sistemas físicos que serán regulados (vejiga, esfínteres, etc.) y en un sistema neurorregulador, que regula el comportamiento de dichos órganos. El sistema neurorregulador está compuesto fundamentalmente por 9 centros nerviosos autónomos que colaboran para desempeñar su función. Estos centros se comunican entre sí y con el sistema nervioso central mediante señales nerviosas aferentes, eferentes e internas que forman parte del dominio del sistema (figura 1).
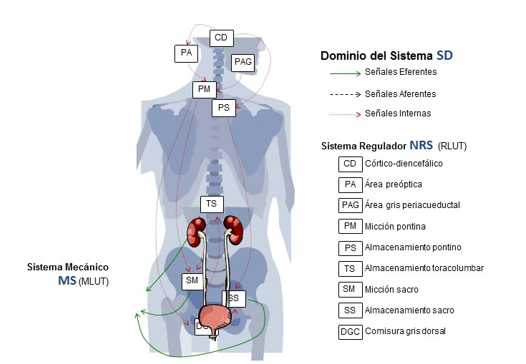
Fig. 1. Modelo del tracto urinario inferior (LUT) en los humanos. Sistema_biológico = < MS, NRS, SD >.
El dominio del sistema; además de por las señales nerviosas, está compuesto por los estados en los que se puede encontrar el sistema, las posibles acciones que puede tomar cada centro para actuar sobre el sistema y por el conjunto de posibles resultados de dicha actuación, expresado mediante un conjunto de intenciones de actuación sobre el sistema mecánico.
El sistema neurorregulador, a partir del estado actual del sistema, decide realizar un conjunto de acciones sobre el sistema mecánico con la intención de mantenerlo regulado. Por otra parte, el sistema mecánico, a partir del estado actual en el que se encuentre y del conjunto de intenciones de actuación del sistema neurorregulador, evolucionará a un nuevo estado. Este proceso se repite constantemente.
Este sencillo funcionamiento se complica un poco debido a que el sistema neurorregulador del LUT está compuesto en realidad por centros nerviosos que actúan de forma independiente, coordinándose entre sí o con el sistema nervioso central, para lograr la regulación del LUT.
Cada uno de estos centros nerviosos ha sido modelado como un agente inteligente PDE (percepción, deliberación, ejecución). 10,36
Este modelo confiere a cada centro nervioso (i.e., a cada agente) la capacidad para percibir (Perceptnc) y tener una visión particular (φnc) del estado en el que se encuentra el sistema mecánico (σt). Aunque el sistema biológico no cuenta con esta capacidad, el modelo del sistema neurorregulador se enriqueció capacitando a cada centro para que pudiera aprender de su experiencia pasada (Memnc) gracias a un estado interno (Snc) que es fruto de las decisiones tomadas en actuaciones previas y de la percepción actual del estado del sistema mecánico. A partir de la percepción del sistema y de su estado interno, cada centro puede tomar una decisión (Decisionnc) acerca de qué tarea debe realizar (p) para contribuir a mantener regulado el sistema mecánico. Sin embargo, puesto que este centro nervioso no actúa de forma aislada, sino que lo hace juntamente con otros 8 centros nerviosos (en el caso del LUT), no se puede asegurar que su actuación provoque el cambio esperado en el sistema mecánico. Es por esto por lo que se incorporó una función de ejecución (Execnc) que expresó la intención (γnc) del cambio, en lugar del cambio mismo (σt+1).
Puesto que el sistema neurorregulador está compuesto por n centros nerviosos (figura 1), todos ellos actuando al mismo tiempo sobre el sistema mecánico con la intención de llevarlo a un determinado nuevo estado (σt+ 1), será el propio sistema mecánico el que finalmente reaccione frente a todas las posibles intenciones de actuación (Γ) que provienen de todos los centros nerviosos implicados, evolucionando a un nuevo estado (σt+ 1) que no tiene por qué coincidir con las intenciones particulares de los centros nerviosos. En la ecuación 1 se muestra la dinámica de funcionamiento.
Puesto que el modelo biológico del LUT ha sido enriquecido incorporando memoria y capacidad de decisión a los centros nerviosos, ha sido posible desarrollar dispositivos que, además de emular el comportamiento habitual del regulador, también sean capaces de detectar e incluso corregir posibles disfunciones. 11,37-40 Es por esta razón que el estado global del sistema (σ) trasciende el actual estado del sistema mecánico (ecuación 1), incorporando en el sistema de ecuaciones el estado interno de todos los centros nerviosos que intervienen en el proceso (ecuación 2). Desde un punto de vista más abstracto, el estado del sistema estará compuesto por el estado del sistema mecánico junto con la experiencia adquirida por el sistema neurorregulador a lo largo de su funcionamiento.
Este modelo de caja blanca del LUT ha permitido entenderlo mejor y ha sido el marco teórico para la construcción de simuladores que han podido ser empleados en terapias de rehabilitación frente a disfunciones neuronales. Sin embargo, a pesar de que su comportamiento ha sido satisfactorio y ha cumplido con las expectativas de funcionamiento esperadas, no ha contemplado los requerimientos operativos necesarios para desarrollar, a partir de él, dispositivos hardware que pudieran implantarse en el cuerpo e interactuar a nivel de centro nervioso con el sistema neurorregulador biológico.
Modelo arquitectural del sistema neurorregulador
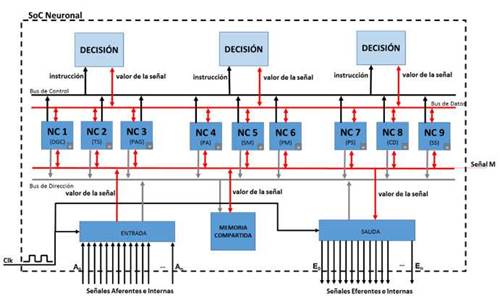
La estructura general del modelo arquitectural que se propuso se basó en un sistema multiprocesador en el que cada procesador es elemental y representa el funcionamiento de un centro nervioso. De esta forma, cada procesador puede actuar de forma independiente (figura 2).
A pesar de que cada procesador actúa de forma autónoma, lo hace siempre coordinándose con el resto de los centros. Para ello, se ha diseñado un bus de datos que ha implementado las conexiones neuronales aferentes, eferentes e internas, que a su vez han facilitado la transmisión de información entre cada uno de los procesadores.
Se propuso un módulo de entrada responsable de capturar todas las señales aferentes que provengan de algún órgano o elemento del sistema mecánico que se desea regular. Igualmente, con las posibles señales internas provenientes de otros centros nerviosos, generalmente ubicados en niveles superiores del sistema neurorregulador humano y que pudieran intervenir en el comportamiento del regulador. Así mismo, se propuso un módulo de salida que recogía las intenciones (Γ) de los procesadores para regular al sistema mecánico y las convertía en señales eferentes. Puesto que el subsistema regulador, en este caso del LUT, pudiera actuar con otros subsistemas de regulación, también se tuvo en cuenta la posibilidad de transmitir señales internas para interconectar los procesadores con centros nerviosos del sistema biológico o con otros procesadores ubicados en otros subsistemas artificiales de regulación.
Puesto que cada centro nervioso se modeló como un agente inteligente PDE dentro de un sistema multiagente, se extrajeron de dicho modelo los elementos estructurales de su composición para abordar el diseño arquitectural de los procesadores. Según esta visión, se propuso para cada procesador un módulo de percepción, un módulo de ejecución, un módulo de memoria del estado interno y un módulo de memoria adicional para albergar la lógica de funcionamiento del procesador.
El componente de percepción consta de un multiplexor que, a partir del estado en el que se encuentra el procesador (Si), almacenado en el componente de memoria interna, este debe recuperar la información que precise (percepción φi), a partir del bus de entrada (señales aferentes e internas) para desempeñar su función (definida en la memoria de programa).
El componente de ejecución consta fundamentalmente de un demultiplexor controlado por las posibles acciones (P) que selecciona las posibles influencias (Γ) sobre el sistema mecánico. Debe recordarse que será el propio sistema mecánico el que actúe frente a todos los intentos de actuación por parte de los centros nerviosos que intervienen en su regulación.
La memoria de estado se corresponde con la función de memorización (Memnc ()) del modelo teórico. Por lo tanto, a partir del resultado del componente de percepción, junto con el estado interno actual, se debe generar y almacenar un nuevo estado interno del procesador (Si). Adicionalmente, esta memoria interna permite parametrizar cada procesador almacenando un conjunto de valores representativos de cada centro y de cada individuo como los umbrales de tolerancia al dolor, presiones, etc. Finamente, también se debe guardar en esta memoria el conjunto de las posibles reacciones del centro.
Aunque no está contemplado en el modelo teórico, el modelo arquitectural añade al procesador una memoria de programa en la que se almacena el conjunto de instrucciones que expresan el funcionamiento de un determinado centro nervioso. De esta forma, basta con modificar esta programación para modificar su comportamiento. Es importante entender que la lógica aquí recogida ha de regular el comportamiento general de un determinado centro (control voluntario, inhibidor de presión, etc.), pero que son los parámetros almacenados en la memoria de estado los que particularizan dicho comportamiento para diferentes individuos.
Por último, cada procesador constará de su propio bus de datos el cual permitía el paso entre sus componentes y un bus de control encargado de dirigir las instrucciones provenientes de la memoria de programa hacia los diferentes componentes.
Este modelo arquitectónico, junto con el modelo teórico descrito sucintamente en el apartado anterior, constituyen nuestra propuesta de solución para disponer de un modelo del sistema neurorregulador humano más general, que sea viable y que se pueda implementar en hardware. A partir del marco general que nos proporciona el nuevo modelo, hemos podido crear un prototipo del centro córticodiencefálico.
RESULTADOS Y DISCUSIÓN
La propuesta de solución consistió en incorporar al modelo teórico del sistema neurorregulador 5,39 un nuevo modelo arquitectural que tuviera en cuenta los aspectos no funcionales de este sistema. A pesar de que el modelo teórico ha sido validado ampliamente, 6 era necesario validar tanto el nuevo modelo arquitectural, como el impacto que pudiera tener este nuevo modelo sobre el modelo teórico, en particular y sobre el conjunto de la propuesta, en general. Por esta razón se diseñó una estrategia de validación que contemplara todos los elementos implicados (figura 3). A partir del nuevo modelo se propuso un conjunto de arquitecturas candidatas para realizar las pruebas. Por cada una de las arquitecturas se implementó un prototipo sobre un Field Programmable Gate Array (FPGA) especialmente diseñado para el entrenamiento de SoC que permitió realizar pruebas unitarias sobre las arquitecturas candidatas y comprobar el correcto funcionamiento de los prototipos. Finalmente, para validar el correcto comportamiento del dispositivo implantable, es decir, del neurorregulador, se verificó que era capaz de regular adecuadamente los órganos y componentes del sistema mecánico.
En la actualidad no estamos en disposición de poder realizar este tipo de prueba sobre humanos. Por esta razón, se decidió implementar un simulador del sistema biológico tanto del regulador, como del sistema mecánico a partir de los modelos teóricos validados y de la base de datos obtenida de pacientes reales con y sin disfunciones a lo largo de 20 años de investigación y colaboración con departamentos de urología y neurología de diversos hospitales universitarios. 41-43 Esta base de datos incluyó las variables urodinámicas obtenidas a partir de electromiografías, pruebas de contraste y cálculo de presiones, tanto de pacientes con disfunciones neurológicas, como de individuos sanos. 44
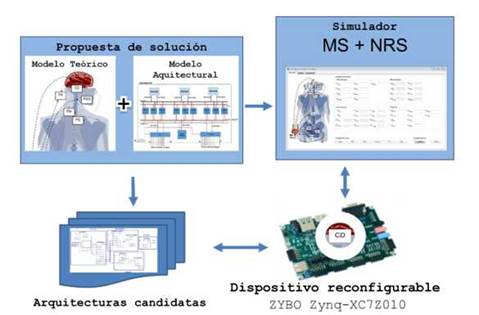
Fig. 3 Escenario construido para la validación de la propuesta: modelo general, simulador del sistema mecánico y del sistema neurorregulador, arquitecturas candidatas para el centro neuronal creado y prototipo físico del mismo implementado mediante FPGA.
La razón de querer implementar también un simulador del sistema neurorregulador se debió a que nuestro modelo arquitectural es de caja blanca. Esto ha permitido que se pudiera actuar sobre él a nivel de centro nervioso. Por lo tanto, aunque un caso particular que se debió validar fue la sustitución total del sistema neurorregulador biológico por nuestro prototipo de sistema neurorregulador, la verdadera utilidad, potencialidad y novedad de nuestra propuesta ha radicado en que, justamente se ha logrado sustituir tan solo los centros nerviosos que pudieran estar afectados y que los centros nerviosos sintéticos sustituidos fueran capaces de realizar su función interactuando entre sí, pero también interactuando con los centros nerviosos biológicos que no presentaban disfunciones.
A partir del escenario construido (nuevo modelo propuesto, simulador del sistema mecánico, simulador del sistema neurorregulador y prototipos hardware) y de la base de datos disponible de pacientes reales, 44 se diseñó un conjunto de experimentos para cubrir las premisas establecidas: se buscó validar los prototipos hardware a nivel de centro nervioso, verificando que tanto su comportamiento individual, como el comportamiento del resto de centros nerviosos biológicos y del sistema mecánico (simulado) fueran los esperados y que siguieran la misma dinámica que el sistema biológico humano, es decir, que las curvas generadas por todos los componentes fueran compatibles con las curvas obtenidas de individuos sanos y de pacientes reales con disfunciones en el sistema neurorregulador, concretamente en el tracto urinario inferior (LUT).
Concretando, los experimentos consistieron en tomar un centro nervioso del ser humano simulado por nuestra herramienta e inhabilitarlo. De esta forma se originó una disfunción en el sistema neurorregulador, con su correspondiente impacto sobre el sistema mecánico (también simulado). Para estos experimentos se seleccionó el centro córticodiencefálico. Una vez hecho esto, se conectó al simulador el prototipo FPGA que implementó en hardware la versión sintética del córticodiencefálico. Esto último equivalió a la implantación del sistema embebido en el cuerpo del individuo. Finalmente, se lanzaron un conjunto de pruebas para validar que el sistema mecánico volvía a comportarse adecuadamente, reestableciendo la dinámica habitual de sus variables urodinámicas, pero también para validar que el centro artificial implantado se ha integrado adecuadamente con el resto de los centros biológicos.
Conclusiones
En este trabajo se propuso un modelo del sistema neurorregulador humano que debía servir para crear sistemas hardware que pudieran ser embebidos en el cuerpo humano, más concretamente, el diseño system on chip de un sistema multiprocesador que emulara el comportamiento, a nivel de centro nervioso, del sistema neurorregulador. A partir del modelo propuesto, se creó un prototipo hardware que emulara el centro nervioso córticodiencefálico. Tanto el modelo del sistema neurorregulador, como el prototipo del córticodiencefálico han podido ser validados junto con el modelo teórico a través de un simulador del sistema biológico (sistema neurorregulador y sistema mecánico) también propuesto en este trabajo.
La visión de caja blanca que aportó el modelo propuesto supuso importantes mejoras con respecto a los modelos tradicionales de caja negra: permitió actuar a nivel de centro nervioso sin tener que sustituir todo el sistema regulador, permitió la interacción de los centros artificiales con el resto de los centros biológicos. Esto es especialmente importante si se tiene en cuenta que muchos centros nerviosos no actúan sobre un único órgano y que su drástica sustitución podría tener consecuencias en otros subsistemas y órganos. Igualmente permitió validar el funcionamiento parcial o total del sistema regulador de forma más precisa y confinable, permitió que el sistema siguiera comportándose coherentemente frente a situaciones inesperadas que no se hubieran tenido en cuenta durante el diseño del modelo y permitió construir sistemas expertos más precisos para ayudar a los especialistas en la toma de decisiones y simuladores que han resultado útiles en terapias de rehabilitación.