INTRODUCCIÓN
La infección por el virus SARS-CoV-2 comienza por la unión de una construcción trimérica de la proteína espiga o espícula (S, del inglés spike protein) presente en la superficie de las partículas virales a receptores de las células del hospedero. 1,2,3 En humanos, el SARS-CoV-2 utiliza el receptor celular de la enzima convertidora de angiotensina tipo 2 (ACE2, del inglés angiotensin-converting enzyme 2), que se expresa en células epiteliales respiratorias de las vías aéreas, nasales y alveolos. 2-4 La unión de la proteína S-compuesta 1273 aminoácidos y altamente glicosilada- al receptor ACE2 está mediada por un fragmento de la subunidad S1 llamado dominio de unión al receptor (RBD, del inglés Receptor Binding Domain). 2-4 El RBD tiene carácter inmuno-dominante dentro de la proteína S, y a su vez es el blanco de alrededor del 90 % de los anticuerpos neutralizantes generados en convalecientes de la COVID-19. 5 A nivel internacional, originalmente se diseñaron 2 tipos diferentes de vacunas de subunidades de proteínas, las basadas en la proteína S completa 6 y aquellas basadas únicamente en el RBD como antígeno vacunal. 7,8
Sin embargo, desde muy temprano nuestro grupo y otros, demostraron que el RBD recombinante obtenido en células de organismos superiores es relativamente poco inmunogénico, lo que se debe en parte a su bajo peso molecular (~30 kDa), a la presencia de glicanos (carbohidratos unidos a la proteína) de origen mamífero y a la baja activación de las células B debido a una presentación monovalente de este antígeno monomérico. Esto conlleva una baja producción de anticuerpos específicos para el RBD. 8 Así, la hipótesis científica de este trabajo consistió en que la conjugación química del antígeno RBD a una proteína portadora como el toxoide tetánico (TT) permitiría la obtención de un conjugado RBD-TT más inmunogénico que el RBD monomérico, y por tanto de mayor potencial como inmunógeno de una vacuna efectiva contra la COVID-19. En consecuencia, el objetivo de esta investigación consistió en desarrollar un candidato vacunal basado en un conjugado de RBD a TT con capacidad de generar una fuerte respuesta de anticuerpos neutralizantes y memoria celular en animales de laboratorio y posteriormente en humanos.
MÉTODOS
El desarrollo y la evaluación preclínica de SOBERANA02 consistió en 4 etapas fundamentales: diseño del inmunógeno enfocado en la conjugación del RBD a la proteína portadora TT; obtención del antígeno viral RBD mediante técnica recombinante; obtención y caracterización de conjugados RBDn-TT, y evaluación de la inmunogenicidad de los conjugados en animales de laboratorios.
Para la obtención del antígeno viral RBD, la expresión recombinante de la secuencia de RBD (Arg319-Phe541-(His)6) se realizó en células hospederas CHO-K1, soportado por la plataforma de producción de proteínas recombinantes del CIM: trabajo con líneas celulares derivadas de la línea celular CHO, la fermentación en modo perfusión para la obtención del caldo de cultivo enriquecido en la proteína de interés, así como la purificación y la caracterización de glicoproteínas.
La obtención de este antígeno vacunal comenzó con el clonaje en un vector lentiviral del gen que codifica para la proteína RBD del virus SARS-CoV-2 del aa 319 al 541, seguido de codones que codifican para una cola de seis histidinas. El vector lentiviral codificante de la proteína RBD 319-541 se utilizó para transducir la línea celular de ovario de hámster chino CHO-K1. Posteriormente se obtuvo, mediante procesos de adaptación a medios de cultivo químicamente definidos y ciclos de clonaje celular, una línea estable productora de la proteína RBD 319-541, tanto en forma monomérica como dimérica.
La secuencia de aminoácidos del RBD recombinante se extendió hasta el residuo 541 para incluir la Cys538, que, al no estar pareada, conllevó a que el antígeno se obtuviera como mezcla de monómero de RBD con la Cys538 cisteinilada con otra Cys proveniente del medio de cultivo, y de dímero con dos unidades de RBD enlazadas por un puente disulfuro intermolecular.
El monómero de RBD se separó del dímero mediante cromatografía de exclusión molecular para su posterior conjugación a TT, mientras que el dímero se utilizó como inmunógeno de SOBERANA01 y SOBERANA-Plus.
La producción a escala de fermentadores de 2 L dio lugar a la proteína RBD 319-541 utilizada en la obtención de conjugados para evaluación preclínica. La utilización de esta plataforma fue estratégica en el proyecto vacunas SOBERANAS, porque facilitó la transferencia exitosa del proceso desde la fase de desarrollo a escala piloto en fermentadores de 2 L hasta la escala productiva en fermentadores de 500 L y 2000 L.
Para obtener los conjugados RBDn-TT se desarrolló un procedimiento de reducción selectiva de la Cys538, insertada en la secuencia con este objetivo, para obtener un tiol libre que puede ser empleado en la conjugación a TT sin afectar los otros 4 enlaces disulfuro intramoleculares que mantienen la estructura tridimensional nativa del RBD y son clave para mantener su correcta antigenicidad (figura 1A). Se estudiaron diversos agentes reductores como el ditriotreitol (DTT) y el tris-(2-carboxietil)fosfina (TCEP), así como protocolos en los que se varió el tiempo de reacción, temperatura, concentración del RBD y estequiometría.
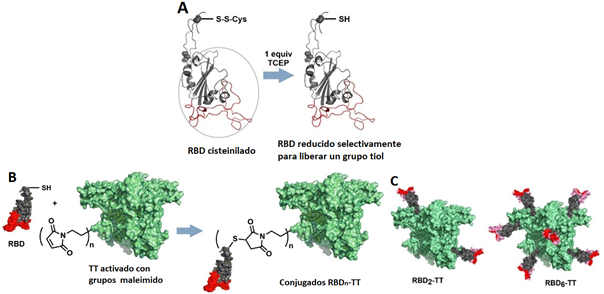
Fig. 1 A) Funcionalización sitio-selectiva del RBD por reducción de enlace S-S intermolecular en la Cys538. B) Conjugación química de RBD a TT. C) Representación estructural de los conjugados RBD2-TT y RBD6-TT.
Una vez que se logró estandarizar y escalar la reducción selectiva del RBD, se procedió a la conjugación a la proteína TT (~150 kDa) empleando la adición de tioles a grupos maleimido. 9 La figura 1Bmuestra este procedimiento, que se realizó en varios lotes modificando la estequiometría de la reacción para obtener un conjugado con 2 unidades de RBD por TT (RBD2-TT) y otro con 6 unidades de RBD por TT (RBD6-TT). La figura 1Cmuestra la representación estructural de los conjugados RBD2-TT y RBD6-TT.
Una vez establecido el procedimiento de conjugación más eficiente, se llevó a cabo el escalado de la tecnología en condiciones de Buenas Prácticas de Fabricación. En el mismo se establecieron los parámetros operacionales críticos, los atributos de calidad del producto incluida sus especificaciones de calidad, los controles de procesos y de calidad, la generación de toda la documentación necesaria, así como el proceso a una escala que actualmente produce alrededor de un millón de dosis por lote.
En la etapa de evaluación de la inmunogenicidad a los conjugados RBD2-TT y RBD6-TT, y otros (no se muestra), se les evaluó la respuesta humoral y celular en ratones para tener evidencias preclínicas de cuáles candidatos eran más adecuados para avanzar a ensayos clínicos en humanos.
Para evaluar la funcionalidad de los anticuerpos, o sea, su carácter neutralizante, se realizaron 2 ensayos con los sueros de ratones vacunados: el ensayo de neutralización molecular y el ensayo que reporta la dilución de suero.
Se estudió además, la respuesta celular generada para ambos inmunógenos adsorbidos en alum. También se evaluó la respuesta de células T específicas y se compararon los índices de avidez (AI) de los anticuerpos generados por ambos conjugados obtenidos.
RESULTADOS Y DISCUSIÓN
En cuando al diseño del inmunógeno, en julio de 2020, se publicó el primer reporte del empleo de RBD monomérico -obtenido de forma recombinante en células de insecto- como inmunógeno de un candidato vacunal chino. 7 Sin embargo, nuestra estrategia fue diferente y se enfocó en el diseño de un conjugado de RBD a una proteína portadora como el TT, buscando así que el mismo fuera más inmunogénico que el RBD por sí solo.
Los elementos para predecir la mayor inmunogenicidad del conjugado eran: a) su mayor peso molecular favorece el tránsito desde el tejido subcutáneo hasta los nodos linfáticos, donde se acumula en las células presentadoras de antígenos y favorece la respuesta de células T y de anticuerpos, b) su capacidad de activar de forma más eficiente las células B (linfocitos productores de anticuerpos) debido a la presentación multivalente del antígeno viral y c) el efecto inmunopotenciador derivado de la activación de las células T colaboradoras (linfocitos T helper) por epítopos T presentes en el toxoide tetánico.
Para esto, la conjugación química del RBD al TT se debía realizar de forma específica por un sitio de la proteína que no afectara los epítopos conformacionales del RBD responsable de la interacción con el receptor ACE2, llamado Motivo de Unión al Receptor (RBM, del inglés Receptor Binding Motif), pues estos son esenciales para generar una eficiente respuesta de anticuerpos neutralizantes. Además, se apostó por expresar el antígeno viral en células de mamíferos para garantizar que la respuesta de anticuerpos estuviera dirigida hacia el fragmento polipeptídico del RBM y no hacia cadenas oligosacarídicas (glicanos).
El empleo de un equivalente de TCEP en condiciones controladas de reacción permitió la reducción selectiva de la Cys538 sin afectar su antigenicidad.
La figura 2 muestra la caracterización de los conjugados RBDn-TT.

Fig. 2 Caracterización de conjugados RBDn-TT. A) Reconocimiento por sueros de convalecientes (antigenicidad) de RBD monomérico nativo y reducido. B) Estudio de la interacción de RBD-ACE2 con RBD monomérico (nativo y modificado) y conjugados RBD-TT.
La figura 2Amuestra que el reconocimiento por suero de convalecientes del RBD reducido con TCEP es idéntico al del RBD nativo, mientras que una reducción similar con DTT conlleva a una pérdida total de la antigenicidad, posiblemente por la ruptura de otros puentes disulfuros intramoleculares.
La figura 2Bmuestra la conservación de la antigenicidad de los conjugados, al ser estos reconocidos -incluso mejor que el RBD nativo- por el receptor ACE2 en ensayos ELISA. Un conjugado modelo de RBD6-BSA también fue bien reconocido por sueros de convalecientes.
La alta eficiencia y reproducibilidad de la reacción de conjugación, realizada con un estricto control de tiempo, concentración, equivalentes, etc. ha sido fundamental para el éxito de la vacuna, pues la misma ha sido escalada a nivel de gramos para producir hasta un millón de dosis en un lote de conjugación.
El escalado de la etapa de conjugación progresó de lotes de 150 mil dosis a lotes de 1 millón de dosis, lo cual tuvo un impacto significativo en el sistema productivo de la vacuna. Se demostró comparabilidad entre las diferentes etapas de desarrollo del escalado (laboratorio, piloto e industrial) que permitieron avanzar de manera acelerada y a su vez se demostró consistencia en el proceso productivo lo que incidió de manera decisiva en la obtención del certificado de Buenas Prácticas de Fabricación emitido por el CECMED y el otorgamiento del Autorizo de Uso de Emergencia de la vacuna.
Los estudios de caracterización realizados a las proteínas producidas en cada una de las escalas, reportó identidad correcta de secuencia primaria, secundaria y terciaria, glicosilación característica de las células CHO, pureza por encima del 90 % y reactividad sobre la molécula de ACE2, lo cual demostró la calidad de los procesos.
Conjugados con mayor carga de RBD también fueron obtenidos, pero no mostraron ventaja sobre el conjugado RBD6-TT en la evaluación preclínica.
SOBERAN02 es la única vacuna que emplea una conjugación química del RBD a TT para combinar las ventajas de una presentación multivalente y del efecto inmuno-potenciador del TT. Vale resaltar que otros inmunógenos conjugados reportados como candidatos vacunales no han sido aprobados aún como vacuna, por lo que SOBERAN02 es la primera vacuna conjugada en el mundo contra la COVID-19.
Desde el punto de vista de la evaluación de la inmunogenicidad de los conjugados en animales de laboratorio, a los conjugados RBD2-TT y RBD6-TT, y otros (no se muestra), se les evaluó la respuesta humoral y celular en ratones para tener evidencias preclínicas de cuáles candidatos eran más adecuados para avanzar a ensayos clínicos en humanos. La figura 3Amuestra el esquema de inmunización utilizado, en el que se comparó la respuesta de conjugados con diferente carga de RBD con la respuesta del RBD monomérico, todos adyuvados con alum. En la figura 3Bse observa que RBD6-TT/alum generó una respuesta temprana y alta de anticuerpos anti-RBD, lo que es muy deseable en momentos de pandemia, mientras RBD2-TT/alum y RBD/alum requirieron de la dosis de refuerzo para alcanzar altos títulos de IgG. Con RBD6-TT/alum se realizó un estudio de dosis con 0,5; 1 y 3 µg del conjugado y se encontró una respuesta de IgG dosis dependiente en el día 7, pero en el día 14 la respuesta fue muy alta incluso con la dosis más baja. También se compararon los índices de avidez (AI) de los anticuerpos generados por ambos conjugados, encontrando 81 % para los de RBD6-TT/alum y 69 % para los de RBD2-TT/alum (figura 3C). Esto es consistente con una mayor maduración de la afinidad y predice una mejor funcionalidad de los anticuerpos producidos por RBD6-TT. Además, se observó una respuesta inmune Th2 sesgada para RBD2-TT/alum (relación IgG2a/IgG1 0,54), mientras que para RBD6-TT/alum se encontró una respuesta Th1/Th2 más balanceada (relación IgG2a/IgG1 0,81) (figura 3D).
Para evaluar la funcionalidad de los anticuerpos, o sea, su carácter neutralizante, se realizaron 2 ensayos con los sueros de ratones vacunados. El primero es el ensayo de neutralización molecular, que representa la dilución de suero que da lugar a un 50 % de inhibición de la interacción RBD-ACE2 (mVNT50, figura 3E), y el segundo es el ensayo reporta la dilución de suero que da lugar a un 50 % de neutralización de la interacción del virus con células Vero E6 que expresan el receptor ACE2 (cVNT50, figura 3F). Las figuras 3E y 3F muestran un mayor nivel de neutralización a nivel molecular y celular por los sueros de ratones vacunados con RBD6-TT/alum, demostrando que la respuesta humoral generada por este inmunógeno no es solo mayor sino también de mejor calidad.

Fig. 3 A) Esquema de inmunización de ratones BALB/c. B) Anticuerpos específicos anti-RBD generados a los días 7, 14, 21, y 28. C) Índice de avidez de los anticuerpos generados al día 28. D) Relación de anticuerpos IgG2a/IgG1. E) Ensayo de inhibición de la interacción molecular RBD-ACE2. F) Ensayo de neutralización de la interacción del virus con células Vero E6 conteniendo el receptor ACE2.
Finalmente se estudió la respuesta celular generada para ambos inmunógenos adsorbidos en alum. Un experimento de transferencia de esplenocitos de ratones vacunados a inocentes (naive). También se evaluó la respuesta de células T específicas. Además, se compararon los índices de avidez (AI) de los anticuerpos generados por ambos conjugados y se observó una respuesta inmune Th2 sesgada para RBD2-TT/alum.
Conclusiones
Se demostró que la respuesta de anticuerpos neutralizantes y celular en animales de laboratorios es significativamente superior con el uso de inmunógenos conjugados RBD-TT que con RBD monomérico, comprobando así la hipótesis de trabajo. De los conjugados estudiados, RBD6-TT mostró una respuesta humoral más temprana, elevada y neutralizante que RBD2-TT, por lo que constituyó el inmunógeno de elección para avanzar a ensayos clínicos en humanos.














