Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Farmacia
versão On-line ISSN 1561-2988
Rev Cubana Farm v.32 n.3 Ciudad de la Habana set.-dez. 1998
Empresa Farmacéutica "8 de Marzo"
Procedimiento para la obtención de cimetidina polimorfo "A" a partir de cimetidina polimorfo "B" impuro
Jesús García Valdés,1 Minka Portas Ponce,2 Maytée González Gómez3 y Lázaro Pulido Fariñas4- Investigador Titular.
- Aspirante a Investigadora.
- Ingeniera Química.
- Técnico.
Resumen
Se describen procedimientos que permiten mediante cristalización en mezclas alcohol etílico-agua (solventes de producción nacional), obtener cimetidina polimorfo A que cumple los requerimientos de la Farmacopea de los EE.UU. a partir de polimorfos A y B impuros. Se estableció que si el contenido de impureza era igual o menor al doble del permitido, podía utilizarse alcohol etílico absoluto con un rendimiento en peso superior al 70 %, pero si el contenido de impurezas estaba entre 2 y 3 veces, era necesario utilizar alcohol etílico con un contenido de agua del 6 % y un rendimiento en peso del 60 al 65 %. Se presentan además los resultados obtenidos durante su comprobación a escala industrial.Descriptores DeCS: CIMETIDINA/aislamiento & purificación; TECNOLOGIA FARMACEUTICA; INDUSTRIA FARMACEUTICA; CALIDAD DE LOS MEDICAMENTOS; CONTROL DE CALIDAD.
La cimetidina1 (N-metil - N´ -{ 2 [(5 -metil imidazol - 4 -y1) - metiltio ] etil } N" cianoguanidina) constituye un potente antagonista de los receptores H2 de la histamina que inhibe la secreción del jugo gástrico estimulada por la histamina, por lo que es ampliamente usada en las úlceras pépticas.2
Es bien conocido que la cimetidina presenta polimorfismo3 y hasta la fecha han sido caracterizados 4 polimorfos de la base anhidra y 3 polimorfos del monohidrato de la base. Las formas anhidras han sido designadas polimorfos A, B, C y D, mientras que las formas hidratadas se designan como M-1, M-2 y M-3.
Por lo general el polimorfo de cimetidina preferido para uso farmacéutico es el polimorfo A (cimetidina A)3,4 y muy especialmente el producto comercializado según los requerimientos actuales de la Farmacopea de los EE.UU. (USP XXIII).
No obstante, al desarrollarse procedimientos que permiten obtener polimorfo B (cimetidina B) con elevada pureza polimórfica, han hecho de la cimetidina B un polimorfo alternativo para la formulación farmacéutica.3 Esto ha ocasionado que actualmente la Farmacopea Británica (BP-93) reconozca el polimorfismo de este compuesto y sus ensayos de identificación permiten aceptar otros polimorfos, principalmente el polimorfo B.5
Durante el proceso de síntesis de la cimetidina se forman compuestos secundarios6 que a pesar de los procesos de purificación realizados por los productores, algunos niveles de éstos acompañan al principio activo y su presencia es evaluada por diferentes Farmacopeas como "sustancias relacionadas". Para este ensayo la USP XXIII emplea técnicas de cromatografía líquida de alta resolución7 y acepta un contenido de impurezas individual hasta 0,1 y 0,5 % al evaluar todas las impurezas. Por su parte la BP 93 establece un procedimiento por cromatografía en capa delgada con evaluación visual5 y acepta hasta 0,2 % de impurezas individuales.
En Cuba se han recibido por varias vías cimetidinas de diversas procedencias, muchas de ellas declaradas como cimetidinas calidad BP, pero nuestra Industria Farmacéutica exige el cumplimiento de los requerimientos USP para confección de sus formas terminadas; por ende, en ocasiones algunos lotes son rechazados ya sea por diferencias polimórficas o por presentar niveles de "sustancias relacionadas" por encima del nivel aceptable.
Para la purificación de la cimetidina la literatura reporta diferentes métodos. El uso de isopropanol para obtener por cristalización cimetidina A purificada a partir de cimetidina B (polimorfo M-1) fue descrito por Harsányi y otros6 en 1982. Posteriormente, García y otros8 reportan el uso de alcohol etílico en la transformación del polimorfo de cimetidina B en cimetidina A.
Nuestro trabajo ha estado encaminado a desarrollar procedimientos que permitan mediante el empleo de solventes de producción nacional procesar cimetidina A ó B con alto contenido de impurezas; se ha establecido que el uso del etanol con un contenido de agua del 1 al 6 % en dependencia del contenido de impurezas permite simultáneamente obtener el polimorfo deseado (polimorfo A) y un contenido aceptable de "sustancias relacionadas", con rendimientos entre el 60 y 70 % en peso.
Métodos
En este estudio se emplearon cimetidina A y B cuya presencia de "sustancias relacionadas" sobrepasaban los límites establecidos en la USP XXIII, las cuales denominaremos "cimetidinas impuras".Como solventes se utilizaron alcohol etílico absoluto de uso técnico, alcohol etílico natural clase A (ambos de producción nacional) y mezcla etanol-agua desionizada según la necesidad.
Como inóculo de cristalización se empleó cimetidina polimorfo A preparado en nuestro laboratorio mediante recristalizaciones sucesivas de cimetidina calidad USP en alcohol etílico absoluto.
Purificación a escala de laboratorio
En la figura se representa el procedimiento empleado para el procesamiento de cimetidinas impuras. Para ello 20-50 g de cimetidina impura se disolvieron bajo agitación y reflujo, en el volumen y tipo de solvente de estudio según lo expuesto en las tablas 1 y 2. Posteriormente, la solución obtenida se mantuvo bajo estas condiciones durante 10-20 min. La disolución se enfrió hasta alcanzar 35 °C y se añadieron 15-30 mg de inóculo, continuando el enfriamiento hasta una temperatura de 10 °C. La suspensión permaneció bajo estas condiciones por no menos de 2 h y posteriormente la masa de cristales se filtró y la torta fue lavada con el solvente de estudio previamente enfriado a 10 °C. El sólido se secó en estufa a 60 °C hasta que presentó una pérdida por desecación menor de 1 %. Los líquidos madres (LM) y de lavados se conservaron para su eventual reutilización en ensayos posteriores.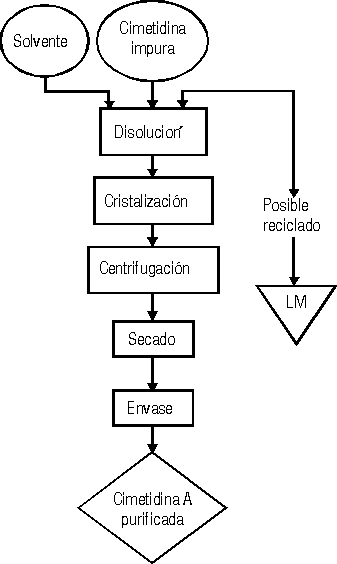
| | | Tipo | | | | |
| | | Etanol | | | | |
| | | LM 007 + etanol | | | | |
| | | LM 001 + etanol | | | | |
| | | LM 003 + etanol | | | | |
| | | Etanol | | | | |
| | | Etanol | | | | |
| | | Etanol | | | | |
| | | Etanol | | | | |
| | | LM 008 + etanol | | | | |
| | | Etanol | | | | |
| | | LM 010 + etanol | | | | |
| | | Etanol | | | | |
| | | LM 012 + etanol | | | | |
| | | Etanol | | | | |
| | | LM 014 + etanol | | | | |
| | | Etanol | | | | |
| | | LM 016 + etanol | | | | |
| | | Etanol | | | | |
| | | Etanol | | | | |
| | | LM 019 + etanol | | | | |
| | | Etanol | | | | |
| | | LM 021 + etanol | | | | |
| | | Etanol | | | | |
| | | Etanol | | | | |
| | | Etanol | | | | |
| | | Etanol | | | | |
| | | Etanol | | | | |
| | | Etanol + agua | | | | |
| | | Etanol + agua | | | | |
| | | Agua | | | | |
| | | Agua | | | | |
| | | Tipo | | | | |
| | | Etanol | | | | |
| | | Etanol | | | | |
| | | LM 033 + etanol | | | | |
| | | LM 034 + etanol | | | | |
| | | LM 035 + etanol | | | | |
| | | LM 036 + etanol | | | | |
| | | LM 037 + etanol | | | | |
| | | Etanol | | | | |
| | | Etanol | | | | |
| | | Etanol | | | | |
| | | Etanol | | | | |
| | | Etanol | | | | |
| | | Etanol | | | | |
| | | Etanol + agua | | | | |
| | | Agua | | | | |
Comprobaciones a escala industrial
En un reactor apropiado se cargan 550 L de alcohol-agua (Kf 5-7 %) y se añaden bajo agitación 100 kg de cimetidina impura. La mezcla se calentó hasta reflujo y se mantuvo en estas condiciones durante 20 min. La disolución se filtró en caliente y el líquido claro obtenido se recogió en un cristalizador donde se enfrió con agua recirculada hasta alcanzar 35-40 °C , y fueron añadidos 80-90 g del inóculo apropiado. El enfriamiento se continuó hasta 5-10 °C y se mantuvo hasta el fin de la cristalización. La suspensión fue centrifugada y los cristales se lavaron con alcohol frío. Los cristales se secaron en horno de aire recirculado a 60 °C hasta que su pérdida por desecación fue inferior a 1 %, posteriormente se envasaron en bolsas de polietileno contenida en tambores de fibra.Para establecer el nivel de impurezas presente se utilizó el procedimiento de evaluación por HPLC de "sustancias relacionadas" descrito en la USP XXIII7 y se empleó un cromatógrafo líquido de alta resolución "KNAUER".
Con fines comparativos se definió el índice de impureza II como:
AI II = ---- Apdonde:
AI: área del pico de la impureza "i"
Ap: área del pico patrón según la monografía
Este índice permitió evaluar comparativamente la efectividad del proceso de purificación estudiado ya que el producto obtenido sería aceptado si II < 1.
Se determinó el tipo de polimorfo obtenido al realizarse a cada muestra su espectro IR, en pastillas de KBr al 1 %, en el rango entre 1 125 y 1 180 cm-1 mediante un espectrómetro FT-IR "Brucker" modelo IFS 48 y el programa de computación OPUS/IR ver 1.2. La evaluación semicuantitativa del contenido del polimorfo "B" se realizó según el método desarrollado por Minka Portas y otros (Comunicación personal), al evaluar el área bajo la curva de integración del pico entre 1 187 y 1 177 cm-1 y establecer el contenido del polimorfo B mediante una curva de calibración previamente establecida.
El contenido de agua del solvente empleado en los ensayos de purificación fue establecido según el método de Karl-Fisher descrito en la USP XXIII.9
Resultados
Se comprobó que el inóculo preparado era cristalográficamente puro (más del 98 % de polimorfo A) y con un contenido de impureza muy bajo, pues presentó un II de 0,18.Los resultados obtenidos al procesar a escala de laboratorio cimetidinas impuras polimorfo B y A se presentan en las tablas 1 y 2 respectivamente. En las tablas 3 y 4 se muestran los resultados estadísticos obtenidos al emplear la t de Student para comparar los II de las cimetidinas procesadas y purificadas en función de los solventes utilizados.
| Solvente | | | | | | | | | | |
| Alcohol absoluto | | | | | | | ||||
| | | | | |||||||
| Alcohol 94 % | | | | | | | ||||
| Alcohol absoluto | | | | | | | ||||
| | | | | |||||||
| Alcohol 94 % | | | | | | |
| Solvente | | | | | | | | | |
| Alcohol | |||||||||
| absoluto | | | | | | ||||
| | | | | ||||||
| Alcohol absoluto | | | | | | ||||
| Alcohol 94 % | | | | | | ||||
| | | | | ||||||
| Alcohol 94 % | | | | | |
| No | | |||||
| Lotes | | | | | | |
| | | | | | | |
| | | | | | | |
| | | | | | | |
| | | | | | | |
Discusión
Las cimetidinas impuras con II < 2, tanto las utilizadas en los ensayos con alcohol absoluto como alcohol de 94 %, fueron similares entre sí.Las cimetidinas II > 2 difirieron significativamente de las que poseen II < 2.
Los productos obtenidos a partir de cimetidinas con II < 2 presentaron un contenido de impurezas inferior independientemente del solvente empleado.
El alcohol de 99 % brindó cimetidinas con II < 1 al procesar cimetidinas impuras con II < 2.
Se comprobó lo planteado por García y otros al obtenerse cimetidinas polimorfo A con el empleo de alcohol absoluto y alcohol de 94 % como solventes.
Lo anterior permite plantear que para procesar cimetidinas impuras A y B con II < 2 se puede utilizar tanto alcohol absoluto como el alcohol de 94 %, pero preferiblemente el alcohol absoluto, pues se logran rendimientos en peso superiores al 70 %. El reciclado de los líquidos madres no permitió obtener de forma estable productos de calidad a menos que se incrementara a 8-9 volúmenes la cantidad de solvente a utilizar. Esto se explica por la relativamente poca solubilidad de las impurezas en alcohol absoluto que sólo pueden ser removidas al incrementar en los reciclos el volumen de alcohol presente.
En cambio, cimetidinas impuras A y B con II > 2 sólo pudieron ser procesadas al emplear el alcohol de 94 % con rendimientos en peso del 60-65 % aproximadamente, ya que en este solvente la solubilidad de la impureza se ve incrementada. No obstante, no se recomienda el reciclaje de los líquidos madres pues la presencia de agua en el medio se incrementaría, lo que conllevaría a que la cimetidina obtenida no fuera cimetidina A cristalográficamente pura.
En ambos casos se obtienen cimetidinas que cumplen los requisitos de la Farmacopea de los EE.UU. USP XXIII.
Mediante este procedimiento se procesaron 5 236 kg de cimetidina no apta para la producción de medicamentos, con un rendimiento de 3 421,5 kg de cimetidina purificada cuyo valor asciende alrededor de 171 000 dólares. Todo lo anterior implica que el país no tuvo que erogar adicionalmente alrededor de 162 000 dólares por la adquisición de la cantidad recuperada de cimetidina.
El procedimiento desarrollado por su rentabilidad y la calidad del producto obtenido es apto para la purificación y transformación de polimorfo B impuro a cimetidina polimorfo A.
Agradecimientos
Queremos dejar constancia de nuestro agradecimiento a todos aquéllos que han colaborado en la realización de este trabajo, muy especialmente a los lincenciados Juan Luis Benítez Caballero, Regla de la Caridad León Pérez y al colectivo del Laboratorio Químico de la Empresa Farmacéutica "MEDSOL" por la relización de las evaluaciones por HPLC y los espectros IR; a la técnica Margot de la Rosa Ibarnca de nuestra Empresa por su apoyo en la ejecución de los controles de proceso y al colectivo de obreros y técnicos de la Empresa Laboratorio Farmacéutico "Mario Muñoz" donde se realizaron los trabajos a escala industrial.Summary
The methods allowing the crystallizations of ethyl-alcohol-water mix and the obtention of an A polymorph cimetidine from impure A and B polymorphs in compliance with the requirements set by US Pharmacopeia are described. It was established that if the impurity content was equal to or lower than twice the allowable limit, then absolute ethyl alcohol with a weigth yield over 70 % could be used; however, if the impurity content doubled or tripled the said allowable level, then it would be necessary to use ethyl alcohol with a 6 % content and a weight yield from 60 to 65 %. Also, results obtained from testing at an industrial scale presented.Subject headings: CIMETIDINE/isolation & purification; TECHNOLOGY, PHAR-MACEUTICAL; DRUG INDUSTRY; DRUG QUALITY; QUALITY CONTROL.
Referencias Bibliográficas
- The Merck Index. 10 ed. New Jersey: Merck, 1983:323.
- Shibata M, Hiromasa K, Kazuhiro M, Katsuaki M, Toshimasa I, Masatoshi I. X ray structural studies and physicochemical properties of cimetidine polymorphism. Pharm Sci 1983;72(12):1436-42.
- Graboyes H, Kirpatrick D. Un procedimiento para preparar polimorfo B de cimetidina. Patente # 2025665. España. Julio 29, 1987.
- Smith K. French laboratories: nouvelle forme polymorphique de la Cimétidine. Patente # 7727887. París. Sept. 15, 1977.
- British pharmacopeia. London: Her Majesty´s Stationery Office; 1993:158-9.
- Harsányi K, Domány G, Toldy L. Cimetidine monohydrate and processes for its preparation and use. Patente # 2101991. Gran Bretaña. Junio 24,1982.
- United States Pharmacopeial Convention. USP XXIII. United States Pharmacopeia. 23 ed. Easton: Mack Printing; 1995:373.
- García Valdés J. Solicitud Patente Cubana 83-96 del 4 de octubre de 1996.
- United States Pharmacopeial Convention. USP XXIII. United States Pharmacopeia. 23 ed. Easton: Mack Printing; 1995:apéndice 921.
Ing. Jesús García Valdés. Ave. 313 No. 16408 esquina 164 A Reparto Lutgardita, Boyeros, Ciudad de La Habana, Cuba.














