1.-INTRODUCCIÓN
Desde el surgimiento de la especie humana, el hombre ha trabajado incesantemente en adquirir los conocimientos que le permitan explicarse los fenómenos de la naturaleza, el funcionamiento de su cuerpo y la transformación de los recursos naturales para la satisfacción de sus necesidades. Actualmente, una gran parte de los esfuerzos de los científicos apuntan al desarrollo de sensores capaces de detectar señales de diferentes tipos y procesarlas de manera eficiente [1].
De manera particular se trabaja en el desarrollo de sensores electroquímicos, que son aquellos que utilizan la electroquímica como herramienta analítica. Los sensores potenciométricos detectan el cambio en el potencial de un electrodo como consecuencia de la variación en la composición iónica de la muestra, y el proceso de medición se realiza con una celda electroquímica a corriente cero. Entre las aplicaciones más relevantes de la potenciometría están la medición y el control del pH, que tiene gran importancia en áreas como la industria y el diagnóstico médico [2] [3].
El pH de una solución indica cuán básica o ácida es la misma. Cuando un electrodo sensible al ion H+ se pone en contacto con una solución acuosa de una sustancia que contenga iones H+, se desarrolla una diferencia de potencial proporcional al logaritmo de la concentración de estos iones, tal como se muestra en (1). La expresión analítica de este potencial fue obtenida por el científico Walther Nernst en 1889, y se conoce como Ley o Ecuación de Nernst [4]. La expresión muestra cómo el potencial varía en -59.2 mV por unidad de pH.
Los electrodos capaces de detectar cambios en la concentración de un ion en específico se denominan electrodos selectivos a iones (ESI) [5]. Sin embargo, existen electrodos que son capaces de detectar la concentración de varios iones sin ser selectivos a uno en específico [4]. Para permitir la difusión del ion deseado e impedir el paso de otras especies iónicas, resulta habitual revestir los electrodos con una membrana selectiva. En los últimos años se ha reportado la utilización de materiales orgánicos semiconductores o polímeros semiconductores para la construcción de membranas sensibles a diferentes iones [6]. Para permitir la difusión de los iones H+ e impedir el paso de otras especies iónicas, resulta habitual que los electrodos utilizados para la medición de pH posean una membrana selectiva al ion H+.
Los polímeros semiconductores pueden combinarse con otros materiales (incluso otros polímeros) para la fabricación de electrodos, y tienen la ventaja de poder depositarse a bajas temperaturas con métodos relativamente sencillos. Además, estos materiales pueden ser utilizados en medios acuosos y se destacan por su biocompatibilidad [7,8]. Entre los materiales más utilizados está la Polianilina (PANI), debido a su propiedad de aumentar su conductividad eléctrica luego de ser sometida a un proceso de dopaje [9].
Se conoce que estos polímeros se han depositado sobre diferentes substratos, lo cual ha permitido que formen parte de la capa activa de Transistores Orgánicos de Capa Fina (OTFT, del inglés Organic Thin-film transistor) y también en Foto Transistores Orgánicos (OPT, del inglés Organicphoto transistor). En particular, los OTFT sensibles a iones (ISOFET), se utilizan para desarrollar sensores de diferentes tipos como los de gas, vapor y fluidos [10-13].
En la actualidad existe una notable actividad en la búsqueda de nuevos materiales para la construcción de electrodos. Entre los más prometedores se halla el óxido de indio y estaño (ITO, del inglés IndiumTin Oxide), compuesto en un 90% de In2O3 y un 10% de SnO2 [14]. Debido a la transparencia y conductividad eléctrica del ITO, se ha utilizado en la fabricación de pantallas, celdas solares y biosensores.
Korostynska [15], reporta el uso del ITO y materiales poliméricos semiconductores en la fabricación de electrodos para su utilización en la medición de varias especies químicas y en particular, del pH. Otros trabajos demuestran que es posible la fabricación de electrodos para la medición de pH con substratos de vidrio y con ITO y PANI como elementos sensibles [16,17]. La posibilidad de combinar el PANI con otros polímeros como la Lignina Sulfonada (LS) ha quedado abierta para futuras investigaciones.
El éxito de las mediciones potenciométricas depende en gran medida del sistema de medición empleado. Es necesario contar con un circuito electrónico que posea una alta impedancia de entrada para garantizar que no circule corriente por los electrodos. En la actualidad, existe una marcada tendencia a utilizar técnicas de Instrumentación Virtual en el diseño de los sistemas de medición, debido a la facilidad y altas potencialidades para el acondicionamiento, adquisición, almacenamiento y procesamiento de las señales de interés [18].
En este trabajo se presentan los aspectos relevantes en el diseño, construcción y evaluación de electrodos de trabajo de vidrio/ ITO/ PANI-LS y Vidrio/ITO para la medición de pH. Se muestra el diseño del sistema de medición potenciométrico para la evaluación de los electrodos de trabajo. Los resultados permiten concluir que los electrodos de vidrio/ITO/PANI-LS y vidrio/ITO tienen respuestas potenciométricas cercanas a la nernstiana en un rango de medición de pH de 3 a 11 unidades. En ese rango de medición existe una relación lineal entre la diferencia de tensión y el pH.
2.- MATERIALES Y MÉTODOS
2.1.- MATERIALES
En el proceso de construcción se utilizaron los siguientes materiales:
20 láminas de 2.5 cm x 1.5 cm de vidrio con una capa de ITO de 0.1 mm de espesor, depositada sobre una de sus superficies (vidrio/ ITO) y 20 láminas de vidrio/ ITO de 2.5 cm x 2.5 cm (obtenidas comercialmente de la compañía Sigma-Aldrich).
5 litros de agua ultra pura (18 MΩ/cm).
20 ml de dimetil-acetamida (DMAc).
10 mg de PANI.
10 mg de LS.
1 agitador magnético con plato caliente (hot-plate).
50 ml de acetona y 50 ml de alcohol isopropílico (IPA).
Cristalería de laboratorio (beakers, probetas, matraces, u otros).
Pistola para secado con aires o gases.
Espectro fotómetro Shimadzu UV-1650PC (http://www.shimadzu.com).
Papel de filtro y cinta adhesiva.
Medidor de pH Sartorius Professional Meter PP-15 (http://www.sartorius.com).
2.2.- MÉTODOS
La construcción se dividió en dos etapas. La primera consistió en el proceso de limpieza de las láminas de vidrio/ ITO utilizadas. La segunda etapa, fue el proceso de deposición del material orgánico semiconductor sobre las láminas limpias. La limpieza y la deposición de los materiales que fueron realizados son procedimientos que han sido descritos anteriormente en otras publicaciones [19-22].
En total se obtuvieron 10 electrodos de 2.0 cm x 2.5 cm y 10 electrodos de 2.0 cm x 1.5 cm. En la figura 1 se aprecia una imagen de un electrodo de 2.0 cm x 1.5 cm al terminar las deposiciones. Las láminas restantes de vidrio/ ITO de las dos dimensiones, en las que no se depositó PANI-LS, fueron limpiadas y almacenadas para su posterior utilización como electrodos de trabajo.
3.- DISEÑO DEL SISTEMA DE MEDICIÓN POTENCIOMÉTRICO
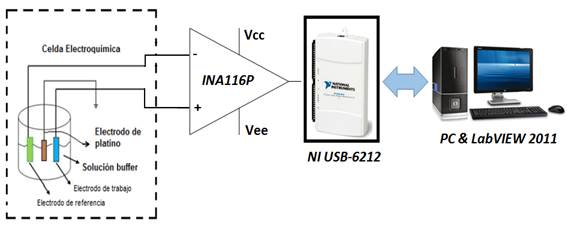
Como sistema de medición se opta por un canal analógico de adquisición de señal acoplado a una tarjeta de adquisición de datos (TAD) controlada por un Instrumento Virtual (VI) diseñado en LabVIEW 2011. En la figura 2 se muestra esquemáticamente las conexiones eléctricas del sistema de medición potenciométrico, donde se pueden identificar las siguientes partes: una celda electroquímica, un amplificador de instrumentación y una TAD NI USB-6212.
El sistema diseñado cumple con los siguientes requisitos:
Medir el potencial potenciométrico (a corriente 0) que se genera en la celda electroquímica.
Herramienta de software basada en un Instrumento Virtual para el manejo de la NI USB-6212, interfaz visual donde se muestran de forma gráfica y numérica el valor de la variable medida en tiempo real, tiempo transcurrido del experimento y el número de muestras adquiridas.
Almacenamiento de los datos adquiridos en un fichero tipo Excel, para su posterior procesamiento.
La celda electroquímica se construyó con tres electrodos sumergidos en una solución electrolítica contenida en un beaker. Se utilizaron electrodos de vidrio/ ITO/ PANI-LS y vidrio/ ITO como electrodos de trabajo; un electrodo de referencia de Ag/AgCl y un tercer electrodo de platino para conexión a tierra (GND) la solución electrolítica. El tercer electrodo constituye una mejora al sistema de medición reportado en [18]. La solución electrolítica consistió en 40 ml de una solución buffer de pH con valores de 3, 4, 7, 10 y 11 en el transcurso de los experimentos.
La celda electroquímica fue conectada a un amplificador de instrumentación INA116P el cual presenta bajas corrientes de polarización de entrada (Ibias). Así se garantiza el acondicionamiento de la señal medida, ya que la impedancia de entrada del INA116P es 1015 Ω, provocando que la circulación de corriente desde los electrodos hacia el sistema de medición sea inferior a ±3 fA. De esta manera se logra establecer cumplir el requisito de medición a potencial potenciométrico [4].
La salida del amplificador de instrumentación se conectó a la TAD NI USB-6212, realizándose la medición en el modo referido a tierra (RSE, del inglés Reference Singled Ended) a través del electrodo inerte de platino. De esta forma, se logra mantener una línea de base o tensión de directa constante.
4.- EVALUACIÓN DE LAS RESPUESTAS POTENCIOMÉTRICAS DE LOS ELECTRODOS EN LA MEDICIÓN DE PH
En la etapa experimental de este trabajo se utilizaron los siguientes materiales:
Sistema de medición potenciométrico diseñado compuesto por la celda electroquímica e instrumentación electrónica.
10 electrodos de vidrio/ ITO/ PANI-LS de 2.0 cm x 2.5 cm.
10 electrodos de vidrio/ ITO/ PANI-LS de 2.0 cm x 1.5 cm.
10 electrodos de vidrio/ ITO de 2.0 cm x 2.5 cm.
10 electrodos de vidrio/ ITO de 2.0 cm x 1.5 cm.
500 ml de soluciones buffer de pH 3, 4, 7, 10 y 11.
Medidor de pH Sartorius Professional Meter PP-15.
Un multímetro digital Agilent 34401.
Durante las mediciones, la temperatura se mantuvo en 25°C ± 2°C, al efectuarse todos los trabajos en una sala de laboratorio con temperatura controlada. Se realizaron 10 mediciones con cada uno de los electrodos, para un total de 400 experimentos. El rango de medición se estableció entre pH = 3 (límite inferior) y pH = 11 (límite superior). Para cada experimento se siguió el siguiente protocolo y los pasos del 2 al 6 se repiten para soluciones buffer de cada uno de los pH de interés:
Preparación de la celda electroquímica con el electrodo, de referencia, y de conexión a GND. Como electrolito se utilizaron las soluciones buffer con pH valor conocido.
Con el medidor PP-15, se comprobó el valor del pH de la solución buffer a utilizarse como electrolito.
Se sumergieron los tres electrodos en un beaker con 40 ml de electrolito. La distancia entre el electrodo de trabajo y el de referencia se fijó en 5 cm, logrado mecánicamente utilizando un soporte universal.
Se comprobaron las conexiones eléctricas del sistema.
A través de la herramienta de software de Instrumentación Virtual, se realiza la medición durante 5 minutos (fs = 1 Hz) de los datos correspondientes a la diferencia de potencial entre los electrodos de la celda.
Al finalizar cada medición se limpiaron los electrodos de referencia y de trabajo con agua des ionizada.
De cada uno de los experimentos realizados se obtuvieron las curvas potenciométricas, dadas por la Variación del Potencial de la Celda Electroquímica vs Duración del Experimento. Se analizaron las características temporales de cada una de estas curvas, y se hallaron las curvas de calibración (Ecelda/pH) para cada tipo de electrodo. Para el procesamiento de los datos experimentales se utilizaron los programas OriginPro 8.5.0 SRI y Excel.
4.-RESULTADOS
4.1.- ANÁLISIS DE LA RESPUESTA TEMPORAL DE LAS CURVAS POTENCIOMÉTRICAS OBTENIDAS CON LOS ELECTRODOS DE VIDRIO/ITO/PANI-LS
Las curvas potenciométricas se caracterizaron por una respuesta transitoria inicial seguido de una tendencia a alcanzar un valor estable de potencial. Para cada una de las curvas potenciométricas se determinó el valor del potencial de la celda electroquímica (Ecelda) y el valor final estacionario al cual tiende cada una de las curvas potenciométricas. Se realizaron 200 experimentos con estos electrodos, donde el 93.5% (187 mediciones) mostraron respuestas temporales con una de las tendencias que se presentan en la figura 3.
El 79.1% de los experimentos mostraron un comportamiento creciente (tendencia 1) para los valores de pH 3, 4 y 7. Para los valores de pH 10 y 11, el 84.8% de los experimentos mostraron un comportamiento decreciente en el tiempo (tendencia 2). Este resultado sólo incluye a los electrodos de vidrio/ ITO/ PANI-LS.
El comportamiento creciente de las respuestas temporales para pH 3, 4 y 7, se debe a la acumulación de iones H+ a lo largo de la interfaz electrodo/electrolito. Estos iones buscan enlazarse con la estructura polimérica de la interfaz, proceso en el que ocurren reacciones de oxidación-reducción (REDOX). Durante estas reacciones se crea un potencial positivo directamente proporcional al logaritmo de la concentración de iones en la interfaz. Sin embargo, a medida que todas las posibilidades de enlaces se hayan cubierto, los iones H+ que no lograron enlazarse se alejan de la interfaz repelidos por sus homólogos, provocando que la diferencia de potencial resultante finalmente llegue a un valor constante, proporcional al logaritmo de la concentración de iones que lograron enlazarse con la cadena polimérica.
Para los valores de pH 10 y 11, la concentración de iones H+ presente en la interfaz electrodo/electrolito es baja en relación con los valores de pH 3, 4 y 7. Sin embargo la concentración de iones OH- en soluciones básicas es mayoritaria, lo que provoca que el número de iones de este tipo que se pueden enlazar con la estructura polimérica a través de reacciones REDOX sea mayor en relación con el número de iones H+. El potencial que se crea en la interfaz es negativo y proporcional a la concentración de los iones OH-.
4.2.- CURVAS DE CALIBRACIÓN
Las curvas de calibración establecen una relación entre la entrada de un sensor o transductor y su salida. En este caso la variable de entrada o independiente (correspondiente al eje de las abscisas del gráfico) es el pH de las soluciones buffer y la variable de salida o dependiente (correspondiente al eje de las ordenadas), es la diferencia de potencial entre el electrodo de trabajo y el electrodo de referencia. Las curvas de calibración que se obtuvieron en este trabajo son lineales con un límite inferior y superior comprendido entre 3 y 11 unidades de pH. A la pendiente de una curva de calibración se le denomina sensibilidad. En este trabajo, las curvas de calibración se obtuvieron a partir de los puntos de entrada/salida obtenidos luego de realizar las mediciones en el laboratorio. Se obtuvieron curvas de calibración de los electrodos de vidrio/ITO/PANI-LS y de los electrodos de vidrio/ITO.
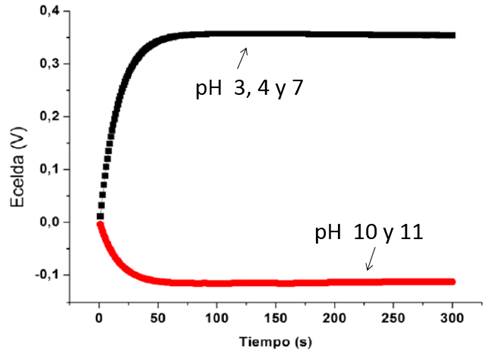
Figura 3 Tendencias de las respuestas temporales potenciométricas de los electrodos de vidrio/ ITO/ PANI-LS.
Se extrajeron los datos de las mediciones experimentales realizadas. De las 300 muestras contenidas en cada una de las curvas potenciométricas se tomaron los últimos 150 valores, cuando la señal había alcanzado el estado estacionario. Se garantizó que los datos seleccionados representaran la respuesta estabilizada de cada uno de los electrodos y se calculó el promedio y la desviación estándar utilizando el software OriginPro 8.5.0 SRI.
En la figura 4 se muestran las curvas de calibración obtenidas para los electrodos de vidrio/ITO/PANI-LS y vidrio/ITO. En la Tabla I se presentan los parámetros hallados a través del asistente matemático, luego del ajuste de cada una de las curvas.
El análisis de la figura 4 y de los datos aportados por la Tabla I permite apreciar que existe un alto grado de dependencia entre el pH y el potencial de celda, evidenciado por el valor del coeficiente de correlación r. En todos los casos r estuvo cercano a -0.99. Además, los valores del coeficiente de regresión lineal ajustado (R2) estuvieron entre 0.98 y 0.99. Los puntos de intersección y las pendientes de las curvas de calibración obtenidas presentaron desviaciones estándar por debajo del 10% de su valor lo cual es considerado aceptable.
La sensibilidad de la curva de calibración obtenida para los electrodos de vidrio/ITO/PANI-LS de 2.0 cm x 1.5 cm fue de -55.17 mV/pH, lo cual coincide en un 93.21% con el valor teórico reportado en la ley de Nernst para la medición de pH (que es de -59.2 mV/pH). Esta respuesta puede clasificarse como cercana a la nernstiana.
En el caso de los electrodos de vidrio/ITO/PANI-LS de 2.0 cm x 2.5 cm, la sensibilidad tuvo un valor de -56.57 mV/pH, un 95.55 % del valor teórico reportado en la ley de Nernst. Al igual que el primer caso analizado, esta respuesta se puede clasificar como cercana a la nernstiana.
Los electrodos de vidrio/ITO de 2.0 cm x 1.5 cm y de 2.0 cm x 2.5 cm mostraron sensibilidades de -53.5 mV/pH y -56.63 mV/pH, respectivamente. Estos valores presentan un 90.43% y un 95.72% de coincidencia con el valor teórico de la ley de Nernst. Las respuestas potenciométricas de estos electrodos también pueden clasificarse como cercanas a las nernstiana.
Los electrodos de vidrio/ITO/PANI-LS además de haber sido construidos mediante un método sencillo, mostraron sensibilidades cercanas a la nernstiana. Estos resultados son similares a los reportados en la literatura con otros materiales. Este aspecto constituye una ventaja del uso del PANI-LS en la construcción de electrodos para la medición de pH.
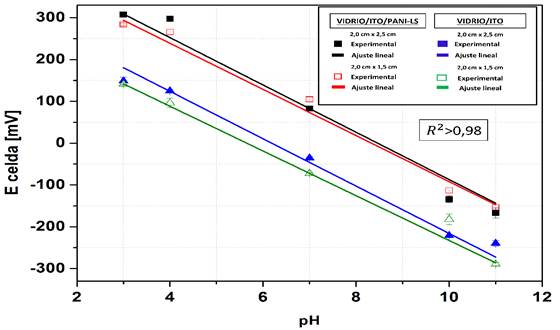
Figura 4 Curvas de calibración de los electrodos de vidrio/ ITO/ PANI-LS y vidrio/ ITO con dimensiones de 2.0 cm x 2.5 cm y 2.0 cm x 1.5 cm.
Tabla 1 Parámetros obtenidos del ajuste de las curvas de calibración de los electrodos según sus dimensiones.
| Material del electrodo | Dimensión del electrodo | Pendiente (mV/pH) | r/ R2 | |
|---|---|---|---|---|
| Valor | D.E | |||
| Vidrio/ITO/PANI-LS | 2.0 cm x 1.5 cm | -55.17 | ±3.43 | -0.99/ 0.98 |
| 2.0 cm x 2.5 cm | -56.57 | ±1.32 | -0.99/ 0.99 | |
| Vidrio/ITO | 2.0 cm x 1.5 cm | -53.50 | ±1.44 | -0.99/ 0.99 |
| 2.0 cm x 2.5 cm | -56.63 | ±2.32 | -0.99/ 0.99 | |
5.-CONCLUSIONES
En este trabajo se diseñaron y construyeron utilizando la técnica de auto montaje, electrodos de vidrio/ITO/PANI-LS no reportados anteriormente en la literatura para la medición potenciométrica de pH. Además, se utilizaron como electrodos láminas de vidrio/ITO obtenidas comercialmente.
También, se diseñó y construyó un sistema de medición potenciométrico para la medición de pH conformado por una celda electroquímica, un amplificador de instrumentación INA 116P, una TAD NI USB-6212 y un Instrumento Virtual.
Se comprobó experimentalmente que con los dispositivos y los procedimientos de medición empleados, pueden realizarse la medición potenciométrica de pH de soluciones líquidas en condiciones de laboratorio. Lo anterior de demuestra por la dependencia lineal obtenida entre el potencial de la celda electroquímica y los valores de pH en un rango de 3 a 11.
Los electrodos de vidrio/ ITO/ PANI-LS mostraron respuestas potenciométricas que pueden clasificarse como cercanas a la nernstiana. La sensibilidad de los electrodos de 2.0 cm x 1.5 cm fue -55.17 mV/pH; y la de los electrodos de 2.0 cm x 2.5 cm fue -56.57 mV/pH.
Los electrodos de vidrio/ ITO mostraron respuestas potenciométricas que también pueden clasificarse como cercanas a la nernstiana. La sensibilidad de los electrodos de 2.0 cm x 1.5 cm fue -53.5 mV/pH; y la de los electrodos de 2.0 cm x 2.5 fue -56.63 mV/pH.
Los resultados obtenidos experimentalmente muestran que es posible utilizar electrodos de vidrio/ITO/PANI-LS y vidrio/ITO para construir celdas electroquímicas para la medición de pH.