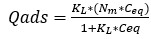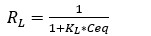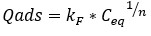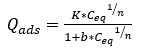INTRODUCCIÓN
El agua residual de los procesos industriales constituye una de las principales vías de contaminación ambiental; por ello, los métodos de tratamiento de residuales líquidos cobran gran importancia (Basso y Cukierman 2001; Ahmet et al. 2007; Ghassabzadeh et al. 2010; Tapia et al. 2017, 2018; Carbonel 2018; Pabón et al. 2020). Entre los métodos con esta finalidad, la adsorción usando materiales naturales como adsorbente (Alkan 2001; Ahmet et al. 2007; Blanchard, Maunaye y Carbonel 2018) se aplica en las investigaciones científicas para la recuperación de metales pesados tales como cadmio, cobre, mercurio, níquel, hierro, plomo y zinc (Cabrera, Gabaldon y Marzal 2005; Blanchard, Maunaye y Carbonel 2018; Carbonel 2018; Garrido et al. 2019; Pabón et al. 2020; Mishell, Johama y Ramirez 2022).
Diversas tecnologías y métodos de análisis se emplean para eliminar la contaminación del agua por metales pesados (Basso y Cukierman 2001; Caviedes, Delgado y Olaya 2016; Coz 2022; Ghassabzadeh et al. 2010; Góngora y Sosa 2022; Leyva et al. 2001; Tejeda y Herrera 2014; Zamzow et al. 1990). Uno de los más usados en la actualidad en el tratamiento de residuales con iones metálicos en soluciones es el método de absorción (Alkan 2001; Córdova 2015; Rodríguez 2016).
Con base en sus propiedades adsorbentes la zeolita, natural o modificada, constituye uno de los adsorbentes investigados en el tratamiento de residuales industriales (Estupiñán y otros 1998; Leyva et al. 2001; Rodríguez et al. 2006; Tapia et al. 2011; Malamis y Katsou 2013; Ismadji, Soetaredjo y Ayucitra 2015; Rodríguez 2016; Armas y Calapaqui 2022). Algunos autores (Estupiñan, Sarmiento y de Galvis 1998; Cabrera, Gabaldon y Marzal 2005; Rodríguez et al. 2006) investigan el intercambio catiónico empleando una zeolita natural (clinoptilolita) con relación Si/Al igual a 5, inicialmente con soluciones patrón de Cu(II) y Ni(II) y posteriormente con los enjuagues de los baños de recubrimientos metálicos, en el tratamiento de residuales de recubrimientos electrolíticos mediante adsorción para disminuir la contaminación por iones Cu(II) y Ni(II).
La industria cubana del níquel aplica tratamiento a sus residuales líquidos para minimizar su impacto ambiental y recuperar iones metálicos disueltos. A este fin se han utilizado zeolitas naturales en la recuperación de Ni(II), Co(II) y amonio de las soluciones carbonato amoniacales residuales del proceso de lixiviación Carón de minerales lateríticos. En una investigación Rodríguez, Rodríguez y Basa (1997) demuestran la selectividad por el amonio en una primera etapa, que luego favorece la adsorción mediante el intercambio de iones Ni(II) y Co(II) en la segunda etapa. Comprueban la diferencia en las velocidades de adsorción, lo que podría ser una vía para la separación selectiva de los iones metálicos. Posteriormente al usar mezclas de soluciones residuales de los procesos de lixiviación carbonato amoniacal, con pH igual a 9, y de la lixiviación ácida a presión, con pH igual a 3, comprueban la recuperación de Ni(II), Co(II) y la neutralización del residual a pH igual a 7.
Resultados de pruebas de adsorción (Tapia et al. 2011) demuestran que la zeolita natural adsorbe los iones Cu(II) con una eficiencia de remoción cercana al 99 % durante los primeros 60 minutos. Los tiempos de ruptura y saturación se alcanzan a las 4,2 h y 34,6 h, respectivamente. En cuanto a la reutilización de la zeolita, se determina que su capacidad de captación de iones Cu(II) es completamente regenerada mediante la aplicación de una solución de NaCl (100 g/L).
Cabrera, Gabaldon y Marzal (2005) analizaron el uso del material zeolítico natural de Cuba para la remoción de varios iones metálicos, tales como Cu(II), Zn(II) y Ni(II), con el propósito de evaluar su uso potencial como un adsorbente de bajo costo. Ellos demuestran que la selectividad de estos iones metálicos sigue el orden siguiente: Cu(II) >Zn(II)>Ni(II).
Rodríguez (2016) evalúa la capacidad de adsorción de zeolitas naturales: clinoptilolita y heulandita, para los cationes metálicos de plomo(II), Cu(II), cinc(II), manganeso(II), Ni(II) y amonio. Las pruebas realizadas con clinoptilolita evidenciaron grados de remoción con el orden siguiente: Pb(II) > Cu(II)> Cd(II)> Zn(II)> Mn(II)> Ni(II) y el proceso cumple la ecuación isoterma de adsorción de Freundlich; mientras que en los ensayos con heulandita, la selectividad de remoción siguió el orden: Pb(II) > Cd(II) > Cu(II) > Zn(II) > Mn(II) > NH4+. Los resultados con zeolita heulandita tratada con una solución de cloruro de sodio demostró que la capacidad de adsorción de Cu(II) es superior al de Zn(II) y Mg(II).
Esta investigación tuvo el propósito de caracterizar la remoción de iones Cu(II) y Ni(II) empleando como material adsorbente zeolita en estado natural de la zona central de Cuba y aplicando el método de adsorción con soluciones acuosas modeladas, en un rango de pH entre 4 y 6 unidades.
MATERIAL Y MÉTODO
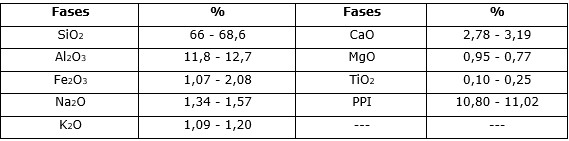
Se utilizó zeolita natural cubana con tamaño de partícula de 0,47 mm, área específica de 38,5 m2/g cuya composición química refleja contenidos de sílice y aluminio superiores al 65 % y 11 %, respectivamente; calcio inferior al 3,5 % y el resto de los componentes inferiores al 2 % (Tabla 1).
La composición mineralógica, determinada por difracción de rayos X muestra que entre el 70 % y el 85 % de la zeolita es clinoptilolita-mordenita, con cantidades minoritarias de cuarzo y óxidos e hidróxidos de hierro.
Para analizar el proceso de adsorción se prepararon soluciones acuosas modeladas, usando reactivos puros con concentraciones en un intervalo de 300 mg/L -1500 mg/L para el Cu(II) y 100 mg/L -1500 mg/L para el Ni(II), las cuales fueron almacenadas en condiciones ambientales. Los experimentos se realizaron en batch, con dosis de zeolita de 10 g a 15 g. Se empleó el método espectrofotométrico en la determinación de las concentraciones de Cu(II) y Ni(II) en las soluciones modeladas.
Métodos de estudio cinético
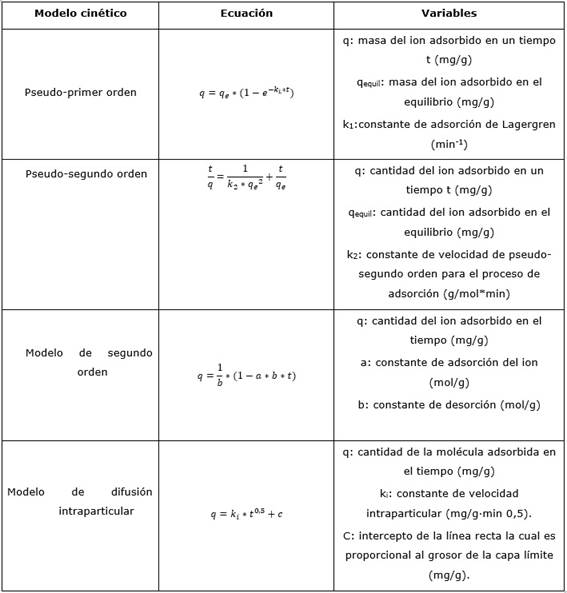
Varios modelos matemáticos empíricos permiten obtener los parámetros cinéticos de adsorción con los cuales es posible describir el fenómeno físico o químico que tiene lugar. Entre estos se encuentran los modelos de pseudo-primer orden, pseudo-segundo orden, segundo orden y difusión intraparticular (Azizian 2004; Kennedy y Murthy 2010). La adsorción en la interface sólido-líquido en un sistema perfectamente mezclado es descrita generalmente por las etapas siguientes:
Etapa 1. Difusión del soluto desde el seno de la fase líquida hacia la película líquida que rodea el adsorbente.
Etapa 2: Difusión a través de la película líquida que rodea las partículas del adsorbente.
Etapa 3: Difusión en los poros del adsorbente o difusión intraparticular.
Etapa 4: Adsorción en los sitios activos del material.
Se considera que la velocidad del proceso está controlada por las etapas 2 y 3, difusión externa y la difusión intraparticular, respectivamente. En el estudio cinético se analizaron los modelos siguientes que describen la velocidad del proceso (Tabla 2):
- Modelo de pseudo-primer orden propuesto por Lagergren (Ghassabzadeh 2010), comúnmente usado en el caso de la adsorción física, siendo la velocidad de adsorción proporcional a la concentración de soluto.
- Modelo de pseudo-segundo orden. En este modelo la etapa limitante de la velocidad está dada por la quimisorción.
- Modelo de segundo orden. Característico en la adsorción química sobre materiales altamente heterogéneos. Considera que la adsorción tiene lugar en sitios energéticamente diferentes sobre la superficie del sólido.
- Modelo de la difusión intraparticular. Este describe que el transporte del adsorbato desde el seno de la solución hacia la fase sólida; está dado por el proceso de transporte/difusión intraparticular, siendo el paso limitante en muchos procesos de adsorción.
Isotermas de adsorción
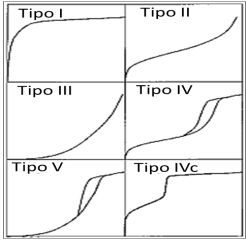
El estudio de adsorción puede realizarse mediante la identificación de la forma y la curvatura de las isotermas de adsorción y mediante su modelo matemático (Azizian 2004; Garrido et al. 2019). La forma de las isotermas depende en gran medida del tipo de adsorbente y el adsorbato, por tanto, las mismas serán diferentes como se indica en la Figura 1, según la clasificación de la IUPAC.
Para el análisis de los datos experimentales se han desarrollado diversos modelos matemáticos, siendo los más utilizados: Langmuir, Freundlich y Langmuir-Freundlich. Aunque existen otros modelos como el de Redlinch- Peterson, Toth, Tempkin, entre otros.
Isoterma de Langmuir
Este modelo considera que la superficie está idealmente limpia y homogénea. La adsorción ocurre en sitios específicos del adsorbente y todos son idénticos. Solo un adsorbato ocupa cada sitio, y una vez formada la monocapa cesa la adsorción. Puede ser descrito por la ecuación 1.
Dónde:
Qads: cantidad de soluto adsorbido por peso unitario de adsorbente (mol/g).
Nm: capacidad máxima de adsorción (mol/g).
KL: constante de saturación (mol/L).
Ceq: concentración del adsorbato en la disolución en el equilibrio (mol/L).
Las características esenciales del modelo de Langmuir pueden ser expresadas en términos del factor de separación (RL), el cual está definido por la ecuación 2.
De acuerdo al valor de RL la forma de la isoterma puede ser interpretada de la siguiente forma:
RL > 1, adsorción no favorable
RL = 1, adsorción lineal
0 < RL < 1, adsorción favorable
RL = 0, adsorción irreversible
Isoterma de Freundlich
Este modelo fue establecido empíricamente y se basa en que la adsorción es de naturaleza física, no hay asociación de las moléculas adsorbidas y la superficie del adsorbente es heterogénea.
El modelo clásico de Freundlich está descrito por la ecuación 3.
Dónde:
Qads: cantidad de soluto adsorbido por peso unitario de adsorbente (mol/g).
1/n: coeficiente de Freundlich (1<n<10).
kF: constante de Freundlich (mol/g).
Ceq: concentración del adsorbato en la disolución en el equilibrio (mol/L).
Es un modelo útil para determinar la adsorción en soluciones líquidas y es riguroso para los casos que ocurren en superficies heterogéneas.
Isoterma de Langmuir-Freundlich
El modelo de Langmuir-Freundlich es una combinación de ambos, por lo que representa una adsorción mediante una combinación de mecanismos sobre materiales heterogéneos. La ecuación 4 describe este modelo.
Donde:
Qads: cantidad de soluto adsorbido por peso unitario de adsorbente (mol/g)
1/n: coeficiente de Freundlich (1<n<10)
K, b: constantes empíricas del modelo de Langmuir
Ceq: concentración del adsorbato en la disolución en el equilibrio (mol/L)
RESULTADOS Y DISCUSIÓN
Utilizando zeolita como material adsorbente para la remoción de iones Cu(II) y Ni(II) de soluciones acuosas modeladas (Martin 1984; Zamzow 1990; Rodríguez, Rodríguez y Basa 1997; Leyva 2001; Rodríguez et al. 2006; Kennedy y Murthy 2010; Tapia et al. 2011; Malamis y Katsou 2013; Rodríguez 2016) se obtuvieron los modelos cinéticos y las ecuaciones isotermas de adsorción que describen el proceso de recuperación de los iones Cu(II) y Ni(II).
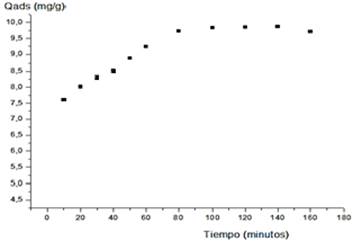
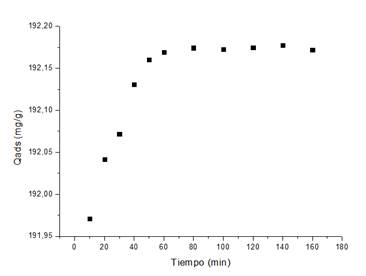
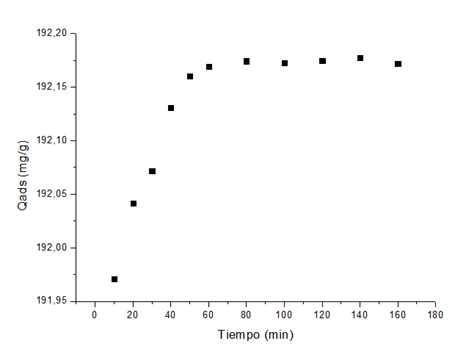
El estudio cinético permitió comprobar que la remoción del Cu(II) y Ni(II), muestra inicialmente un incremento paulatino de la masa de iones metálicos adsorbidos, hasta alcanzar valores constantes que representan el estado de equilibrio o de saturación de la superficie del material adsorbente. En las Figuras 2 y 3 se comprueba que para el Cu(II) el equilibrio se establece a los 80 min, mientras que para el Ni(II) es a partir de 60 min; en ambos casos el tiempo óptimo, según las condiciones experimentales, para lograr la máxima remoción de Cu(II) y Ni(II).
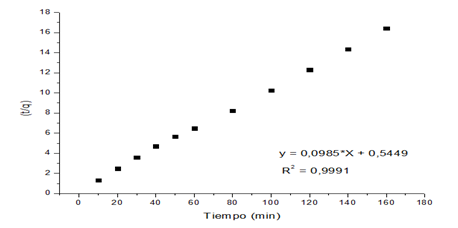
Al analizar los resultados experimentales se demostró que la cinética del proceso de adsorción de los iones Cu(II) y Ni(II) es descrito por el modelo de pseudo-segundo orden, como se muestra en las Figuras 4 y 5.
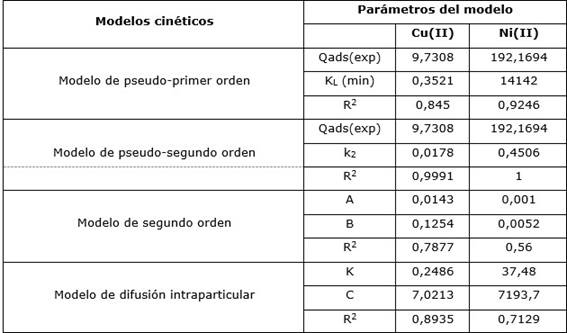
Los resultados experimentales de los modelos cinéticos estudiados sobre el proceso de adsorción, indicados en la Tabla 3, muestran que el modelo de pseudosegundo orden describe con exactitud la adsorción del Cu(II) y el Ni(II) en la zeolita usada como adsorbente, lo cual es corroborado por los coeficientes de correlación alcanzados. Este resultado es similar a los obtenidos en otras investigaciones (Nibou, Barkat y Trari 2010; Malamis y Katsou 2013; Plazinski, Dziuba y Rudzinski 2013; Blanchard, Maunaye y Carbonel 2018) para la adsorción de los iones metálicos Cu(II) y Pb(II) en bentonita, caolín, zeolita naturales y modificadas.
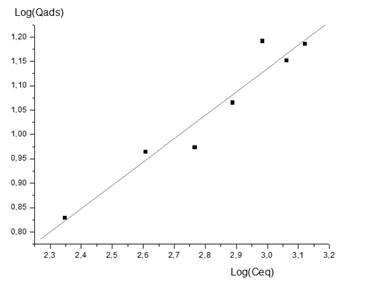
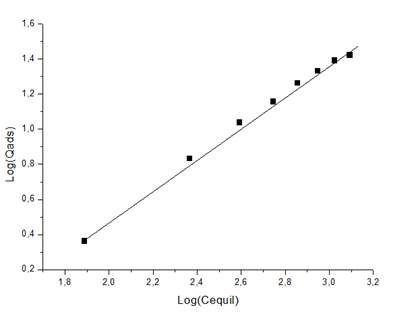
El análisis de los modelos de las isotermas de adsorción permitió comprobar que el correspondiente a Freundlich describe la adsorción de ambos iones en la zeolita natural, como se puede observar en las Figuras 6 y 7 y en la Tabla 4.
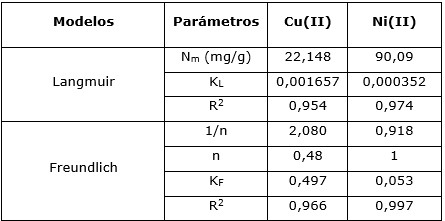
El coeficiente de regresión tomó valores de 0,966 para los iones de Cu(II) y 0,997 para los de Ni(II), revelando así que los modelos describen con exactitud el proceso de adsorción. Además, el valor del factor de separación (RL) calculado para el rango de concentraciones inicial de cada ion seleccionado para realizar la investigación toma valor entre 0 y 1, demostrando que la adsorción en la zeolita es factible.
Isotermas de adsorción
Los máximos valores de adsorción para los iones Cu(II) y Ni(II) en el equilibrio son de 22,148 mg/g y 90,09 mg/g respectivamente, resultando elevados al ser comparados con los reportados en la literatura para la remoción de los iones Cu(II), Ni(II) y otros iones metálicos empleando diversos materiales adsorbentes (Basso y Cukierman 2001; Tejeda y Herrera 2014; Tapia 2017, 2018; Garrido et al. 2019; Pabón et al. 2020; Góngora y Sosa 2022). En el caso del Cu(II), este resultado es inferior a la bentonita sódica y al carbón activado, superior al caolín y la bentonita cálcica y similar al resto de los adsorbentes.
Tal comportamiento puede explicarse no solo por un intercambio de iones entre el material adsorbente y el adsorbato, sino también puede deberse a atracciones electrostáticas entre los grupos hidroxilos superficiales y la molécula hidrolizada con interacciones débiles por puentes de hidrógeno.
En la literatura especializada (Ahmet et al. 2007) se reporta que los cationes multivalentes pueden ser adsorbidos sobre la superficie de un sólido a través de la salida de impurezas hacia la solución o producto de atracciones electrostáticas entre los grupos activos superficiales e incluso podría tener lugar un proceso de precipitación en el material, dependiendo del pH de la solución y la forma en que se presente el metal en dicho medio.
Los resultados demuestran que la zeolita presenta una capacidad de remoción de 22,148 mg/g para el ion de Cu(II), similar a los reportados en otras investigaciones (Tapia et al. 2011) y 90,09 mg/g para el ion de Ni(II). Esto se debe a que en la superficie de la zeolita natural existen grupos superficiales Si-OH2+ (silanodioles) los cuales intervienen directamente en la remoción de los contaminantes. Los silanodioles son considerados grupos superficiales débilmente ácidos (Alkan 2001), pueden exhibir reacciones de intercambio iónico entre los iones hidronios (H3O+) y los cationes multivalentes, en este caso Cu(II) y Ni(II) (Rodríguez et al. 2006).
La influencia del pH en el proceso de adsorción ha sido estudiada en investigaciones precedentes, en las que se ha concluido que durante el proceso hay disminución del pH de las soluciones y que a valores de pH bajos, la superficie del material adsorbente se carga positivamente incrementando la repulsión entre los iones metálicos y los grupos superficiales, sin embargo, a medida que se incrementa el pH del medio, la superficie del material se carga negativamente, disminuyendo la repulsión entre los grupos superficiales y los iones, aumentando gradualmente la remoción de los iones metálicos.
Experimentalmente se corroboró que los mejores resultados de remoción de Cu(II) se obtienen en el intervalo de 4 a 6 unidades de pH, y valor óptimo cuando el pH es de 5 unidades, coincidiendo con las condiciones de equilibrio de las soluciones acuosas, similar a los valores obtenidos (Ahmet et al. 2007) en la remoción de Cu(II) y Pb(II).
Otro aspecto muy importante es que en el proceso de adsorción del Cu(II) y Ni(II) no ocurre la precipitación de los respectivos hidróxidos de estas especies, ya que las concentraciones molares utilizadas en la investigación, son inferiores a las necesarias para alcanzar el pH de precipitación de los hidróxidos de cobre y níquel.
CONCLUSIONES
El estudio cinético del proceso de adsorción de los iones Cu(II) y Ni(II) demuestra que se alcanza el estado de equilibrio a los 80 min y 60 min, respectivamente. El modelo cinético de pseudo-segundo orden describe el proceso de adsorción para ambas especies metálicas.
La ecuación isoterma de adsorción de Freundlich describe la adsorción del Cu(II) y Ni(II) en la zeolita natural, con capacidades máximas de adsorción para el Cu(II) y Ni(II) de 22,148 mg/g y 90,09 mg/g, respectivamente.
La zeolita natural puede utilizarse como adsorbente del Cu(II) y Ni(II) en las soluciones residuales, alcanzando los mejores resultados para un valor óptimo pH igual a 5 unidades.