Introducción
Los tumores del estroma gastrointestinal (GIST) son los tumores mesenquimales más frecuentes en el tracto gastrointestinal,su incidencia anual se reporta entre 10 y 20 casos por millón de habitantes en países desarrollados, y entre el 20 y el 45% son malignos.1,2,3La expresión de la glucoproteina transmembrana que forma parte del receptor celular KIT (CD117) con actividad tirosin-quinasa sintetizado a partir del proto-oncogén c-kit caracteriza a estos tumores.1,2,3,4 La expresión de c-KIT y de CD 34 común a los tumores GIST y a las células intersticiales de Cajal y las similitudes ultraestructurales ha llevado a considerar que estos tumores se originan de estas células o de sus precursores.5,6
Los elementos clínicos más frecuentes son la presencia de tumor abdominal, hemorragia digestiva por ulceración mucosa y el dolor o sensación de plenitud abdominal.7,8) Los GIST tienen generalmente un largo período de crecimiento silente hasta manifestarse clínicamente, suelen tener un crecimiento expansivo desplazándose las estructuras vecinas sin invadirlas y ello, explica que no sea infrecuente que estas lesiones puedan medir 20 o 30 cm al momento del diagnóstico en dependencia del órgano en que asienten.
Para el diagnóstico se requiere la combinación de estudios endoscópicos e imaginológicos. Los hallazgos de la ecografía, la ecoendoscopía y la tomografía son muy sugestivos de éste diagnóstico. Las densidades imagenológicas y la homogeneidad o no, de las mismas muchas veces orientan al radiólogo experimentado, hacia el tumor estromal.
En ocasiones como en el presente caso, las enormes dimensiones del tumor, el importante desplazamiento de estructuras y su vecindad a estructuras vitales hace pensar que se trata de un tumor irresecable y se niega al paciente tal posibilidad. Sin embargo un análisis meticuloso de las imágenes por personal con experiencia y una intervención compleja, pero segura es totalmente factible.
Presentación de caso
Se trata de un paciente masculino de raza negra de 56 años de edad, con antecedentes de hipertensión arterial, que acude refiriendo pérdida de peso de 15 Kg en 4 meses y sensación de plenitud gástrica progresiva de 2 meses de evolución. Niega dolor, pero nota aumento del diámetro del abdomen que le hace muy incómodo el descanso en decúbito supino.
Al examen físico se constata un aumento llamativo de la circunferencia abdominal, simétrica, con aumento de la circulación venosa tegumentaria que se hace visible fácilmente a pesar de la tez oscura del enfermo. A la palpación se detecta una gran tumoración, redondeada, renitente no movible, indolora, cuyos límites se pierden por debajo del reborde costal y la pelvis.
Los estudios hemoquímicos se muestran dentro de parámetros normales, salvo por una Hemoglobina en 9 g/dl. La Radiografía de Tórax (Rx) se encuentra dentro de límites normales. La ecografía abdominal revela una gran imagen hipoecogénica, heterogénea de bordes redondeados que ocupa prácticamente todo el abdomen y rechaza prácticamente, todo el intestino delgado hacia el flanco y fosa ilíaca izquierda. El riñón izquierdo se encuentra desplazado hacia abajo, sin infiltración. No se logra delimitar la lesión de la pared posterior del cuerpo gástrico ni el cuerpo del páncreas. No se evidencia infiltración vascular.
Endoscopia Superior. Esófago y duodeno normales, hacia la cara posterior del cuerpo gástrico que aprecia un abombamiento que impresiona por compresión extrínseca a ese nivel.
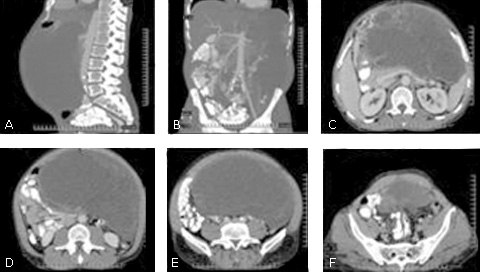
En la Tomografía Axial Computadorizada (TAC) contrastado de abdomen (Fig. 1) se aprecia una tumoración polilobulada de 25 x 30 cm con densidades heterogéneas que recuerda a una tumoración sólida con aéreas de necrosis central. La lesión ocupa prácticamente todo el abdomen desplazando el intestino delgado hacia el hemiabdomen izquierdo, al bazo hacia arriba y el riñón izquierdo muy desplazado hacia abajo. El estómago se encuentra muy comprimido y rechazado contra la pared abdominal anterior y la cola del páncreas está rechazada hacia atrás y arriba. No se evidencia infiltración vascular, la vena Cava y la Porta impresionan comprimidas por la lesión. La tumoración está muy vascularizada. La biopsia aspirativa, dio no útil en dos ocasiones.
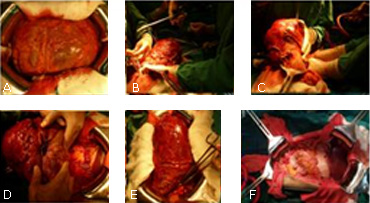
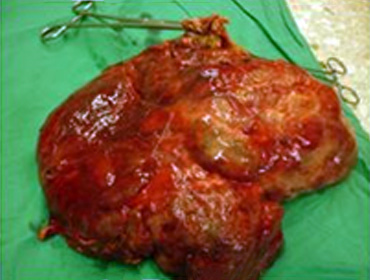
Se decide intervenir quirúrgicamente al paciente con el diagnóstico presuntivo de un Tumor Gástrico de Estroma Gastrointestinal Gigante y durante la laparotomía se encuentra, una tumoración muy vascularizada que bloquea prácticamente todo el abdomen. Se moviliza con gran dificultad (Fig. 2), liberándose adherencias a la pared, el epiplón mayor, el intestino delgado y la Gerota izquierda; se logra exteriorizar la lesión en íntimo contacto en su cara posterior con la raíz del mesenterio y la porta (Fig. 3). Dicha lesión proviene de un pedículo que emerge de la curvatura mayor gástrica de unos 5 cm. Se realiza una resección atípica gástrica en curvatura mayor con márgenes de seguridad de más de 2 cm y gastrorrafia en un plano continúo. El paciente evoluciona muy favorablemente y es dado de alta al quinto día del postoperatorio.
En la biopsia de pieza quirúrgica se diagnosticó un tumor de estroma gastrointestinal.
Al año de seguimiento el paciente se encuentra libre de enfermedad, asintomático y con recuperación de su peso y actividades habituales.
Discusión
Los GIST gástricos son dentro de las localizaciones del tubo digestivo, la más frecuente en la mayoría de las series y los de mejor pronóstico.9,10) Parecería según estos estudios que la topografía tumoral sería un factor pronóstico no independiente, y relacionado con otros, más contundentes como el tamaño tumoral y el índice mitótico. Los GIST gástricos menores de 5 cm son generalmente benignos y hasta los 10 cm tienen buen pronóstico.11
En un estudio publicado por Appelman y Heldwig en la Revista Americana de Patología Clínica, se muestra que tumores de < 6 cm tenían un porciento de metástasis al momento del diagnóstico de 20 %, y aquellos con tumores ≥ 6 cm el porciento era del 85 %.12
Esta variable pronóstica, debemos decir que está muy relacionada con la topografía tumoral, y la actividad mitótica. Por ejemplo se afirma que las lesiones gástricas son menos agresivas que las intestinales entre otras cosas, porque al momento del diagnóstico, por lo general, son más pequeñas (< 5cm.) y tienen un bajo conteo mitótico.11,13
La mayoría de los patólogos están de acuerdo en destacar que el conteo o la actividad mitótica es uno de los parámetros importantes a tener en cuenta en la valoración pronóstica de estas lesiones. Los GIST excepcionalmente se presentan con un patrón mitótico de más de 20 a 50 por 50 HPF. Los tumores estromales que presentan estos recuentos deben catalogarse como altamente malignos Los GIST pequeños, que aún están confinados a la pared del órgano que les dio origen pueden tener, como ya dijimos, un crecimiento tanto exofítico hacia la serosa como endofítico hacia la mucosa. En los GIST de mayor tamaño estos parámetros pierden relevancia.
La invasión de las capas musculares es el patrón de crecimiento típico de los GIST, sobre todo si consideramos que las células que le dieron origen (Células Intersticiales de Cajal) se encuentran entrelazadas entre las capas de músculo liso. Este tipo de invasión no tiene relevancia pronóstica.14
En su crecimiento expansivo estas lesiones comprometen sucesivamente la serosa del órgano y luego estructuras vecinas, estas lesiones no presentan una cápsula verdadera y generalmente desplazan pero no invaden, estructuras vecinas. Este elemento puede evidenciarse en nuestro caso de estudio a pesar de las grandes dimensiones del tumor. La invasión es un claro parámetro de malignidad. Según la experiencia de Miettinen, la invasión mucosa sólo se ve en los GIST malignos.15 Expresó que el patrón de crecimiento submucoso de estas lesiones es similar al de los linfomas, entre los elementos glandulares. En tres series diferentes de casos clínicos se mostró a la invasión mucosa como parámetro negativo en cuanto al pronóstico.16,17 La sola presencia de una úlcera mucosa no debe ser considerada como invasión. La ulceración de la mucosa puede ser común en los GIST gástricos y de intestino delgado, y muchas veces condiciona su forma de presentación. La mayoría de los GIST (89 %) expresaban el CD117+, y en el 57 % de ellos, la mutación estaba en el exón 11. Los pacientes que presentaron la mutación en el gen c-Kit mostraron un porciento mayor de recurrencias (p = 0,0006) y una mayor mortalidad que aquellos sin la mutación (49 % vs. 86 % sobreviva a 5 años. p = 0,0001). Concluyen en este trabajo que la mutación del c-Kit es un fuerte marcador pronóstico y puede ser potencialmente utilizado como herramienta para predecir el resultado clínico de los pacientes con GIST
Los tumores estromales del tubo digestivo presentan un crecimiento local característico que en la mayoría de ellos, es exofítico por eso raramente ocluyen, aunque a veces pueden hacerlo por su forma de crecimiento expandiendo y comprimiendo.
Menos frecuentemente presentan un crecimiento endofítico y es en estos casos donde determinan más frecuentemente obstrucción intestinal, aunque en ellos, el sangrado por ulceración mucosa sigue siendo un síntoma no infrecuente.
No se extienden por vía submucosa lo que tiene importancia terapéutica, ya que el margen de resección en general no es un problema si se realiza una resección marginal, incluyéndose todo el tejido tumoral objetivable macroscópicamente en la pieza.
En lo regional, al igual que el resto de los sarcomas, no es frecuente la diseminación linfática. Las metástasis linfáticas se presentan en 10 - 15 % de los casos.18
Consideraciones finales
La resección quirúrgica radical en la enfermedad primaria, en algunos casos de recidiva locoregional y cuando es posible en tumores metastáticos sintomáticos, sigue siendo la modalidad terapéutica de elección. Los tumores estromales generalmente no se extienden invadiendo la pared del órgano, por lo tanto, no son necesarios márgenes amplios de resección visceral.
Si están involucrados órganos contiguos, es necesaria una resección en bloque. La apertura tumoral intraoperatoria debe evitarse por el demostrado peor pronóstico en estos casos. Se asocia con un aumento del riesgo de recurrencia peritoneal.19).
No deben realizarse resecciones ganglionares regladas, salvo el compromiso macroscópico evidente. Los márgenes de resección visceral necesarios en el tratamiento de los tumores estromales. En estos pacientes el margen macroscópico considerado seguro, osciló entre 1,5 y 2 cm. El estudio microscópico de las piezas rebeló que no se reconocía tumor más allá de los 3 mm de la lesión. Basados en esta escasa pero aparentemente contundente observación, se permite afirmar que 2 cm es un margen seguro en la extensión de la resección visceral. La hipótesis que se plantea es que el STI571 puede tener su máximo impacto en la sobrevida cuando existe poca carga tumoral, y esto sucede luego de la resección macroscópica del tumor primario. El tratamiento de los eventuales focos microscópicos residuales sería el objetivo de la terapia adyuvante.20,21
Esta entidad claramente debe ser bien diferenciada de los tumores epiteliales de la mucosa en el preoperatorio, con pronóstico y agresividad evidentemente distinta y en los que la resección R0 puede ser posible aun en tumores de gran tamaño.22,23
En la actualidad, la aparición de imatinib (desarrollado por Novartis) ha permitido que los GISTs Kit+ (mutación que se presenta en más del 95 % de los casos de GIST) detengan su avance e incluso reduzcan su tamaño.24).No es una alternativa a la cirugía. Se emplea en aquellos casos en los cuales es imposible extirpar el tumor (por su tamaño o porque el paciente no puede operarse) y también, en quienes han sufrido la diseminación del cáncer a otros órganos (metástasis). Existen nuevas drogas como el sunitinib y el regorafenib en actual uso para aquellos casos no respondedores al imatinib.25,26,27,28