Introducción
El cáncer es una de las enfermedades más preocupantes en la actualidad, el número de personas que lo padecen aumenta cada año, siendo la tercera causa de muerte a nivel mundial, con una incidencia de 14,1 millones de personas y con una mortalidad de 8,2 millones.1 En Cuba representa la segunda causa de muerte con un número de 24 902 defunciones en el año 2018.2)
A pesar de las técnicas de tratamiento antitumoral convencionales, las cifras de casos diagnosticados y la tasa de mortalidad continúa en incremento. Por este motivo se requiere de enfoques terapéuticos que sean capaces de adelantarse a los medios convencionales existentes hoy día.3
Aunque la cirugía permanece como la primera línea de tratamiento en los casos en los que resulta técnicamente posible, existe una extensa parte de la población que escapan a los criterios quirúrgicos. Las técnicas ablativas han ampliado el espectro terapéutico para aquellos pacientes sin otra opción.4
El término ablación se define como la aplicación directa de un tratamiento químico o térmico en lesiones tumorales localizadas, con la intención de lograr su erradicación o destrucción parcial. En la actualidad existen numerosos métodos de ablación, que se pueden clasificar en: químicos, térmicos, con material genético y con semillas radioactivas.5
La primera técnica que se introdujo fue la inyección percutánea intratumoral de etanol. A principios de la década del 90 se realizó la primera ablación tumoral por radiofrecuencia, con mejores resultados que la alcoholización. De esta manera fueron desarrollándose nuevas modalidades como la ablación por microondas, que junto a la radiofrecuencia, son las más empleadas en la actualidad. Resulta de interés además mencionar las técnicas más novedosas como el ultrasonido focalizado de alta intensidad, electroporación irreversible, ablación percutánea por láser y la crioterapia.5
Al cambiante panorama de la terapéutica antitumoral se suma el vertiginoso desarrollo de algunas subespecialidades, como es el caso de la radiología intervencionista y la oncología intervencionista. Esta es una modalidad terapéutica poco invasiva, realizada con control imagenológico y que permite guiar en los 3 planos del espacio, los medios utilizados para el tratamiento. Prácticamente todos los medios imagenológicos son útiles para guiar los procederes ablativos, pero, sin dudas, los más empleados son la tomografía computarizada, la ecografía y la fluoroscopía.6
Para lograr una mayor efectividad es imprescindible que cada caso sea valorado individualmente, por un equipo multidisciplinario, donde se tengan en cuenta los criterios de tratamiento que mejor se ajusten a cada paciente, así como el tipo de ablación que sea requerido. Igual importancia tiene el seguimiento y evaluación de respuesta en el tiempo establecido, según la localización y la extensión tumoral. En la actualidad la ablación se ha incorporado a un amplio espectro de entidades clínicas, como tumores focales hepáticos, pulmonares, riñones, huesos, y glándulas suprarrenales.7
La motivación de esta investigación está dada por la ausencia de publicaciones relativas al tema en nuestro país. Se infiere por tanto que no se ha logrado insertar en el arsenal terapéutico cubano los beneficios de una terapia antitumoral mínimamente invasiva, efectiva y segura, que no resulta excesivamente costosa, y traería numerosos beneficios a pacientes oncológicos, no solo como terapia paliativa, en algunos casos con intención curativa. Se ofrecería una alternativa a pacientes en estadios medio y avanzados, incrementando no solo la sobrevida, sino también la calidad de vida, además se lograría una reducción significativa en gastos hospitalarios, algunos procederes se realizan de manera ambulatoria, con sedación local, existen bajas tasas de complicaciones, y aquellos que requieren ingreso, transcurre entre 24 y 48 horas en internamiento hospitalario.
El objetivo del artículo fue argumentar la necesidad del uso de las terapias ablativas tumorales percutáneas en Cuba mediante la revisión de su estado actual en el mundo.
Métodos
Se realizó una revisión bibliográfica descriptiva, entre los meses de noviembre del 2019 y febrero del 2020, sobre los métodos de ablación tumoral percutáneos existentes en la actualidad. Para la búsqueda de información se utilizaron las palabras clave ablación, radiofrecuencia, microondas, láser, crioablación, ultrasonido de alta intensidad y electroporación irreversible. Se revisaron las bases de datos Google Escolar, MEDLINE (Pubmed) y SciELO. Se seleccionaron artículos originales, artículos de revisión y libros publicados del 2002 al 2020, en español e inglés. De los 104 artículos revisados se excluyeron 73 porque estaban duplicados, en otros idiomas o los datos de origen eran insuficientes. Se descartaron las presentaciones en Power Point y se verificó que los 31 restantes fueran útiles para actualizar los conceptos relacionados con la ablación tumoral percutánea guiada por imágenes.
Desarrollo
Dada la multiplicidad de tipos de tratamiento y las amplias aplicaciones de las terapias ablativas en oncología, se hace necesario un entendimiento detallado de sus principios básicos y los avances más recientes para lograr un uso clínico efectivo.
El objetivo principal de la ablación tumoral percutánea, es erradicar completamente todas las células malignas viables dentro del tumor diana. Por lo general serán necesarias varias sesiones de tratamiento para lograr el objetivo deseado, incluso se podrán combinar diferentes técnicas como la embolización, entre otras.8
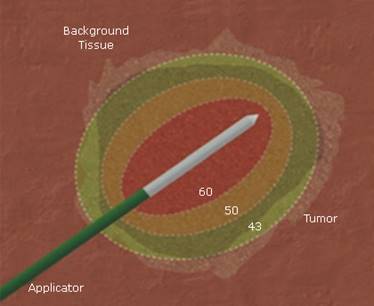
El calentamiento tisular en la ablación ocurre por 2 mecanismos específicos. Primero, un aplicador colocado en el centro del tumor libera una energía que interactúa con el tejido para generar un calor focal inmediatamente al rededor del mismo. Este mecanismo es similar para todos los dispositivos de ablación térmica, sin importar la fuente de energía utilizada. El segundo mecanismo la propiedad de conducción térmica de los tejidos. El calor generado al rededor del electrodo difunde a través del tumor y esto produce un incremento de temperatura aún mayor. La contribución de la conducción térmica en la ablación tisular está determinada por varios factores, así los patrones de calentamiento de los tejidos variarán según la fuente de energía específica utilizada. El resultado ideal debe ser la inducción de una necrosis por coagulación. El daño celular irreversible ocurre cuando las células son sometidas a temperaturas superiores a 46-48 °C durante 55 a 60 minutos, este se acelera según aumente la temperatura, y así la mayoría del tejido muere en pocos minutos con temperatura superior a los 50 °C (Fig. 1).
 Fuente: Ahmed y otros.9
Fuente: Ahmed y otros.9
Fig. 1 Representación esquemática de la ablación térmica focal. Se posiciona el electrodo dentro del tumor diana, y se aplica energía térmica. Esto crea una zona central de alta temperatura en el tejido adyacente al electrodo (>100 °C) y a su alrededor zonas de calentamiento tisular subletal (< 50 °C) y a continuación parénquima hepático normal.
Terapias ablativas
Durante los pasados 25 años numerosos métodos de destrucción tumoral química o térmica han sido desarrollados y probados clínicamente. Más recientemente una nueva forma de ablación, (ni química, ni térmica) la electroporación irreversible, se ha desarrollado y actualmente se encuentra en investigación clínica.
Ablación química
Los métodos de ablación química incluyen la inyección percutánea de etanol (PEI, por sus siglas en inglés) y la inyección percutánea de ácido acético (PAI, por sus siglas en inglés).
Inyección percutánea de etanol:
La PEI causa deshidratación y necrosis de las células tumorales, acompañado de trombosis de vasos finos, que se traduce en isquemia y destrucción tumoral. Generalmente la PEI se lleva a cabo bajo guía ultrasonográfica y son necesarias inyecciones múltiples de etanol, en una frecuencia de 2 a la semana hasta completar 6 a 8 sesiones, según el tamaño del tumor. Este tipo de terapia encuentra su mayor uso en el tratamiento del carcinoma hepatocelular y las metástasis hepáticas. Se puede obtener entre un 80 - 90 % de necrosis tumoral en lesiones no mayores de 3 o 4 cm de diámetro. Su mayor limitación es la alta tasa de recurrencia local que puede alcanzar un 33 % en lesiones menores de 3 cm y hasta un 43 % en aquellas que excedan los 3 cm. Ha sido reemplazada por otras modalidades de ablación, con mayor efectividad, como es el caso de la ablación por radiofrecuencia (RFA, por sus siglas en inglés), aunque permanece como alternativa terapéutica en pacientes sin criterio quirúrgico, particularmente en lesiones con localización desfavorable para la radiofrecuencia y para países en vías de desarrollo, donde la adquisición de modernas tecnologías se dificulta.10
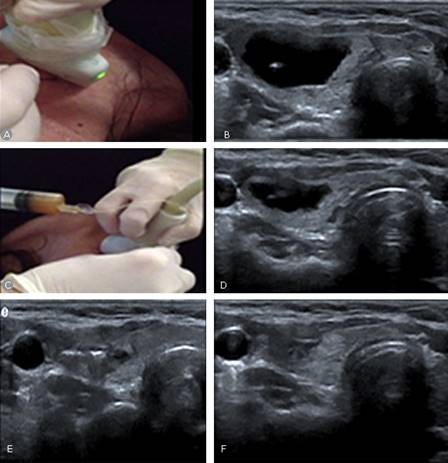
También se utiliza la PEI con muy buenos resultados en el tratamiento de nódulos tiroideos quísticos, sobre todo en pacientes sintomáticos, en los que constituye una alternativa atractiva a la cirugía11) (Fig. 2).
 Fuente: E. Papini y otros.12
Fuente: E. Papini y otros.12
Fig. 2 Inyección percutánea de etanol de un nódulo quístico del tiroides. Esta lesión había sido drenada en 2 ocasiones, con recaída total. (a y b): bajo guía ultrasonográfica se punciona la región central del quiste; (c y d): el componente líquido es evacuado casi en su totalidad; (e) bajo monitoreo ecográfico se administra lentamente etanol absoluto (95 %) en la cavidad residual; (f): ultrasonido de tiroides realizado a los 6 post ablación, donde se observa una pequeña área pseudonodular sin contenido líquido.
En los últimos años la PEI se ha empleado en la recurrencia local del cáncer de tiroides, aunque la cirugía es la primera opción de tratamiento, en casos de recurrencia confirmada, la reoperación puede ser técnicamente dificultosa, la radioterapia también puede considerarse aunque puede aumentar la morbilidad. Por tanto procederes ablativos guiados por imagen como la PEI o la RFA son una alternativa en aquellos con complicaciones post quirúrgicas, riesgo de complicaciones ante la radioterapia, o que se rehúsen a recibir irradiación externa, o con riesgo para una nueva cirugía.13
Otros agentes químico han sido eficazmente aplicados, entre ellos, el ácido acético, la doxiciclina, polidocanol, entre otros. Su ventaja radica en que, si bien es cierto que requieren de mayor número de sesiones de tratamiento, se asocian a menor tasa de complicaciones.14
Ablación térmica
Las terapias ablativas térmicas en la práctica clínica se pueden clasificar en tratamientos hipertérmicos, que incluyen la RFA, ablación por microondas (MWA, por sus siglas en inglés) y ablación por láser (LA, por sus siglas en inglés), ablación por ultrasonido focalizado de alta intensidad (HIFU, por sus siglas en inglés), y en el otro extremo tendríamos la crioablación (CA por sus siglas en inglés).14
Para una adecuada destrucción del tejido tumoral se debe someter a temperaturas citotóxicas a todo el volumen de la neoplasia, abarcando una margen de seguridad. Lo ideal es dejar un margen a 360 °C de 0,5-1 cm de grosor. Esto asegura la erradicación de una posible invasión local microscópica o peritumoral.14)
Ablación por radiofrecuencia
La RFA es la técnica más ampliamente usada a nivel mundial, en una extensa variedad de órganos afectados por enfermedad tumoral, benigna y/o maligna, su mayor aplicación la encuentra en el carcinoma hepatocelular. El advenimiento de la RFA ofreció mejor tasa de supervivencia y control de la enfermedad que la PEI, en la actualidad se considera como la primera línea de terapia ablativa, mientras que continúan en desarrollo otras como la MWA y la CA. Nuevas tecnologías como la IRE y la LA permanecen bajo investigación clínica para evaluar su eficacia.15,16,17
Técnicamente consiste en la aplicación de una corriente eléctrica alterna entre 460 - 500 kHz, mediante un electrodo de radiofrecuencia directamente dentro del tumor que retorna a través de una paleta a tierra que se pone en la superficie cutánea. El campo electromagnético inducido produce oscilación de los iones del tejido, así como calor por fricción, llevando a una necrosis por coagulación y muerte celular a temperaturas entre 60 - 100 °C.18
La eficacia del tratamiento con RFA está limitada por las características del tejido, cuando aumenta la impedancia se limita la zona de ablación y el fenómeno descrito como “dispersión del calor” en áreas cercanas ya que la transferencia de calor generada por el electrodo in vivo es contrarrestada por la perfusión vascular de alto flujo.7 Para mitigar estas limitaciones se han desarrollado varias estrategias como el uso de modo bipolar con múltiples electrodos y sistema de enfriamiento de electrodo. Importante resulta considerar los riesgos de la RFA en cuanto a la localización de las lesiones, se deben evitar aquellas demasiado cercanas a otras vísceras abdominales y las subcapsulares.19
Tumores en otros órganos también son susceptibles de recibir RFA. En riñones con hipernefromas menores de 3 cm, se aconseja la ablación térmica como alternativa a la cirugía convencional.20 Esta modalidad puede ser atractiva a los pacientes por varias razones, es mínimamente invasiva, permite una rápida recuperación, corta estadía hospitalaria, menores complicaciones y menor daño a la función renal.21
La progresión local de tumores primarios y metastásicos pulmonares posterior a terapias ablativas, principalmente la RFA y la MWA, se encuentra entre 0 - 34 %. El proceder es similar aunque al invadir los espacios pleurales parietal y visceral se produce un neumotórax de cuantía variable hasta en un 50 % de los pacientes. Se ha demostrado experimental y clínicamente que la MWA produce zonas ablativas más esféricas y amplias, en menor período de tiempo comparado a la RFA.22
Ablación por microondas
La MWA está considerada en la actualidad como una técnica ablativa emergente, una alternativa valiosa ante la RFA. Una ventaja importante de la MWA es que el resultado del tratamiento no se afecta por el flujo sanguíneo de vasos localizados cerca del tumor.8
La energía microondas es una forma de radiación electromagnética con frecuencias entre 0,3 - 300 GHz. Las antenas y generadores de la MWA son similares a los de la RFA, sin embargo, usan un espectro electromagnético diferente. En este sentido, se utilizan los aplicadores insertados en el tejido que funcionan como antenas para la transmisión de la energía aplicada, en frecuencias que oscilan entre los 915 - 2450 MHz, lo que causa un cambio en la polaridad de las partículas alrededor de 2 billones de veces por segundo, generando rotación polar en el tejido, este movimiento vigoroso de las moléculas de agua contra las fuerzas de fricción produce el calor en el tumor durante la MWA. Cuando la cantidad de calor generado alcanza niveles citotóxicos en el rango de los 50 - 100 °C, se produce la muerte celular y la necrosis por coagulación.22
Las potenciales ventajas de la MWA en relación con la RFA radican en una aumentada uniformidad en la producción de temperaturas intratumorales mayores, mejor perfil de convección del calor, y la capacidad de obtener efecto sinérgico con el uso de múltiples antenas, todo esto resulta en mayor volumen de ablación tumoral. Además la MWA se asocia a un acortamiento en el tiempo de tratamiento y disminución del dolor durante el proceder. La MWA no requiere el uso de almohadillas con función de tierra, lo que disminuye el tiempo de preparación del paciente y elimina el riesgo de producir al mismo quemaduras en piel. También la MWA es capaz de lograr zonas más amplias de calentamiento tisular que la RFA mediante el uso de antenas transmisoras que crean un campo extenso de aplicación de la energía que puede llegar a medir hasta 2 cm de radio a través de la misma antena y no por la conducción térmica, como ocurre en la RFA. En adición, como se mencionó previamente, la MWA es menos suceptible a la dispersión del calor de la sangre que fluye por los vasos sanguineos próximos al tumor.22
La tasa de éxito técnico para el hepatocarcinoma varía de 88 - 98 % y la supervivencia libre de progresión a los 3 años de 27 - 91,7 %. Este mismo criterio se aplica para las metástasis hepáticas.23
Los desafíos que supone esta modalidad emergente de terapia antitumoral para el futuro son los siguientes: la experiencia y los datos clínicos acumulados son mínimos; se requiere de una curva de aprendizaje en función de un uso seguro, dado por la posiblidad de realizar ablaciones más extensas; los sistemas clínicos son muy heterogéneos en términos de diseño de antena, longitud de onda, frecuencia, energía, y enfriamiento, lo que conlleva a diferentes resultados de rendimiento y crea confusión relacionada con la interpretación de los resultados clínicos y la predictibilidad de los resultados entre los diversos dispositivos existentes en el mercado.7
Otros tipos de terapias ablativas (no térmicas)
Crioablación
Con la CA se obtiene necrosis tisular mediante la inducción de temperaturas ultrafrías, con congelación del tejido resultando en una destrucción de las membranas celulares y subsecuente muerte celular.8
Para comprender el principio básico de funcionamiento de esta modalidad, se debe hacer alusión a varios principios físicos, como la Ley de Termodinámica, que explica cómo al liberar un gas contenido a alta presión hacia un área determinada con menor presión, este gas se expande y su temperatura baja, al expandirse el gas, aumenta la distancia entre sus moléculas, en contraposición a las fuerzas de Van der Waals, o fuerzas de atracción intermoleculares, se produce entonces un aumento en la energía potencial del gas, este aumento de la energía potencial lleva a un decrecimiento de la energía cinética del gas, lo que se manifiesta como una disminución de la temperatura. Según el principio del efecto Joule-Thompson, a través de la expansión isentálpica, un gas puede experimentar un aumento o descenso de su temperatura. Cada gas tiene un punto de inversión de temperatura Joule-Thompson específica, si se sobrepasa, la expansión produce aumento de la temperatura y por debajo, esta desciende. Para la mayoría de los gases, la temperatura ambiente está por debajo del punto de inversión, la expansión del gas produce descenso de temperatura. Otros gases, como el helio, hidrógeno y neón, presentan su punto de inversión de temperatura por debajo de la temperatura ambiente sufren calentamiento durante la expansión. Por tanto durante el proceso de CA, los tejidos sometidos alcanzan temperaturas ultrafrías, en el orden de los -160 °C, al permitir que el gas argón se expanda de altas presiones a bajas presiones a través del orificio pequeño (puerto de Joule-Thompson) de una criosonda. El helio, al tener un efecto contrario, se usa para calentar la sonda y permitir su remoción al finalizar el proceder.14
Entonces, durante el tratamiento de CA se implementa un ciclo altérnate de congelación-descongelación sobre el tumor, para inducir cambios osmóticos que resultan en una ruptura de la membrana celular con la eventual muerte celular. El proceso de muerte celular por CA puede ser explicado por cualquiera de las vías propuestas. Estas incluyen citolisis directa via formación de cristales de hielo intra y extracelulares, que causan desnaturalización de las proteínas, deshidratación intracelular y cambios en el pH, necrosis isquémica por daño vascular, edema celular y disrupción de vasos durante la fase de descongelación, o activación de la respuesta inmunitaria antitumoral e inducción de la apoptosis celular. En adición, el daño endotelial resultante en la CA induce la agregación plaquetaria y microtrombosis.14
La CA percutánea se puede realizar bajo guía ultrasonográfica, tomográfica o por resonancia magnética. Se usa un sistema de crioterapia a base de argón y aplicadores de 1,5 - 2,4 mm de diámetro. Cada criosonda está diseñada para obtener un radio predecible de congelación hasta 4,5 cm, sin embargo, el diámetro puede variar discretamente, según el tipo de tejido y estructuras vasculares adyacentes, que pudieran provocar un efecto de calentamiento local por la sangre circulante.14
Con esta terapia se logra obtener un volumen ablativo amplio, a través de la sumatoria de múltiples aplicadores, se asocia a menos dolor que la MWA y la RFA, lo que puede ser el resultado de un efecto analgésico térmico de nervios sensitivos cercanos. Además, la CA tiene la capacidad de preservar la red de colágeno y sobre todo la arquitectura celular del tejido tratado, por tanto, eliminando el tejido cicatrizal dentro del tejido tratado. Consecuentemente se evita el daño al tejido sano adyacente. A diferencia de la ablación térmica, el tejido tratado no se desnaturaliza, así que las células del organismo son capaces de reabsorber el tejido necrótico y no se crea una cavidad por la ablación. La visualización por métodos de imagen de la llamada “bola de hielo” en dentro del tejido tratado permite un monitoreo más efectivo de los márgenes expansivos de la zona de ablación y minimiza el daño inadvertido de las áreas adyacentes sanas.14
Aunque la experiencia de tratamiento es actualmente limitada en tumores de cabeza y cuello, los sistemas de crioterapia percutánea han sido empleados extensamente en el tratamiento de tumores sólidos de hígado, riñones y pulmones.14
Ablación por láser
La ablación por láser (AL) es otro de los métodos para inducir necrosis por coagulación en zonas focales de tejido, a través de una muerte celular inducida térmicamente. Actualmente tiene múltiples aplicaciones de uso en una variedad de órganos.14
La técnica involucra la colocación percutánea, guiada por imágenes de pequeñas agujas en el tejido diana, a través de las cuales se insertan una serie de finas fibras ópticas. Una fuente de energía láser de baja intensidad se acopla a estos cables de fibra óptica para liberar energía en el tumor, la que causa una acumulación local de calor al rededor de las puntas de los cables. Se pueden alcanzar temperaturas tisulares locales muy elevadas lo que resulta en desnaturalización de proteínas y muerte celular.24
La AL es capaz de crear regiones bien definidas de necrosis por coagulación localmente alrededor del aplicador de fibra óptica provocando un mínimo daño sobre tejidos vecinos. Los sistemas percutáneos disponibles hoy día que operan en tejidos profundos usan una fuente de láser estándar tal como el neodymium-yttrium-aluminum-garnet (Nd:YAG), erbium, o holmium, capaces de producir luz láser con longitud de ondas entre 680-1060 nm. Sobre las puntas de la fibra óptica, se montan aplicadores difusores especiales y son rodeados de un domo de vidrio protector que sirven para difundir el láser uniformemente dentro del tejido diana a distancias efectivas entre 12 - 15 mm de la punta del aplicador. Las casas comerciales han desarrollado puntas de aplicadores que usan fibra óptica de diversa composición, longitud y diámetro para alterar el tamaño del área ablativa durante el proceder.24
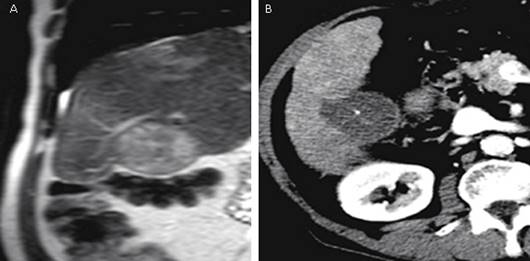
Al igual que las demás terapias ablativas percutáneas pueden ser guiadas por varios métodos de imagen, sin embargo, en el caso específico de la LA se prefiere la guía de la resonancia magnética, por su superior capacidad para visualizar los cambios de temperatura del tejido durante el proceder con el uso de técnicas especializadas de termometría por gradiente de eco. Debido a que la temperatura del tejido citotóxico se asemeja con la extensión de la necrosis por coagulación por la LA, la técnica de termometría por resonancia permite la localización más precisa de los márgenes de la zona de ablación24) (Fig. 3).
 Fuente: Pacella CM.25
Fuente: Pacella CM.25
Fig. 3 Tomografía computarizada de un nódulo hepático exofítico de 30 mm adyacente al colon. (a): antes de la LA y (b): después de la LA usando 4 fibras de 300 µm.
Para el uso de la tecnología láser en las terapias ablativas se recomiendan una serie de medidas de protección tanto para el operador, como para el paciente. Se sugiere el uso, en todo momento de lentes protectores para todo el personal de salud dentro del local de tratamiento, así como para el paciente, para prevenir la exposición de la córnea y la conjuntiva de la potencialmente dañina dispersión de rayos láser. La cara del paciente, así como otras superficies corporales expuestas deben ser protegidas de igual manera, y deben usarse ropajes humedecidos o no inflamables durante el proceder para evitar quemaduras por contacto o incendios si ocurriese una exposición accidental. Así mismo se debe evitar el uso de antisépticos, anestésicos y gases médicos potencialmente inflamables durante la LA.24.
En relación con el resto de terapias ablativas percutáneas, la LA permanece pobremente estudiada. Lou y otros26) encontraron mayor recurrencia tumoral, menor supervivencia global y ablación completa en la LA vs RFA, aunque estos resultados no fueron estadísticamente significativos.
Ablación por ultrasonido focalizado de alta intensidad
Este es el único medio de terapia ablativa instalado y disponible en Cuba, desde el año 2013, el cual se encuentra en el Centro de Investigaciones Médico Quirúrgicas. Hasta la fecha actual se ha realizado tratamiento de tumores hepáticos, pancreáticos, renales, de mamas, y uterinos, aunque no se dispone aún de reporte en la literatura sobre evaluación de resultados obtenidos.
El ultrasonido focalizado de alta intensidad es un procedimiento médico que consiste en la aplicación de un haz de ultrasonido de alta frecuencia y alta energía para producir destrucción celular o necrosis de las células objetivo por elevación de la temperatura entre 55 - 100 ºC. Con la particularidad de que los tejidos colindantes no quedan afectados. La destrucción celular se produce muy selectivamente y con forma ovalada, en los transductores más avanzados el volumen del foco llega ser de 2x2x15 mm3. Se aplica para tratamiento de tumores sólidos benignos y malignos.27
El origen del HIFU no es reciente, se remonta a los años 1950 en los Estados Unidos de América, donde empezaron las primeras investigaciones por parte de Lindstrom y los hermanos Fry en cerebros de animales. Fue posteriormente cuando algunos discípulos chinos, de los investigadores americanos se situaron al frente de las investigaciones de esta tecnología hasta llegar, a principios de los años 1990, al uso clínico en pacientes.28
El objetivo de los sistemas HIFU es elevar la temperatura del punto a tratar por encima de 55 - 60 ºC, para producir necrosis coagulativa y la inmediata muerte celular. Se utiliza ultrasonidos de alta frecuencia y alta potencia con el haz enfocado en un solo punto focal. Los ultrasonidos generan calor como resultado de agitación microscópica al atravesar los diferentes tejidos. Por lo tanto, la energía mecánica de la onda ultrasónica es absorbida como energía calorífica. Además de este efecto principal existen otros efectos biológicos y mecánicos secundarios que participa en la necrosis coagulativa, fundamentalmente la cavitación, la apoptosis y la propagación no lineal de ultrasonido.28
La cavitación se puede definir como la creación de gas en un campo acústico, como por ejemplo el movimiento oscilatorio de una burbuja de aire dentro de un medio líquido al exponerla a un campo acústico. Con la suficiente compresión y expansión del tejido se obtienen burbujas de aire. Estas burbujas de aire interactúan con el ultrasonido produciendo un flujo líquido que puede dañar superficies sólidas. La terapia con HIFU puede producir muerte celular por lesión directa de ADN, que de hecho es el mecanismo primario de muerte celular por hipertermia. Los efectos no lineales de ultrasonido se deben a la modificación de la onda de ultrasonidos dentro del tejido por su heterogeneidad y contribuye al aumento de temperatura.28
Existen básicamente 2 tipos el sistema de guiado: - HIFU Guiado por resonancia magnética (MRgFUS por sus siglas en inglés) - HIFU guiado por ultrasonidos o ecógrafo (USgFUS por sus siglas en inglés). HIFU guiado por resonancia permite una imagen más clara de la zona a trata del paciente, pero no permite visualización a tiempo real. Con lo que los posibles movimientos del paciente podrían perjudicar al tratamiento. Se monitoriza los cambios de temperatura de los tejidos para determinar los efectos de HIFU. El transductor de tratamiento tiene poca movilidad debido a su integración con la máquina de resonancia magnética. Se necesita una sala acondicionada especialmente para resonancias magnéticas. HIFU guiado por ultrasonidos o ecógrafo permite una exploración en tiempo real y se observa los cambios en los tejidos mediante cambios en la escala de grises de la imagen ecográfica. La instalación de la máquina USgFUS es la de una sala convencional.28
Las indicaciones de la terapia HIFU son numerosas y muchas más queda a la espera de ser investigadas:29
Fibromas uterinos.
Fibroadenomas de mama.
Cáncer de hígado.
Metástasis.
Tumores óseos (tratables solo si el oseosarcoma rompe la cortical).
Cáncer de riñón.
Cáncer de páncreas.
Cáncer de mama.
Tumores de partes blandas.
Carcinoma de vejiga.
Tumores en la cavidad pélvica.
Tumor retro-peritoneal.
Tratamiento paliativo para cánceres avanzados.
Tumores residuales.
Tumores de próstata.
Las principales limitaciones incluyen: proceso más lento cuando se trata tumores de mayores dimensiones; posible limitación de tratamiento por la posición del tumor y el camino por donde pasa el ultrasonido (existe técnicas que reduce esa posibilidad); posible ligeras quemaduras en la piel (no se produce en > 95 % casos) pero evitables con el correcto seguimiento médico.29
Electroporación irreversible
La IRE es una técnica en la que se incrementa la permeabilidad de la membrana cellular, ya que cambia el potencial el potencial transmembrana, provocando una disrupción de la integridad de la barrera lipídica, esto facilita el paso de moléculas a través de la membrana celular mediante los nano poros.30
En la IRE, este mecanismo se produce de forma irreversible, llevando a la muerte celular. El sistema de IRE (NanoKnife, AngioDynamics, Queensbury, NY) consta de 2 componentes principales, un generador, y sondas eléctricas con forma de agujas. El generador puede liberar hasta 3000 V, el electrodo tiene un diámetro de 19 gauge con una punta activa que puede ser expuesta hasta 4 cm. Dos o más sondas monopolares o una sola bipolar pueden ser usadas cada vez. El número de sondas monopolares dependerá del tipo y el tamaño del tejido que será tratado. El nivel de voltaje se determina con relación a la distancia entre los electrodos dentro del tumor diana. La IRE se realiza bajo anestesia general, y debe administrarse atracurio, cis-atracurio, pancuronio o un bloqueador neuromuscular equivalente, para prevenir contracciones musculares no deseadas.30
La IRE crea una barrera bien definida entre el área tratada y el tejido sano. Esto sugiere que este tratamiento tiene la habilidad de delinear claramente zona ablativa del tejido no tratado. Adicionalmente la IRE puede crear de manera efectiva muerte tisular en un rango de tiempo de micro a milisegundos, en comparación a las terapias termoablativas, que requieren de 20 minutos hasta horas. Además, como la IRE es una técnica no térmica, existe una ablación completa de los márgenes vasculares sin compromiso de su funcionalidad. Debido a esto, los problemas relacionados con el enfriamiento o calentamiento tisular mediado por la perfusión sanguínea, son irrelevantes.31
No obstante la IRE ha sido empleada por décadas, se considera que aún es un campo emergente en cuanto a aplicaciones clínicas. Hasta la fecha, solo algunas series de casos sobre la eficacia de la IRE en tumores hepáticos. Todos concluyen que la eficacia ablativa tumoral es prometedora, especialmente en aquellas lesiones menores de 5 cm.31
Consideraciones finales
La ablación percutánea tumoral guiada por imágenes se convierte cada vez en una modalidad terapéutica más aceptada en el tratamiento de tumores benignos y malignos en una variedad de órganos. Sin embargo, con el espectro tan amplio de técnicas ablativas que existe en la actualidad, se ha generado una confusión con relación a qué dispositivo usar para tratar qué tipo de tumor. En general se prefiere el uso de MWA para tumores de hígado, periferia de riñón, y pulmón. El uso de cualquier modalidad ablativa que involucre calentamiento del tejido en el pulmón se asocia a neumotórax prolongado o fístulas broncopleurales y por tanto se debe evitar la cauterización del trayecto del electrodo y la punción directa de tumores periféricos. La RFA tiene limitaciones evidentes en relación con la MWA en cuanto al calentamiento tisular y, por consiguiente, se reserva para el tratamiento de lesiones óseas, y otras situaciones que requieran zonas de ablación no extensas. Se preconiza el uso de la CA para tratar tumores renales centrales debido al riesgo potencial de dañar el sistema excretor y el uréter, aunque esto puede variar en dependencia de cada intervencionista. La CA también puede ser útil en algunos tipos de tumores pulmonares, cercanos a la pared torácica y al mediastino, y para algunos tumores del sistema músculo esquelético, en los cuales se busca el tratamiento paliativo del dolor.7
Cuba es un país con serias dificultades económicas, y en este sentido el bloque económico estadounidense ha sido determinante. Sin embargo, el estado ha hecho de la atención sanitaria una prioridad en su gestión, y los índices de salud existentes en la Isla hoy día, dan fe de ello. En el país se cuenta con altas tecnologías en prácticamente todos los frentes, con prioridad establecida en los cuidados y atención al paciente oncológico. Cada año se invierten cifras millonarias, en moneda libremente convertible, y no se escatiman gastos, incluso cuando estos servicios especializados se ofrecen a la población de manera gratuita.
Sin embargo, en relación con el tema abordado en esta investigación, que creemos posee una gran relevancia y a pesar de ser una modalidad bien establecida, con beneficios palpables y con más de 30 años de existencia, no se ha logrado en el país otorgar a las terapias ablativas el lugar que le corresponde en la cadena de opciones terapéuticas en oncología. Si bien es cierto que las últimas tecnologías desarrolladas son muy costosas y requieren de instrumentación y condiciones especiales para su implementación, otras como la ablación química con etanol o ácido acético, la ablación térmica por radiofrecuencia o microondas, son opciones asequibles y reutilizables, que sin dudas han demostrado clínicamente un aumento en la sobrevida global de pacientes con tumores irresecables, llegando a tener hoy día, criterio curativo en determinados tipos de neoplasias. Por tanto, los autores de esta investigación, pretendemos hacer un llamado de atención y sugerimos reevaluar la posibilidad de aumentar nuestro arsenal terapéutico con la incorporación permanente de la ablación percutánea tumoral y continuar ofreciendo una atención a nuestros pacientes con mayor calidad.
La amplia gama de terapias ablativas percutáneas existentes en la actualidad que van desde la ablación con etanol, la radiofrecuencia, microondas, crioablación, láser, ultrasonidos de alta frecuencia hasta la electroporación irreversible, han demostrado ser efectivas y seguras, ganando cada día más adeptos. Es una alternativa eficaz en el tratamiento de tumores irresecables, de forma paliativa y curativa. Se debe realizar una evaluación personalizada, por un equipo multidisciplinario, según el tipo, tamaño y localización del tumor, para seleccionar la modalidad más efectiva. No existe evidencia del uso de las terapias ablativas tumorales percutáneas en nuestro país, el único medio con que se cuenta es un ultrasonido de alta intensidad, sin resultados clínicos publicados. Los pacientes oncológicos cubanos con tumores no resecables, podrían beneficiarse de técnicas como la ablación con etanol, ácido acético, radiofrecuencia o microondas.














