Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Endocrinología
versão On-line ISSN 1561-2953
Rev Cubana Endocrinol vol.25 no.3 Ciudad de la Habana set.-dez. 2014
TRATAMIENTO
Síndrome de deprivación glucocorticoidea
Glucocorticoid deprivation syndrome
MSc. Cossette Díaz Socorro, MSc. Silvia Elena Turcios Tristá, MSc. Erick Robles Torres, Dra. Yudit García García
Instituto Nacional de Endocrinología (INEN). La Habana, Cuba.
RESUMEN
El síndrome de deprivación glucocorticoidea se manifiesta en pacientes con hipercortisolismo endógeno después de la cirugía, y en individuos que han recibido tratamientos con dosis elevadas de glucocorticoides por más de 2 semanas. El eje hipotálamo-hipófiso-adrenocortical regula la secreción diaria de cortisol y presenta un ritmo circadiano. El ritmo puede perderse por estrés, enfermedad, o por la administración farmacológica de glucocorticoides. La retirada de corticoides puede causar insuficiencia adrenal secundaria, síndrome de retirada o deprivación de corticoides, y reactivación de la enfermedad de base para la cual fueron indicados. La insuficiencia adrenal secundaria es la complicación más temida, y constituye la principal causa de crisis adrenal e insuficiencia adrenal secundaria en la actualidad. El síndrome de retirada o deprivación de corticoides es autolimitado, y puede ser tratado fácilmente con el incremento temporal de la dosis de corticoide, seguido por una retirada lenta de este. Es necesario conocer las ventajas y limitaciones que trae aparejado el tratamiento con glucocorticoides, así como su descontinuación gradual. Debe evaluarse adecuadamente el estado del eje hipotálamo-hipófiso-adrenocortical al término del tratamiento prolongado, o con dosis suprafisiológicas de glucocorticoides.
Palabras clave: síndrome de deprivación glucocorticoidea, eje hipotálamo-hipófiso-adrenocortical, glucocorticoides.
ABSTRACT
Glucocorticoid deprivation syndrome occurs in patients with endogenous hypercortisolism after surgery and in individuals receiving treatments at high doses of glucocorticoids for more than 2 weeks. The hypothalamus-hypophysis-adrenocortical axis regulates the daily cortisol secretion and presents a Circadian rhythm that may be affected by stress, disease or glucocorticoid administration The corticoid withdrawal may cause secondary adrenal insufficiency, corticoid deprivation or withdrawal syndrome and reactivation of the underlying disease for which they were prescribed. The secondary adrenal insufficiency is currently the most serious complication and the main reason for adrenal crisis and secondary adrenal insufficiency. The corticoid deprivation or withdrawal syndrome is self-limited and may be easily treated with temporary increase of the corticoid dose, followed by slow withdrawal of this agent. It is then necessary to find out the advantages and limitations of the glucocorticosteroid treatment and its gradual cessation. The state of the hypothalamus-hypophysis-adrenocortical axis should be adequately evaluated at the end of a long treatment, or with the use of supraphysiological doses of glucocorticoids.
Keywords: glucocorticoid deprivation syndrome, hyphothalamus-hyphophysis-adrecortical axis, glucocorticoids.
INTRODUCCIÓN
El síndrome de deprivación glucocortioidea, también denominado síndrome de retiro de glucocorticoides, puede aparecer en pacientes con hipercortisolismo endógeno después de la cirugía adrenal o hipofisaria, y en aquellos que han recibido tratamiento con dosis elevadas de glucocorticoides por más de 2 semanas. En estas situaciones, el enfermo ha estado expuesto a concentraciones elevadas de cortisol u hormona sintética similar, y al disminuir bruscamente los niveles de estas hormonas, presentan manifestaciones de insuficiencia adrenal.1
La presencia de síntomas, en el síndrome de retiro de glucocorticoides, no siempre depende de la ausencia relativa de cortisol en la circulación periférica, podrían estar presentes también, con niveles de cortisolemia aparentemente normales y durante el remplazo con hidrocortisona. Se plantea la hipótesis de una tolerancia individual a los cambios de la cortisolemia.1
DESARROLLO
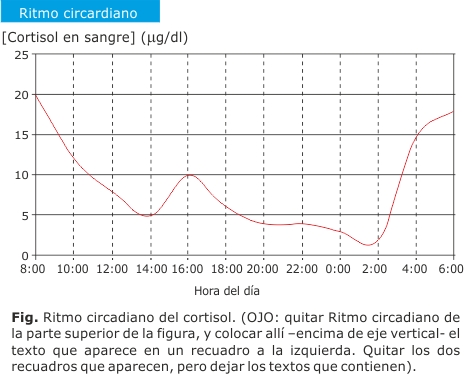
El eje hipotálamo-hipófiso-adrenocortical (HHA) regula la secreción diaria de cortisol. La hormona liberadora de corticotropina (CRH) es secretada por el hipotálamo, y estimula la secreción de la hormona adrenocorticotropa (ACTH) en la hipófisis, que a su vez, estimula la secreción de cortisol por la glándula adrenal.2,3 Este eje hormonal presenta un ritmo circadiano, y su regulador más potente es el ciclo día/noche (figura).4
El ritmo normal del eje HHA puede perderse por estrés, enfermedad, o por la administración farmacológica de glucocorticoides,5 drogas que son utilizadas con frecuencia en diversas situaciones clínicas, por sus efectos antiinflamatorios e inmunomoduladores.2
Los síndromes asociados a la retirada de corticoides aparecen por el empleo de dosis altas de corticoides, o ante una disminución rápida o retirada brusca de la corticoterapia prolongada. Esta situación puede causar 3 problemas: insuficiencia adrenal secundaria, síndrome de retirada o deprivación de corticoides y la reactivación de la enfermedad de base, para la cual fueron indicados.6
La insuficiencia adrenal secundaria es la complicación más temida, y se produce por supresión del eje HHA. Recientes reportes indican que la retirada incorrecta de corticoides en pacientes con uso prolongado de estos, constituye la principal causa de crisis adrenal e insuficiencia adrenal secundaria.6,7
Clásicamente se considera que la cantidad normal secretada de cortisol es de 12 a 30 mg por día (lo que equivale a una dosis de 3 a 7,5 mg de prednisona). Recientemente se ha sugerido una secreción diaria algo menor: unos 10 mg (el equivalente a 2,5 mg de prednisona). Esta producción de cortisol puede aumentar hasta 10 veces en situaciones de estrés.
Las dosis de corticoides pueden ser clasificadas en fisiológicas (igual a la cantidad secretada diaria) y suprafisiológicas (mayor de 0,1 mg/kg de prednisona). Luego de la suspensión brusca de dosis suprafisiológicas, durante un tiempo prolongado, el eje no es capaz de responder ante situaciones especiales aumentando la secreción de cortisol. La dosis mínima, el intervalo de las dosis y la duración de la terapia necesaria para suprimir el eje, no son del todo conocidas; esta supresión puede durar hasta un año.2 Los valores de ACTH pueden recuperarse y ser supranormales, mientras que el cortisol sérico puede permanecer subnormal4 (tabla 1).
Existe una amplia variabilidad individual entre las dosis necesarias para suprimir el eje. No obstante, se sabe que una dosis de más de 30 mg de hidrocortisona al día (o sus equivalentes: 0,75 mg de dexametasona o 7,5 mg de prednisona) administrada durante más de 2 o 3 semanas, puede suprimir el eje HHA. Este efecto es más frecuente si el fármaco se administra en la noche. En los pacientes con síndrome de Cushing exógeno, debe asumirse que existe una supresión del eje. En los niños se deben extremar las precauciones, ya que el eje se suprime en aquellos que reciben más de 0,075 mg/m2 de prednisona al día, o más de 0,3 mg/m2 de hidrocortisona/día. 4
Cuando el médico sospecha la supresión del eje suprarrenal, puede elegir entre:2
- Tratar al paciente como si la insuficiencia suprarrenal fuera una certeza (glucocorticoides y educación).
- Realizar una prueba de estimulación con ACTH.
El test de estimulación con ACTH mide directamente la integridad funcional de las glándulas suprarrenales, e indirectamente la función del eje HHA.7 Se considera normal si los valores de cortisolemia después de 30 minutos de estimulación con ACTH, sobrepasan los 496,6 nmol/L o 18 µg/dL.1,7
La prueba tiene buena sensibilidad para la detección de la insuficiencia suprarrenal primaria, pero no para la insuficiencia de causa secundaria, pues en esta última tiene mayor fiabilidad la respuesta del cortisol a la hipoglucemia insulínica o el test de metopirona. A pesar de esto, por la ausencia de efectos adversos y la comodidad de su realización, el test de ACTH es el más utilizado. En los últimos años se ha propuesto una modificación de este, con el empleo de dosis bajas de ACTH (1 mg), que tiene la ventaja de permitir el diagnóstico de insuficiencias parciales, que pueden quedar enmascaradas con la dosis convencional. Una respuesta inferior a 16 µg/dL diagnostica una insuficiencia suprarrenal, mientras que una respuesta superior a 22 µg/dL la descarta.7
El gold standard para la evaluación del eje HHA es la respuesta a la hipoglucemia insulínica. Otras pruebas diagnósticas que han sido empleadas con este fin son el test de glucagón, el de metopirona y el de CRH.4
Sí ndrome de retirada o deprivación de corticoides
Al conjunto de síntomas y signos que aparecen cuando el paciente no consigue tolerar la retirada de glucocorticoides, ante la ausencia de enfermedad subyacente para la cual fueron indicados estos medicamentos, y con un eje HHA no suprimido, se considera como un síndrome de retirada de corticoides. El cuadro clínico se caracteriza por una dependencia física y psíquica. La dependencia física se manifiesta por anorexia, náuseas, vómitos, pérdida de peso, astenia, cefalea, mialgias, artralgias, hipotensión postural, taquicardia, fiebre y descamación de la piel. La dependencia psicológica se caracteriza por varios grados de efectos psicológicos adversos, entre los que se citan los cambios de humor y la labilidad emocional, como las manifestaciones más comunes, seguidas por el delirio y los estados psicóticos.6
Los mecanismos causales de este síndrome aún son inciertos. Los investigadores plantean que el síndrome puede estar relacionado con algunos mediadores incluyendo CRH, vasopresina, propiomelanocortina, citocinas (interleucina 1 y 6, factor de necrosis tumoral alfa), prostaglandinas (fosfolipasa A2) y con modificaciones de los sistemas noradrenérgico y dopaminérgico.6
El diagnóstico se establece por la demostración de la integridad del eje HHA ante la presencia de síntomas que sugieren insuficiencia adrenal. Este síndrome es autolimitado, con una duración que varía de 6 a 10 meses, y puede ser tratado fácilmente con el incremento temporal de la dosis de corticoide, seguido por una retirada lenta de este.6
Prevención del síndrome de deprivación glucocorticoidea
La forma de prevenir la presentación de este síndrome incluye la disminución gradual de las drogas glucocorticoideas en pacientes con más de 2 semanas de tratamiento. En enfermos con hipercortisolismo endógeno, se sugiere normalizar las concentraciones de cortisol con tratamiento médico, antes de la cirugía, para suprimir la esteroidogénesis; así como también, evitar el tratamiento posquirúrgico con glucocorticoides de forma prolongada e innecesaria.1,8
Aspectos a tener en cuenta en el tratamiento con glucocorticoides4
- Objetivos del tratamiento: sustituir la función suprarrenal fisiológica o lograr el efecto terapéutico (suprimir la ACTH, acción antiinflamatoria o acción inmunosupresora).
- Elección del corticoide que se quiere administrar (tabla 2), respetando el principio de emplear la mínima dosis necesaria durante el menor tiempo posible. Los aspectos a considerar son: la potencia del preparado y duración de su acción, efectos glucocorticoide y mineralcorticoide, vía de administración, tiempo de tratamiento (agudo o crónico), cadencia o pauta de administración, dosis a emplear y momento del día.
- Efectos secundarios (locales o sistémicos) que se van a provocar durante el tratamiento.
- Evaluación de la eficacia del tratamiento: el fármaco debe suspenderse si no se alcanza el objetivo terapéutico, si aparecen complicaciones, o si se ha alcanzado el máximo beneficio.
- Evaluación de la integridad del eje HHA inmediatamente después de retirar el fármaco: en los casos en que se haya suprimido la función fisiológica, se pautará el tratamiento sustitutivo.
Vías de administración: los corticoides pueden ser administrados por vía sistémica (oral, endovenosa e intramuscular), y por vía local (intrarticular, tópica e inhalada).4
Corticoides tópicos: la aplicación de corticoides cutáneos pueden además de suprimir el eje, causar un síndrome de Cushing. 4 El clobetasol-17-dipropionato, preparado de más alta potencia que existe actualmente en el mercado, es el corticoide que con mayor frecuencia aparece asociado en la literatura, a efectos adversos secundarios sistémicos.9
Se describen múltiples factores que incrementan el riesgo de efectos secundarios de los corticosteroides tópicos. Los tratamientos prolongados y de forma continua, los corticosteroides de potencia alta o muy alta, la aplicación en la piel que tiene menor grosor (escrotos, axilas, ingles, párpados) y la de mayor vascularización (cara y cuero cabelludo), la extensión en grandes zonas, la edad del paciente (niños y ancianos), la oclusión terapéutica o la inducida por la ropa, la piel enferma, y los excipientes no grasos.10
Corticoides inhalados: varias preparaciones de esteroides artificiales han mostrado su eficacia como broncodilatadores cuando se administran inhalados. No obstante, está bien documentado que los corticoides inhalados llegan a suprimir el eje HHA, especialmente el tratamiento con fluticasona, y pueden llegar a provocar un síndrome de Cushing. Estos efectos secundarios, en ocasiones, pueden revertirse, si se suspende el tratamiento con fluticasona y se inicia con budesonida.4
Posiblemente la supresión suprarrenal sea uno de los mejores marcadores de los efectos sistémicos de los corticoides inhalados. Tras la administración de 250 y 500 µg de fluticasona, 2 veces al día, los niveles de cortisol sérico fueron 10 y 21 % menores, respectivamente, que en el grupo placebo, lo cual indica un incremento de los efectos sistémicos con dosis elevadas.11
Descontinuación de la terapia
Entre las causas de suspensión del tratamiento con glucocorticoides, se encuentran los pacientes con: diabetes mellitus de difícil control, hipertensión arterial severa, osteoporosis invalidante, seudotumor cerebral, inhibición del crecimiento, psicosis inducida por esteroide, úlcera péptica, y exacerbación de la queratitis herpética (menos común).6 Cuando está indicado suspender el tratamiento, se pueden seguir varios esquemas:2
Terapia en días alternos: reducir la dosis 5 mg de prednisona o su equivalente cada 1 a 2 semanas, hasta suspender, o hasta llegar a una dosis fisiológica (5 mg de prednisona) y cambiar a 20 mg de hidrocortisona por día. Luego de 2 a 4 semanas, reducir la dosis 2,5 mg por semana hasta llegar a 10 mg, momento en el cual se podría hacer una prueba de ACTH, y si es normal, se suspende el tratamiento.
Terapia diaria: con el mismo esquema de la alternativa anterior, pero con una reducción inicial menor (2,5 mg por semana de prednisona o su equivalente). Cuando la dosis es mayor de 40 mg de prednisona, se recomienda disminuir 10 mg de la dosis cada 1 a 3 semanas. Si la dosis inicial es menor de 40 mg, reducir 5 mg por semana, y a continuación se seguirá con el esquema anterior.
Si en este período el enfermo sufre un estrés agudo, puede necesitar un suplemento mayor de corticoides.2 Todo paciente que haya recibido tratamiento prolongado o con dosis elevadas, debe ser considerado de riesgo hasta 1 año después del retiro de la corticoterapia. 6
Por más de 60 años los corticoides han sido empleados para diversas enfermedades. Llegaron y se establecieron definitivamente en la práctica médica. En todos estos años el empleo de los corticoides ha pasado por una “ciclotimia” periódica entre la “panacea” y la “encarnación del mal”, pero teniendo en cuenta la experiencia clínica acumulada, puede lograrse su uso correcto.5
Se concluye que es importante identificar los pacientes con riesgo de presentar un síndrome de deprivación glucocorticoidea, con el objetivo de prevenir su aparición y orientar el tratamiento oportuno. La terapia con glucocorticoides debe indicarse si existe un beneficio evidente, y suspenderse, si no se alcanza la respuesta deseada o aparecieran efectos adversos. Es necesario conocer las ventajas y limitaciones que trae aparejado este tratamiento, así como su descontinuación gradual. Debe evaluarse adecuadamente el estado del eje HHA al término del tratamiento prolongado, o con dosis suprafisiológicas.
REFERENCIAS BIBLIOGRÁFICAS
1- Hernández JA, Jorge R. Trastornos de la glándula hipofisaria. La Habana: Editorial Ciencias Médicas; 2010. p. 54-6.
2- Botargues M, Enz P, Musso C. Tratamiento con corticoides. Evid Act Pract Ambul. 2011;14(1):33-6.
3- Chung S, Gi S, Kyungjin K. Circadian rhythm of adrenal glucocorticoid: its regulation and clinical implications. Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease. 2011;(1812.5):581-91.
4- Galofré J. Manejo de los corticoides en la práctica clínica. Rev Med Univ Navarra. 2009;53(1):9-18.
5- Serra HA, Roganovich JM, Rizzo LF. Glucocorticoides: de lo molecular al uso clínico. MEDICINA (Buenos Aires). 2012;72:158-70.
6- Alves C, Robazzi TC, Mendonça M. Withdrawal from glucocorticosteroid therapy: clinical practice recommendations. J Pediatr (Rio J). 2008;84(3):192-202.
7- Rica I, Grau G, Vela A. Insuficiencia suprarrenal. Protoc Diagn Ter Pediatr. 2011;1:166-76.
8- Pérez Corral B, Aguado Matilla R, Álvarez San Martín RM, Ballesteros Pomar MD, Roiz V, Cano Rodríguez I. Síndrome de supresión de corticoides. Endocrinol Nutr. 2007;54(7):395-7.
9- Casado-Verrier B, Sanz-Canalejas L, Gómez-Fernández C, Pagán B, López M, Casado-Jiménez M. Síndrome de Cushing iatrogénico por corticoides tópicos en dos adultos. Med Cutan Iber Lat Am. 2012;40(2):58-61.
10- Alejandre Lázaro G, Moreno García F. Corticosteroides tópicos. Inf Ter Sist Nac Salud. 2010;34:83-8.
11- Izquierdo Alonso JL, Rodríguez Glez-Moro JM. Utilización excesiva de corticoides inhalados en la enfermedad pulmonar obstructiva crónica. Arch Bronconeumol. 2012;48(6):207-12.
Recibido: 18 de junio de 2014.
Aprobado: 5 de octubre de 2014.
Cossette Díaz Socorro. Instituto Nacional de Endocrinología (INEN). Calle Zapata y D, Vedado, municipio Plaza de la Revolución. La Habana, Cuba. Correo electrónico: cossettediaz@infomed.sld.cu