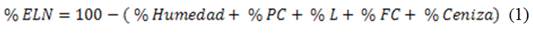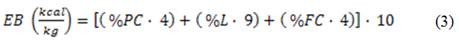Introducción
Ricinus communis linn, también conocida como higuerilla, ricino, higuereta, palma cristi, castor o tártago entre otros muchos vocablos, es una planta arbustiva perenne de la familia Euphorbiaceae. Es de origen tropical y procede del norte de África, alrededor de Etiopía, sin embargo, se ha naturalizado en diversas áreas tropicales y subtropicales en todo el mundo por su rusticidad y fácil adaptabilidad a diversas condiciones ambientales, convirtiéndose en una maleza invasora tanto en áreas urbanas como agrícolas.1
En México, esta planta se encuentra de manera silvestre en diversas regiones del país;2 se adapta a zonas marginales, tiene bajos requerimientos de agua, presenta una disposición de riqueza genética para selección de variedades y no compite con la alimentación humana.1 Además, contiene varios compuestos nutricionales como proteínas, carbohidratos, minerales y otros compuestos bioactivos que le confieren diversas propiedades benéficas para la salud, ya sea como agente antioxidante, hepatoprotector, antimicrobiano, anticonceptivo, diurético, anticancerígeno o actividad antifertilidad.3-6 También contiene algunos compuestos tóxicos y alergénicos como la ricina y la ricinina, que se encuentran principalmente en la semilla (1-5 %) 3) y que pueden ser desactivados con calor (50-121°C, 60 min, pH 7,8) y en álcalis fuertes.5,6
Sin embargo, el uso más común de la Ricinus communis es para la extracción del aceite de ricino presente, principalmente, en la semilla, cuyo contenido puede oscilar entre 12,20-64,84 %.1-3 Este aceite es muy utilizado a nivel industrial para producir lubricantes, cosméticos o para aplicaciones médicas.3,5
Por otro lado, la torta obtenida después de la extracción del aceite y previa desintoxicación, tambien ha sido aprovechada para complementar la alimentación animal destinada, por ejemplo, a las raciones de ovejas, vacas, pollos y peces, 7 mientras que las hojas han sido utilizadas como cataplasma en llagas, forúnculos e hinchazones. En decocción es purgante, lactagogó y emanogogó; ayuda en dolor de estómago, de cabeza y de vejiga; para el tratamiento de las caries o como loción para los ojos.8
Esto ha llevado a reconsiderar el aprovechamiento de esta planta como una potencial fuente alternativa de nutrientes de interés médico y comercial. Sin embargo, la mayoría de la información reportada en la literatura está enfocada en la semilla (aceite), 8 mientras que, para las hojas en específico, la información sobre su composición química y nutricional aún es escasa.
Algunos trabajos realizados solo evalúan el análisis histoquímico y fitoquímico primario en la hoja, como el de Gopalkrishnan 8, en la India. Krishnamoorthy 9 evaluó la composición fitoquímica primaria en diversas partes de la planta. Annongu y Joseph 10, en Nigeria, determinaron el análisis proximal en las semillas y en la torta obtenida después de la extracción del aceite, para evaluar su posible aplicación como alimento para animales. Otros autores han estimado la capacidad antioxidante 11 o el efecto bioinsecticida 12 en los extractos de las hojas, utilizando diversos solventes.
Derivado de lo anterior, el objetivo de este trabajo es identificar algunos compuestos nutricionales presentes en las hojas de Ricinus communis recolectadas en Silao de la Victoria, Guanajuato, México, mediante su evaluación fitoquímica primaria, composición química y determinación de algunos compuestos bioactivos y minerales, para avanzar sobre su aporte nutricional y coadyuvar a su valorización, pues actualmente en la localidad es considerada como una maleza que afecta a suelos cultivables o cercanos a ríos.
Materiales y métodos utilizados
Reactivos
Los reactivos utilizados fueron grado analítico. Agua desionizada 18,2 MΩ-cm (Elix). Hidróxido de sodio (pureza 99 %, Karal), éter de petróleo (ACS, Karal), cloroformo (pureza 99,8 %, Karal). Ácido clorhídrico (pureza 37 %, Supelco), ácido sulfúrico (pureza 98 %, Supelco), ácido fosfórico (pureza 85 %, Supelco), ácido nítrico (pureza 98,5 %, Supelco), metanol (pureza 99,5 %, Supelco), cloruro férrico (pureza 98 %, Supelco), etanol (pureza 99,9 %, Supelco) y acetonitrilo (pureza 99,9 %, Supelco). Pentaóxido de vanadio (pureza 99,6 %, Thermo Scientific) y 2,5-bis(5-ter-butil-benzoxazol-2-il)tiofeno (BBOT) (99 %, Thermo Scientific). Miricetina (pureza 96 %, Sigma Aldrich), quercetina (pureza 95 %, Sigma Aldrich), kaempferol (pureza 97 %, Sigma Aldrich), ácido g-aminobutarico (pureza 99 %, Sigma Aldrich), kit de L-aminoácidos en HCl 0.1N (Sigma Aldrich), trietanolamina (pureza 99 %, Sigma Aldrich) y fenil isotiocianato (pureza 99 %, Sigma Aldrich). Helio (pureza 99,5 %, Praxair) y argón (pureza 99,9 %, Praxair).
Recolección de muestras
Se recolectaron, de forma manual, hojas sanas de Ricinus communis L. [Sp, PI,2:1007 (1753)] y libres de plaga, en 12 puntos diferentes de muestreo en la ciudad de Silao de la Victoria, Guanajuato, México, durante la temporada primavera-verano. Las hojas fueron lavadas con agua desionizada para eliminar el polvo, y secadas a la sombra a temperatura ambiente por 5 días. Después se molieron utilizando un molino de bolas marca Pulverisette (Alemania) y se tamizaron en un tamizador vibratorio modelo AS 200, marca Retsch (Haan, Alemania) hasta obtener un polvo fino homogéneo. El polvo fue almacenado en bolsas de polietileno a 4 °C.9
Análisis fitoquímico
La caracterización fitoquímica primaria se realizó de forma cualitativa de acuerdo con lo reportado por Valdivia et al., 13 para identificar la presencia de taninos, saponinas, terpenoides y esteroides con ligeras modificaciones. Para ello, los extractos hidro-alcohólicos fueron preparados pesando 5 g de las hojas pulverizadas en un frasco de vidrio; se les añadió 50 mL de la disolución etanol: agua (90:10 v/v) y se dejaron en maceración con agitación durante 24 h a 160 rpm. Transcurrido este tiempo, los extractos fueron filtrados utilizando papel filtro whatman no. 42 y almacenados en frascos color ámbar a 4 °C para su posterior caracterización química. Todas las pruebas se realizaron por triplicado. A continuación, se describen brevemente cada una de ellas.
Prueba de taninos
Los taninos fueron detectados por reacción con cloruro férrico. Para ello, se mezcló 1 mL del extracto hidro-alcohólico con 2 mL de agua desionizada en un tubo de ensayo, y se calentó en baño María a 90 °C. Después, el tubo se dejó enfriar y se le agregaron dos gotas de solución de cloruro férrico al 1 % en metanol. Se dejó reposar y se observaron los cambios ocurridos. La presencia de taninos fue identificada mediante la formación de un color verde oscuro en la solución.14
Prueba de saponinas
Las saponinas fueron observadas mediante el ensayo de espuma de la siguiente manera: se mezcló 1 mL del extracto hidro-alcohólico con 3 mL de agua desionizada en un tubo de ensayo, se agitó vigorosamente y luego se calentó a ebullición durante 5 min. La formación de espuma con burbujas y con duración estable (15 s) mostró la presencia de saponinas.14
Prueba de terpenoides
Para la identificación de terpenoides se realizó la prueba de Salkowski, para lo cual se tomaron 5 mL del extracto hidro-alcohólico y se le agregaron 2 mL de cloroformo y 3 mL de ácido sulfúrico concentrado. Una coloración marrón rojiza es formada en la interface como señal de la presencia de terpenoides.14
Prueba de esteroides
La identificación de esteroides se realizó mediante la reacción de Salkoswki modificada. El procedimiento consistió en mezclar 1 mL del extracto hidro-alcohólico con 3 mL de cloroformo en un tubo de ensayo; se homogenizó y después 2 mL de ácido sulfúrico concentrado fueron adicionados por las paredes del tubo de prueba. La formación de un color rojo en la capa superior y color verde en la capa del ácido sulfúrico fue indicativo de presencia de esteroides en el extracto.14
Composición elemental
Un analizador elemental modelo Flash 2000 de Thermo Scientific (Massachusetts, Estados Unidos), fue utilizado para la determinación del contenido elemental carbono total, nitrógeno total, azufre total e hidrógeno total. Para ello, se pesaron 10 mg de pentaóxido de vanadio con 3 mg de las hojas en polvo en una cápsula de estaño, la que fue cerrada y colocada en el horno del equipo para su análisis. El analizador fue operado a una temperatura de 950 °C en el reactor, y de 650 °C en el horno. El flujo de helio como gas de acarreo fue de 140 mL/min y el de oxígeno de 250 mL/min, como gas de combustión. El tiempo de análisis fue de 720 s. Para asegurar la calidad de los resultados, los análisis se hicieron por triplicado y se utilizó como material de referencia el BBOT.
Análisis proximal
El análisis proximal fue realizado de acuerdo con lo reportado por la FAO,14 con ligeras modificaciones: humedad (calentamiento en estufa a 103±2 °C durante 4 h hasta peso constante); ceniza (calcinación en mufla a 550±20 °C por 3 h); lípidos (extracción soxhlet con éter de petróleo durante 4 h); fibra bruta (extracción soxhlet con ácido clorhídrico 0,225 N por 30 min, seguida de hidróxido de sodio 0.313 N por otros 30 min y calcinación en mufla a 550 °C por 20 min). La proteína cruda fue determinada en un sistema de destilación Kjeldahl marca Ecoshel (Texas, Estados Unidos) utilizando un factor de conversión a proteína de 6,25. Todos los análisis se realizaron por triplicado para cada muestra.
Determinación de macrominerales
Algunos minerales como calcio, potasio, fósforo y magnesio, fueron determinados utilizando un espectrómetro de emisión atómica acoplado, inductivamente, a plasma (ICP-AES) marca Thermo Scientific, Mod. iCAP 6500 (Massachusetts, Estados Unidos). La hidrólisis se realizó pesando 300 mg de las hojas en polvo en viales de vidrio de 15 mL, se añadieron 2 mL de ácido nítrico concentrado y 200 µl de peróxido de hidrógeno y se dejaron en digestión a 105 °C por 4 h. Después se filtraron en papel whatman no. 41 y se llevaron a un volumen de 25 mL con agua desionizada. Una alícuota fue diluida adecuadamente y analizada. La cuantificación se realizó mediante calibración externa, utilizando la solución multielemental QCS-19 ICP 19 Element Quality Standard (100 µg/mL), diluida adecuadamente.15 Los análisis se realizaron por triplicado para cada muestra recolectada.
Contenido de flavonoides
La determinación de algunos flavonoides como son la miricetina, quercetina y kaempferol se realizó de acuerdo con lo reportado por Savic et al., 16 con ligeras modificaciones. Para ello, se pesaron 50 mg de hojas en polvo en tubos de digestión de 40 mL, se les adicionó 5 mL de ácido clorhídrico 6 mol/L y 20 mL de metanol. Los viales fueron cerrados y colocados en baño María a 80 °C durante 2 h. Después se filtraron en papel whatman no. 41 y se ajustó el volumen a 25 mL con agua desionizada. Una alícuota fue diluida adecuadamente en agua antes del análisis. Para la determinación cromatográfica se utilizó un cromatógrafo de líquidos de alta resolución marca Agilent Tecnlogies modelo 1100 (Santa Clara, California), con detector de arreglo de diodos a una longitud de onda de 370 nm. La separación se realizó con una columna RP-luna 5u C18 (250 · 4,6 mm) empleando como fase móvil MeOH/H2O/H3PO4 (50:50:4 v/v/v) a un flujo constante de 1,0 mL/min. La temperatura de entrada a la columna fue de 30 °C y el volumen de inyección de 20 µl. La identificación de quercetina, miricetina y kaempferol se efectuó conforme al tiempo de retención obtenido en los estándares, previa inyección individual. La cuantificación se realizó mediante calibración externa empleando siete niveles de concentración (0,05; 0,1; 0,25; 0,5; 1,0; 2,5; 5,0 mg/L). Los análisis se realizaron por triplicado para cada muestra recolectada.
Determinación de aminoácidos
El procedimiento para evaluar el perfil de aminoácidos consistió en hidrolizar las hojas en polvo (1,0 g) con 3 mL de HCl 6 mol/L durante 1 h a 150 °C. Después, un volumen conocido de cada hidrolizado y en mezcla (equivalentes a 5 µg) fue secado al vacío, reconstituido con una solución de etanol-agua-trietilamina (2:2:1 v/v/v), secados nuevamente al vacío y luego se derivatizaron con 20 µl de la solución etanol-TEA-agua-PITC (7:1:1:1 v/v/v/v) antes del análisis cromatográfico. Las soluciones patrón con los estándares individuales fueron preparadas a una concentración de 1,0 mg/mL en agua o en ácido clorhídrico 0,1 mol/L; se diluyeron adecuadamente y se trataron de forma similar a las muestras. La determinación se realizó en un cromatógrafo de líquidos marca Agilent Technologies modelo 1100 (Santa Clara, California), con detector de UV a una longitud de onda de 254 nm, utilizando una columna Pico Tag (150 · 3,9 mm) y con un volumen de inyección de 4 µl. La separación se realizó utilizando dos eluentes: (A) buffer de acetato de sodio 0,13 mol/L con 0,5 mL/L TEA, ajustado a pH 6,35 con ácido acético glacial y (B) acetonitrilo al 60 % en agua. La curva de calibración se realizó utilizando seis niveles de concentración (50, 150, 300, 450, 600, 750 pmol/µl) empleando el estándar certificado de Sigma-Aldrich que contiene 17 L-aminoácidos a una concentración de 2,5 mmol/L (excepto la cisteína a 1,25 mmol/L) en HCl 0,1 mol/L. La identificación se realizó de acuerdo con el tiempo de retención obtenido en los estándares individuales. Los análisis se realizaron por triplicado para cada muestra.17
Resultados y discusión
Análisis fitoquímico
El análisis fitoquímico primario mostró la presencia de diversos compuestos bioactivos como son los taninos, saponinas, esteroides, terpenoides para todas las muestras analizadas. Resultados similares fueron obtenidos por otros autores, quienes reportaron, de forma general, la presencia de almidón, taninos, alcaloides, glicósidos, saponinas, azúcares, terpenoides y flavonoides en los extractos de hojas, utilizando diversos solventes para su extracción tales como agua, metanol o etanol.4,8,9
Composición elemental
La composición elemental promedio obtenida en las hojas fue de 42,03; 5,33 y 5,72 % para el carbono, nitrógeno e hidrógeno respectivamente (tabla 1); mientras que, para el azufre fue menor al 1 %. Esto hace que las hojas puedan ser aprovechadas, por ejemplo, para obtención de carbón activado, o bien como fertilizante o composta.18
Tabla 1 Composición elemental obtenida en las hojas de Ricinus communis (n= 12)
| Composición elemental | Unidad | Mínimo | Máximo | Promedio | CV* |
|---|---|---|---|---|---|
| Carbono total | % | 38,96 | 43,15 | 42,03 | 3,12 |
| Nitrógeno total | % | 4,35 | 6,33 | 5,53 | 11,20 |
| Hidrógeno total | % | 5,30 | 5,92 | 5,72 | 3,44 |
| Azufre total | % | 0,37 | 0,58 | 0,43 | 16,30 |
*CV: Coeficiente de variación
Análisis proximal
En la tabla 2 se presenta el análisis proximal obtenido en las hojas de Ricinus communis. Los parámetros extracto libre de nitrógeno (ELN), materia orgánica (MO) y la energía bruta (EB) fueron evaluados por aproximación, mediante las siguientes ecuaciones, 14 siendo PC (proteína bruta), L (lípidos), FC (fibra cruda) y MS (materia seca)
La composición química obtenida en el análisis proximal, reveló la presencia de valiosos nutrientes como son la proteína cruda (25,94 -38,31 %), fibra cruda (5,37-6,51 %), lípidos (3,31-4,25 %) y ceniza (8,02-10,7 %). Los macro-minerales evaluados fueron magnesio (0,45-0,56 %), potasio (2,47-3,53 %), calcio (0,81-0,87 %) y fósforo total (0,34-0,55 %). Estos valores son cercanos a lo obtenido por diferentes autores, quienes de forma general, reportan valores en las hojas comprendidos entre 13,13-39,2 % para la proteína cruda, 10,83-18,5 % para la fibra cruda, 1,55-6,04 % de lípidos y 3,3-9,86 % para el contenido de ceniza.8,19-21
Es importante comentar, que dicha variación en el contenido de los nutrientes puede deberse a diferentes aspectos, como pueden ser el lugar de origen, la especie o la forma de cultivo. Comparativamente para la torta de ricinus, después de la extracción del aceite, algunos autores reportan valores de 32-43 % de proteína y algunos minerales como potasio, magnesio, calcio y fósforo en el intervalo de 0,5-1 %.22 Como se puede observar, por su alto contenido en proteína y otros nutrientes, previo tratamiento de desintoxicación, las hojas de Ricinus communis son muy apreciadas como forraje proteico-energético para la alimentación animal.7 Además, Ramírez-Navarro et al., 19 probaron el consumo de harina de la hoja de R. commmunis con ovinos, y Del Viento et al., 23 como forraje con borregos, sin presentar signos de intoxicación en los animales.
Tabla 2 Análisis proximal en las hojas de Ricinus communis (n=12)
| Parámetro evaluado | Unidad | Mínimo | Máximo | Promedio | CV* |
|---|---|---|---|---|---|
| Humedad Materia Seca (MS) Proteína cruda (PC) Fibra cruda (FC) Lípidos (L) Ceniza Extracto Libre Nitrogenado (ELN) Materia orgánica (MO) Energía bruta (EB) | % % % % % % % % kcal/kg | 5,88 88,35 25,94 5,37 3,31 8,02 38,60 80,33 1550 | 11,65 94,12 38,31 6,51 4,25 10,70 49,02 83,42 2175 | 9,07 90,93 33,31 5,97 3,71 9,63 42,02 81,31 1905 | 2,85 2,05 11,20 13,23 14,40 13,80 8,44 9,31 5,97 |
*CV: Coeficiente de variación
Contenido de flavonoides
En el tabla 3 se presentan los valores obtenidos para los tres flavonoides evaluados en las hojas: miricetina, quercetina y keampferol, los cuales pertenecen al grupo de los flavonoles. Su identificación se realizó con base al tiempo de elución obtenida en los estándares individuales, siendo de 3,35; 3,83 y 4,55 min, respectivamente para cada uno de ellos. El límite de cuantificación se consideró como el primer punto de la curva de calibración (0,05 mg/L) para cada uno de ellos, y los valores obtenidos para R2 fueron mayores a 0,995. También se presenta el perfil de aminoácidos. Estos fueron determinados de forma similar a lo realizado para los flavonoides. El tiempo de análisis obtenido fue de 12 min y los valores para R2 fueron mayores a 0,95.
Para los flavonoides, la quercetina (16,19-31,13 %) fue el flavonoide mayoritario, seguida de la miricetina (6,34-12,22 %) y el kaempferol (1,92-2,83 %). En este contexto, existe poca información reportada en la literatura, salvo algunos trabajos de revisión como el realizado por Jena y Gupta, 24 donde reportan para las hojas secas, la presencia de seis compuestos derivados de la quercetina y kaempferol, pues estos son los flavonoles más estudiados. De forma general, los flavonoides son compuestos bioactivos que pertenecen a una clase de metabolitos secundarios producidos por las plantas, y son de importancia tanto nutricional como comercial, principalmente porque no pueden ser sintetizados por humanos ni por animales. Estos nutrientes favorecen a diferentes funciones bioquímicas, enzimáticas y celulares. Presentan propiedades benéficas para la salud por sus efectos antioxidantes, cardiotónicas, antimutagénicas, hepaprotectoras, anticancerosas, antiinflamatorias, antimicrobianos y prevención del Alzheimer. Comercialmente, son componentes indispensables en una gran variedad de productos para aplicaciones nutracéuticas, farmacéuticas, medicinales y cosméticas.25
Tabla 3 Contenido de flavonoides y aminoácidos en las hojas de Ricinus communis (n=12)
| Nutriente | Unidad | Mínimo | Máximo | Promedio | CV* |
|---|---|---|---|---|---|
| Flavonoide | |||||
| Miricetina | % | 0,63 | 1,22 | 0,82 | 20,87 |
| Quercetina | % | 1,62 | 3,11 | 2,28 | 22,43 |
| Kaempferol | % | 0,19 | 0,28 | 0,22 | 24,40 |
| Aminoácido | |||||
| Lisina | % | 1,26 | 1,91 | 1,67 | 7,28 |
| Metionina | % | 0,41 | 0,63 | 0,55 | 7,83 |
| Cistina | % | 0,30 | 0,45 | 0,40 | 7,56 |
| Treonina | % | 0,96 | 1,45 | 1,27 | 10,3 |
| Arginina | % | 1,37 | 2,07 | 1,81 | 9,94 |
| Isoleucina | % | 0,99 | 1,50 | 1,32 | 11,4 |
| Leucina | % | 1,77 | 2,67 | 2,34 | 9,42 |
| Valina | % | 1,25 | 1,89 | 1,65 | 10,8 |
| Histidina | % | 0,50 | 0,76 | 0,66 | 11,5 |
| Fenilalanina | % | 1,28 | 1,93 | 1,69 | 10,4 |
| Glicina | % | 1,14 | 1,73 | 1,51 | 12,5 |
| Serina | % | 0,87 | 1,32 | 1,16 | 9,51 |
| Prolina | % | 1,24 | 1,88 | 1,65 | 12,7 |
| Alanina | % | 1,30 | 1,96 | 1,72 | 10,5 |
| Ácido aspártico | % | 2,18 | 3,31 | 2,89 | 9,69 |
| Ácido glutámico | % | 2,73 | 4,13 | 3,61 | 10,5 |
| Ácido g-aminobutírico | % | 0,29 | 0,44 | 0,39 | 11,8 |
*CV: Coeficiente de variación
Por otro lado, los aminoácidos encontrados en las hojas en mayor proporción (tabla 3) fueron el ácido glutámico (2,73-4,13 %), ácido aspártico (2,18 -3,31 %), leucina (1,77-2,67 %) y arginina (1,37-2,07 %). Mientras que, algunos de los aminoácidos prioritarios para la alimentación animal, como son la lisina y metionina estuvieron entre 1,26-1,91 y 0,41-0,63 %, respectivamente. Estos nutrientes son compuestos bioactivos multifuncionales de gran relevancia nutricional, ya que participan activamente en diversos procesos metabólicos como son la síntesis de nuevas proteínas o de otros metabolitos corporales, coadyuvan en la estimulación del sistema inmunológico o como neurotransmisores; además, también pueden servir como fuentes inmediatas de energía metabólica cuando son oxidados a dióxido de carbono.25
Conclusiones
Se precisó la composición química y la presencia de algunos nutrientes en las hojas de Ricinus communis (1753), recolectadas en doce sitios de muestreo en la ciudad de Silao de la Victoria, Guanajuato, México. Las hojas de esta planta son una materia prima rica en diversos compuestos bioactivos de interés nutricional y comercial como son las saponinas, taninos, terpenoides, esteroides, flavonoides y aminoácidos. También presentaron un alto contenido proteico, macro-minerales como el magnesio, calcio, potasio y fósforo y son ricas en carbono y nitrógeno. Todos estos compuestos le confieren diversas propiedades benéficas para la salud, o bien, para su aprovechamiento en otros sectores, ya sea como fuente proteica para alimentación animal, fertilizante o composta, para obtención de carbón activado o para el curtido vegetal de pieles. Además, otros de sus beneficios son, que es una planta disponible todo el año, de fácil cultivo y de bajo costo, lo cual potencializa su valorización.