INTRODUCCIÓN
La gonadotropina coriónica humana (hCG, por sus siglas en inglés) es una glicoproteína dimérica producida por la placenta durante el embarazo y también por la glándula pituitaria en hombres sanos y mujeres no gestantes, aunque en concentraciones bajas. La misma está compuesta por 2 subunidades: la alfa (α), que es común con otras hormonas como la hormona estimulante de la glándula tiroides (TSH), la hormona folículo-estimulante (FSH) y la hormona luteinizante (LH), y la beta (β), la cual le confiere especificidad a la hCG debido a que cierta parte de esta subunidad es exclusiva de esta hormona, lo que sirve para diferenciarla del resto. Ambas subunidades se mantienen unidas por interacciones hidrófobas e iónicas no covalentes. Durante el metabolismo ocurre la separación de las subunidades α y β, formándose varios productos metabólicos. 1-6
La hCG estimula la producción de testosterona (T) sin afectar marcadores de dopaje como la relación T: epitestosterona. Por ello, la Agencia Mundial Antidopaje (AMA) la incluye en la Lista de sustancias prohibidas en el deporte y exige sanciones cuando la presencia de la hCG intacta en muestras de atletas masculinos excede las 5 mUI/mL. 7-9
En el año 2003 el Laboratorio Antidoping de La Habana (LAH) recibió la acreditación por el cumplimiento de los requisitos descritos en la norma NC ISO/IEC:17025 para laboratorios de ensayo y calibración y el estándar internacional de laboratorios de la AMA. Su misión principal es la de detectar sustancias prohibidas en muestra de atletas mediante la aplicación de procedimientos de ensayo con niveles altos de sensibilidad y precisión. Para la detección y cuantificación de la hCG en orina de atletas masculinos, la AMA impone requisitos de obligatorio cumplimiento para los Laboratorios descritos en su documento técnico TD2021CG/LH “Análisis, reporte y gestión de los hallazgos urinarios de gonadotropina coriónica humana y hormona luteinizante en hombres”. 8-10
Los objetivos de la presente revisión son describir la justificación del uso de la hormona con propósitos de dopaje, relacionar los principales ensayos de detección de la hormona con las normas establecidas en el ámbito del deporte y describir la estrategia del Laboratorio Antidopaje de La Habana (LAH), en el entorno de las regulaciones vigentes.
METODOS
A través de la revisión bibliográfica se recopiló, resumió y analizó la información disponible acerca de la hormona hCG. Por esta razón, los métodos utilizados fueron fundamentalmente: observación, descripción y síntesis.
Criterios de búsqueda: Durante la recopilación de información se utilizaron las siguientes palabras y frases claves como criterios de búsqueda: a) hormona hCG, usos clínicos, estructura, farmacología, estabilidad, métodos de detección, b) hormona hCG, uso en el deporte, c) hormona hCG, Agencia Mundial Antidopaje y d) validación de ensayos, validación de inmunoensayos. Se revisaron documentos en español e inglés.
La revisión abarcó fuentes publicadas en el período 1976 a 2021. De las referencias encontradas solo se aceptaron aquellas cuyo origen fuera trazable, por ejemplo, numeración DOI (digital object identifier o identificador de objeto digital), ISSN (international standard serial number o número internacional normalizado de publicaciones seriadas) y ISBN (international standard book number o número estándar internacional de libros), así como revistas con arbitraje por pares.
De un total de 132 referencias consultadas, se seleccionaron 61 teniendo en cuenta los criterios de inclusión descritos con anterioridad. Entre los documentos revisados se encontraron: libros, artículos científicos, artículos de revisión y manuales de usuario de instrumentos. En general, los documentos fueron extraídos de sitios científicos como Pubmed, Medline, SciELO, Springer, Infomed y los motores de búsqueda fueron Google Académico y Google. Se revisaron documentos técnicos de la AMA, documentos internos del LAH y los siguientes sitios web:
https://www.wada-ama.org/en/what-we-do/science-medical/laboratories: Sitio oficial de la agencia mundial antidopaje que publica las normas que rigen el trabajo en los laboratorios acreditados.
https://diagnostics.roche.com/global/en/products/instruments/cobas-e-411.html Sitio oficial de la firma alemana Roche, específicamente para la consulta de datos referidos al analizador Elecsys cobas e411.
https://www3.paho.org/cub/index.php?option=com_content&view=article&id=223:centro-inmunoensayo-cie&Itemid=528: Sitio oficial del Centro de Inmunoensayos de Cuba, específicamente para la consulta de datos referidos al kit UMELISA HCG.
Entre otros documentos consultados, se encontraron procedimientos normalizados de trabajo (PNT) y protocolos-reportes de validación (PV/RV) del sistema de gestión de la calidad del LAH.
RESULTADOS
Hormona gonadotropina coriónica humana. Descripción
La hormona hCG es una glicoproteína que se produce por el embrión en desarrollo poco después de la concepción y posteriormente por una parte de la placenta denominada sincitiotrofoblasto. También se encuentra en bajos niveles en hombres sanos y mujeres no embarazadas cuya producción ocurre en la hipófisis. La hCG posee una masa molecular de 36,7 kDa y presenta 2 subunidades: la alfa (α) y la beta (β), por lo que se clasifica como heterodimérica. La subunidad α tiene 92 aminoácidos y es común con otras hormonas como la LH, la FSH y la TSH. La subunidad β presenta 145 aminoácidos y es específica de la hCG, lo que permite su diferenciación de las demás hormonas. 2,5,11-13
Farmacología y farmacocinética
La hormona liberadora de gonadotropinas (GnRH) es un decapéptido producido por el hipotálamo y su función es regular la secreción de las gonadotropinas, entre ellas la hCG pituitaria. La secreción de GnRH y la liberación de las gonadotropinas ocurre con carácter pulsátil y en ellas influyen 2 sistemas neuroquímicos: el α-adrenérgico, con carácter estimulador, y el opioide, de carácter inhibidor. La regulación de la producción de gonadotropinas hipofisarias a través de la GnRH responde a un mecanismo de retroalimentación negativa. 1,14-16
Las inyecciones de GnRH promueven los niveles de hCG hipofisaria y de LH y se infiere que la hCG hipofisaria complementa la LH hipofisaria en hombres y mujeres. La acción de ambas está mediada por un receptor conjunto hCG/LH localizado en las células del cuerpo lúteo del ovario, en el tejido miometrial, en el tejido del cordón umbilical y en las células del cerebro humano, entre otros. 1,17
Con el embarazo, la hCG reemplaza a la LH para promover la producción de progesterona; alcanza su concentración máxima a las 10 semanas de gestación y continúa produciéndose a lo largo del embarazo. Estudios en torno a las funciones de esta hormona han demostrado que participa en la promoción de la producción de progesterona del cuerpo lúteo, la angiogénesis de la vasculatura uterina, el crecimiento del útero durante el embarazo, el control de la contracción del músculo uterino, la promoción del crecimiento y diferenciación de órganos fetales, entre otros. 11,15,17-23
La hCG hipofisaria se produce a niveles muy bajos en los hombres (entre 0,03 mUI/mL a 1,7 mUI/mL); mientras que en mujeres es secretada en pulsos en las fases lútea y folicular del ciclo menstrual paralelos a los niveles de LH. 17
Una de las características farmacocinéticas de las gonadotropinas es que no se absorben por vía oral y administrada por vía parenteral la hCG muestra una semivida de 8 h. La eliminación urinaria es del 5 % al 10 % de la dosis. La excreción renal provoca la degradación proteolítica de la hormona y como resultado se obtiene una constitución compleja de varias isoformas moleculares, como son hCG mellada (hCGn), hCG β, hCG β mellada (hCGβn), hCG intacta y un fragmento central de la subunidad β (hCGβcf), siendo estos 2 últimos las variantes urinarias principales. La hCGβcf está conformada por 2 cadenas de aminoácidos unidas mediante puentes disulfuro. 2,14
Las reacciones adversas relacionadas con la administración de la hCG se han descrito en el 1 % al 4 % de los pacientes, y las principales son: cefalea, depresión, edema, pseudo-pubertad, ginecomastia, síndrome de hiperestimulación, agrandamiento ovárico, ascitis, hidrotórax, hipovolemia y, raras veces, shock. Puede producirse un hemoperitoneo por rotura de un quiste ovárico, fiebre y tromboembolia arterial. 14
Usos diagnóstico y terapéutico
Debido a la diversidad de procesos en los que participa directa e indirectamente, la hCG es utilizada en la terapia y diagnóstico de muchas enfermedades. Entre ellas:
Diagnóstico de embarazo. Es uno de los diagnósticos más conocidos y utilizados. Durante el embarazo, existen niveles significativos de hCG en la sangre y la orina. La hormona puede detectarse inmunológicamente con antisueros específicos para su subunidad β. El diagnóstico es rápido y no invasivo, pues la matriz empleada es la orina. 14,15,18,23
Evaluación del transcurso del embarazo. Además de verificar la normalidad del embarazo, este ensayo también aporta datos en la detección de un embarazo ectópico, mola hidatiforme o coriocarcinoma. En los embarazos viables, la concentración media de hCG de 126 mUI/mL 12 días después de la transferencia de embriones, mientras que los niveles menores a 76 mUI/mL se asocian con la pérdida temprana del embarazo. Mientras tanto, niveles de hCGβ superior a 1500 mUI/mL a 2000 mUI/mL son una evidencia de un embarazo ectópico. 11,15,18,20,22
Marcador tumoral. Las mediciones cuantitativas de la hormona en suero se emplean como marcador tumoral de enfermedades trofoblásticas malignas (común en cáncer de testículo y próstata) y tumores de células germinales, así como para dar seguimiento clínico a la respuesta de terapias antineoplásicas. 15,20,24
Marcador para el diagnóstico del síndrome de Down. La detección prenatal de trisomía 21 es extremadamente importante para disminuir la prevalencia de nacimientos con síndrome de Down. Para ello se evalúan marcadores bioquímicos como la α-fetoproteína, el estriol no conjugado, la hCG, la fracción β-HCG libre e inhibina-A. 21,25,26
En la estimulación de la producción de T para evaluar la función de las células de Leydig. Los niveles séricos de T se analizan después de múltiples dosis de hCG. Una respuesta de T disminuida a la hCG indica insuficiencia de las células de Leydig, mientras que una respuesta de T normal sugiere un trastorno hipotalámico-hipofisario. 14,15,27
La administración de hCG es útil, entre otros, en los siguientes casos: a) infertilidad masculina asociada con el hipogonadismo, b) promover la ovulación en protocolos controlados de hiperestimulación ovárica y ayudar a la concepción, c) esterilidad funcional femenina y masculina por insuficiente secreción hipofisaria o por falta de respuesta ovárica al estímulo normal hipofisario, d) amenorrea primaria y secundaria, oligomenorrea y ciclos anovulatorios, e) menometrorragia funcional, amenaza de aborto y aborto habitual. 1,2,11,14,15
El síndrome de hCG familiar es una afección poco común y se describió por primera vez en 2009. Los miembros de la familia afectados producen una forma mutada de hCG con múltiples alteraciones en la región del péptido C-terminal de la molécula, lo que da como resultado un aumento persistente de la hormona. 28,29
Usos en el deporte
El uso de esta hormona en el deporte se basa fundamentalmente en la capacidad de la hCG de restaurar la producción de T endógena. Aparentemente, los consumidores masculinos de esteroides anabólicos abusan de la hCG en 2 situaciones:
El abuso prolongado de esteroides anabólicos en dosis altas desarrolla una inhibición sostenida del eje testicular hipotálamo-hipofisario y con el uso de la hCG se estimula la producción de T testicular, por lo que se considera un medio de dopaje androgénico indirecto. La información preliminar sobre este aspecto sugiere que la relación entre la T y la epitestosterona (marcador de dopaje) no se ve afectada por el tratamiento con hCG debido a la estimulación del paso metabólico de T a estrógenos.
Los consumidores de andrógenos sintéticos (incluida la T) que buscan evitar la detección de dopaje, consumen la hCG para estimular la producción de T endógena. La “mezcla” de T fisiológica con T sintética en el organismo puede enmascarar un resultado analítico cuando se aplica la técnica de espectrometría de masas de relaciones isotópicas.
En hombres, las concentraciones basales de T en sangre se encuentran alrededor de 20 nmol/L y después de una administración de dosis terapéutica de hCG coriónica purificada y recombinante, aumentan a 30 nmol/L-40 nmol/L. Estas concentraciones de T en sangre (con incrementos entre 50 %-150 % equivalente a 10 nmol/L-30 nmol/L por la estimulación fundamentalmente de las células de Leydig) se han relacionado experimentalmente con el aumento de la fuerza y la masa muscular, lo cual justifica la prohibición de la hCG para atletas masculinos. 30
Sin embargo, en el sexo femenino la evidencia disponible demuestra que la hCG no tiene una estimulación significativa en el incremento de las concentraciones de T en sangre, sino en la producción de progesterona y estradiol en los ovarios. Los niveles basales de T en mujeres se encuentran entre 2 nmol/L-2,5 nmol/L y alcanzar niveles entre 30 nmol/L-40 nmol/L es muy poco probable después de una administración de hCG. La mejor evidencia disponible indica que la administración de 250 µg de hCG recombinante a mujeres jóvenes sanas produce un aumento de aproximadamente 0,25 nmol/L de T en sangre. Este aumento es aproximadamente la mitad del ritmo diurno en las concentraciones de T en sangre en las mujeres. También se ha descrito que la administración de hCG purificada en dosis bajas crónicas o dosis altas convencionales (5000 UI a 10000 UI), produce un aumento nulo o mínimo de 1 nmol/L de T en sangre en mujeres jóvenes con función ovárica normal. 30,31
Una consecuencia involuntaria de las pruebas de hCG en la orina de los atletas masculinos es el diagnóstico incidental de tumores de células germinales origen testicular o un tumor secretor de hCG ectópico, que secretan hCG. Por otro lado, la evaluación de hCG en la orina de atletas femeninas ha conllevado a la detección de embarazos o abortos espontáneos, a veces desconocidos para el atleta con consecuencias psicológicas potencialmente graves. 1,2,4,16,29-34
Ámbito regulatorio
La AMA es la responsable de revisar, actualizar y publicar la Lista de sustancias prohibidas con una frecuencia anual junto a una serie de documentos técnicos (DT) que rigen la actividad analítica en los laboratorios y armonizan las metodologías de ensayo. De manera general, se considera una sustancia prohibida si incrementa el rendimiento atlético, perjudica la salud del atleta y como consecuencia va en detrimento de la ética en el deporte. 32,33
Debido al incremento de su uso en el deporte, la hCG se incluye en la Lista de sustancias y métodos prohibidos en el año 1987. El primer límite umbral establecido se fijó arbitrariamente en una concentración de 25 mUI/mL en orina de atletas masculinos, y posteriormente se disminuyó a 5 mUI/mL. En 2005, la hCG también se prohibió para las atletas femeninas, pero la baja probabilidad de mejora en el rendimiento deportivo, unido a la posibilidad de detección de un embarazo, representaba una invasión significativa de la privacidad de las atletas. Por ello, desde el año 2006, la hCG está prohibida solamente en atletas masculinos y la detección de hCG con fines de control del dopaje en atletas femeninas requiere una justificación sólida. Dentro de la Lista, la hCG pertenece a la categoría S2 que incluye las hormonas peptídicas, factores de crecimiento y sustancias relacionadas y miméticos. 2,4,8,34,35
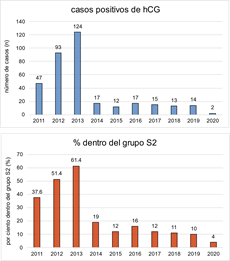
Según las estadísticas publicadas en el sitio web de la AMA, hasta el año 2013, la cantidad de muestras reportadas como positivas a la presencia de hCG fue significativa. En el grupo S.2 llegó a representar el 61,4 % de los casos positivos reportados. Sin embargo, el incremento de las exigencias en los ensayos de detección de la hormona, y al mismo tiempo, el incremento del consumo de otros agentes dopantes de mayor interés (ejemplo: eritropoyetina y sus análogos) originó una disminución notable en los últimos años. En la figura 1 se muestra el comportamiento de la detección de la hCG en los laboratorios para el control del dopaje desde 2011 hasta 2020.
 Fuente: Elaboración propia, a partir de https://www.wada-ama.org/en/resources/anti-doping-stats/anti-doping-testing-figures-report
Fuente: Elaboración propia, a partir de https://www.wada-ama.org/en/resources/anti-doping-stats/anti-doping-testing-figures-report
Fig. 1 . Casos positivos a la hormona gonadotropina coriónica desde 2011 hasta 2020. Gráfico rojo: casos positivos reportados de hCG, Gráfico azul: porciento que representa la hCG dentro del grupo S.2.
Antes de la emisión del primer DT en el año 2017, los requisitos mínimos para el ensayo de hCG y LH recomendaban la medición de la fracción intacta de la molécula de hCG como única alternativa válida para los ensayos de pesquisa (screening) o de confirmación. La primera versión del DT en el 2017 estableció que, a criterio y según los recursos disponibles en el laboratorio, se podía incluir un ensayo de prescreening, con la medición de la fracción total de la hormona. 8)
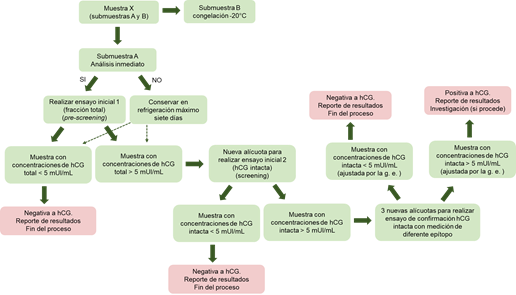
Actualmente, el DT identificado como TD2021CG/LH establece que el proceso de detección de hCG en orina puede realizarse en 2 fases: la preanalítica y la analítica. Esta última comprende el ensayo de pesquisa (screening) y el de confirmación. La fase preanalítica establece, además, las condiciones de conservación de la muestra para su posterior análisis, la estrategia de distribución de alícuotas, criterios de validación, análisis de pesquisa y de confirmación, así como el control de la calidad de los ensayos. La versión vigente del DT permite tanto la realización de inmunoensayos como ensayos basados en cromatografía acoplada a espectrometría de masas (C-EM) específicos para el heterodímero α/β de la hCG (hCG intacta) o para la fracción total de hCG (hCG total). 8
En la figura 2 se muestra el esquema general que deben seguir los laboratorios acreditados para la medición de la hCG en orina de atletas masculinos.
Métodos de detección y cuantificación
Luego del descubrimiento de hCG en la orina de mujeres embarazadas en el año 1927, se han desarrollado una serie de métodos biológicos e inmunológicos para su detección y cuantificación en orina y sangre. 36
En la actualidad, prácticamente todos los ensayos comerciales para hCG se basan en el “principio sándwich” que emplea anticuerpos monoclonales (acm) o una combinación de acm y antisuero policlonal. Básicamente, un acm anti-hCG se fija a una fase sólida para capturar la hCG dimérica, mientras que un segundo anticuerpo monoclonal-antisuero policlonal se conjuga con un agente de señalización (colorante, material radiactivo o enzima para detección espectrométrica/luminiscente) y reacciona con un sitio distal en la hormona para permitir la detección y medición de la hCG capturada. Las regiones antigénicas de la hCG se han definido ampliamente y los anticuerpos monoclonales con especificidad de epítopo conocida, han demostrado ser fundamentales para diseñar ensayos para las formas específicas de hCG. Se recomiendan las muestras de suero para las determinaciones cuantitativas, mientras que las muestras de orina se utilizan principalmente para pruebas de embarazo y para identificar resultados falsos positivos en muestras de suero, así como en análisis antidopaje. Tanto la hCG como la hCGβ están presentes en el suero, por tanto, estos análisis generalmente se diseñan para medir sus niveles combinados. 2,29,36-38
Para la detección y cuantificación de la hCG se han descrito un número considerable de técnicas. A continuación, se describen algunas de las más empleadas:
Tiras reactivas: Es el método comercial más utilizado en orina e implica el método sándwich de inmunocromatografía de doble anticuerpo y oro coloidal. Los diseños iniciales generalmente mostraban límites de detección (LD) de β-hCG superiores a 25 mUI/mL (aprox. 1 ng/mL) Sin embargo, las últimas aplicaciones han disminuido los LD a concentraciones inferiores a 3mUI/mL. 39-41
Radioinmunoensayos (RIA). Este ensayo utiliza un antígeno marcado con isótopos radiactivos para competir con el método de análisis de trazas in vitro del antígeno no marcado. En general, la reacción es compleja, el período efectivo es corto y la contaminación radiactiva lo convierte en un método poco atractivo. Fue uno de los métodos pioneros en la detección y cuantificación de la hCG y en su momento, una de las ventajas fue poder detectar la hCG con una alta precisión en presencia de altos niveles de estrógenos y otras hormonas como la LH. En general se consideran ensayos con características de operación simple, especificidad y determinación rápida. 42-44
Inmunoensayo de electroquímica luminiscente (ECLIA, siglas en inglés) es otra generación de inmunoensayos marcados, caracterizados por la alta sensibilidad y reproducibilidad y con un ruido de fondo muy bajo. La técnica se basa en sensores tipo sándwich y el uso de nanopartículas. Especialmente la reacción con nanopartículas compuestas de dióxido de titanio funcionalizadas en membrana Nafion, han mostrado LD en 0,007 mUI/mL. Sin embargo, los reactivos y los costos de mantenimiento del equipo son altos. 45,46
Inmunoensayos de quimioluminiscencia (CLIA, por sus siglas en inglés) implica la oxidación de sustancias quimioluminiscentes para formar especies intermediarias excitadas y emitir fotones. Esta técnica se ha convertido en una tecnología avanzada para la detección de sustancias en niveles de trazas, por su alta sensibilidad, especificidad, reactivos económicos y estables, rapidez de medición, amplio rango de detección y automatización de operación simple. Los diseños iniciales de CLIA utilizaron un éster de acridinio especial y partículas paramagnéticas en el inmunoanalizador LIAISON, logrando un LD de 0,001 mlU/mL y un rango de trabajo hasta 50 000 mlU/mL. Se han explorado combinaciones de CLIA y otros métodos de inmunoensayo e inmunoadsorción ligado a enzimas con LD de 3 mlU/mL de hCG. La introducción de reacciones que implican la peroxidasa de rábano (HPR, horseradish peroxidase, por sus siglas en inglés) y la oxidación del luminol han demostrado mayor sensibilidad. 39,47,48
Fluoroinmunoensayos (FIA, por sus siglas en inglés) se basa en la sensibilidad de la respuesta inmune y de la detección de fluorescencia. La concentración de una sustancia puede cuantificarse por la intensidad de la fluorescencia provocada por la reacción. Este ensayo es altamente específico y sensible; su desventaja es que el ámbito de aplicación es limitado porque la lectura del resultado final debe realizarse en un tiempo limitado. En general, FIA tiene buena estabilidad, alta sensibilidad y puede mantener la actividad biológica y la actividad inmune. 39,49
Inmunoensayos enzimáticos: es uno de los primeros métodos diseñados para la cuantificación de hCG. En él se combina la amplificación de reacciones catalizadas por enzimas con la especificidad de las reacciones de afinidad anticuerpo-antígeno. Posee una sensibilidad baja y solo es adecuado para determinaciones cualitativas y semi-cuantitativas. El Enzyme-Linked Immuno Sorbent Assay (ELISA, por sus siglas en inglés) es un método de análisis bioquímico común, que amplifica la señal de la unión antígeno-anticuerpo con reacciones catalizadas por enzimas. La técnica muestra una precisión satisfactoria en la identificación de varios biomarcadores tumorales, incluida la hCG. Se ha reportado un rango de detección y cuantificación desde 0,4 mUI/mL a 250 mUI/mL y una sensibilidad mayor que en ensayos RIA. 50,51
Espectrometría de masas (EM) es un método de análisis de medición de la masa iónica mediante la relación masa-carga y recientemente, se ha aplicado ampliamente en el análisis de proteínas. Muestra una velocidad alta de detección, alta precisión y necesita pequeños volúmenes de muestra. La EM se ha convertido en la última década en una fuerte herramienta de diagnóstico clínico. Su uso junto a la cromatografía líquida (CL) es una parte fundamental de la analítica del dopaje porque posee las ventajas de una identificación inequívoca de sustancias prohibidas, al tiempo que excluye cualquier tipo de reacción cruzada debida a compuestos interferentes. Además, puede reducir el riesgo de resultados falsos positivos y falsos negativos. Para el análisis de hCG por CL-EM, se han combinado pasos de hidrólisis y digestión enzimática, mostrando una estabilidad, precisión y repetibilidad satisfactorias. También se ha descrito la posibilidad de diferenciar la molécula de hCG recombinante de la hCG endógena (de origen fisiológico) cuando se utiliza la técnica de ionización por electrospray. 39,52,53
Estabilidad de la hormona en orina
La degradación de la hCG es inducida, entre otros, por condiciones ácidas, calor y escisión proteolítica debido a la presencia de enzimas proteolíticas en la orina, provenientes de fuentes exógenas o endógenas. Ocasionalmente, las temperaturas elevadas durante el transporte de las muestras de orina para el control del dopaje (tomadas en el sitio de la competencia y trasladadas hacia el laboratorio) favorecen el deterioro de la molécula de hCG. 54
Un estudio diseñado para verificar la estabilidad de la hCG en la orina conservada a -20 oC se llevó a cabo con mediciones en 2 intervalos de tiempo: de 5 años a 14 años y de 1 semana a 10 meses. En el intervalo de 5 años a 14 años se detectó una pérdida sustancial de la inmunorreactividad de la hCG, mientras que en el transcurso de 1 semana a 10 meses se demostró la pérdida de una proporción muy variable de la hormona donde las concentraciones de hCGβ aumentaron en la misma medida que la hCG disminuyó, aparentemente debido a la disociación de la hCG en sus subunidades. 55
En 2010, Tsivou y col. evaluaron la adición de una solución estabilizadora a muestras de orina de deportistas, con el objetivo de inactivar químicamente las enzimas proteolíticas y con ello evitar la degradación de la hCG (por adición de una solución química estabilizadora). Incubaron alícuotas de orina enriquecidas con hCG y 6 enzimas proteolíticas (subtilisina A, papaína, tripsina, α-quimotripsina, bromelina y pepsina) durante 4 días con y sin la solución estabilizadora, a 37oC y a -20oC. Después de la incubación a 37oC, observaron que la adición de subtilisina A, papaína, tripsina y α-quimotripsina en las alícuotas de orina no tratadas químicamente, dio como resultado niveles de hCG significativamente menores, contrario a las alícuotas tratadas. En presencia de bromelina y pepsina la concentración de hCG no difirió estadísticamente entre las alícuotas tratadas y sin tratar. Estos autores plantean que la degradación de la hCG pudo ocurrir mediante 2 procesos: a) una disociación causada por el efecto de la temperatura o b) una degradación provocada por la escisión proteolítica, sin embargo, no se puede descartar una combinación de ambos. Las muestras que almacenaron a -20°C registraron niveles más altos de hCG en presencia de tripsina, α-quimotripsina, papaína y bromelina en comparación con las muestras que se incubaron a 37oC. 54
Estrategia en el Laboratorio antidoping para la detección de la hormona
Ensayo inicial o prescreening. Sistema Ultra Micro Analítico
El Sistema Ultra Micro Analítico (SUMA) se creó en la década de 1980 por el Centro de Inmunoensayos (CIE) de Cuba. Es un sistema completo de reactivos e instrumentación para ultramicroensayos que combina la alta sensibilidad de los ensayos inmunoenzimáticos ELISA, con el uso de ultra-microvolúmenes de muestras y reactivos, con una consecuente reducción de los costos. La tecnología SUMA es una plataforma flexible, adecuada para desarrollar programas de salud basados en el pesquisaje activo. Específicamente, el kit Ultra-Micro-ELISA (UMELISA) HCG fue diseñado para detectar hCG en orina y suero con fines clínicos. Sin embargo, en el LAH se estableció una nueva aplicación al control del dopaje y se validó con estos propósitos. 37,56,57
El kit UMELISA HCG utiliza como fase sólida tiras de ultramicroELISA (10µL por pocillo) revestidas con anticuerpos monoclonales y policlonales anti (HCG. Las muestras se incuban en los pocillos y si éstas contienen HCG, la misma se fija a los anticuerpos del recubrimiento de la fase sólida. La realización de un lavado posterior elimina los componentes de la muestra no fijados. Posteriormente se añade un conjugado anti HCG (cadena α y β-fosfatasa alcalina, el cual se une a la hCG fijada en la reacción anterior. Un nuevo lavado de las tiras elimina el conjugado en exceso. La reacción de revelado se hace mediante la adición del sustrato fluorigénico 4-metilumbeliferil fosfato) el cual se hidroliza por la enzima del conjugado. La intensidad de la fluorescencia emitida es proporcional a la concentración de hCG en la muestra. 37
Aunque el kit posee sus propios estándares para la confección de una curva de calibración (cuantificación de la hCG en las muestras) y los controles (control de la calidad del ensayo), en el LAH ha desarrollado controles negativos y positivos “in-house”. El control negativo es una orina obtenida de un voluntario masculino, supuestamente sano con concentraciones de hCG inferiores a 1 mUI/mL (identificado como blanco de orina BLOR). Los controles positivos se diseñaron en 2 niveles: un control para concentraciones altas de hCG (15 mUI/mL identificado como orina positiva ORP2) y otro en concentraciones cercanas al nivel de decisión (5 mUI/mL identificado como orina positiva ORP3). La inclusión de controles diferentes a los del fabricante en el kit es recomendable para aumentar el control de la calidad del resultado analítico. (8,58,59
Cada lote analítico está conformado por los estándares del kit (curva de calibración), controles del kit, controles “in-house” y las muestras de orina de atletas masculinos (todos por duplicado). Los parámetros del control de la calidad, para la aceptación o no de los resultados, son los recomendados por el fabricante. Adicionalmente se verifican las desviaciones de los controles del kit y de los controles “in-house” mediante cartas de control cuyos límites se establecieron a partir de los resultados del proceso de validación del ensayo.
Si los criterios de control de la calidad se cumplen satisfactoriamente, los resultados del lote analítico se aceptan. Si en las muestras se observa valores de fluorescencia similares al control negativo BLOR y menores al control ORP3, se consideran “negativas a la presencia de hCG”. Si, comparado con los controles positivos ORP3 y ORP2, una muestra contiene hCG-total en una concentración superior a 5 mUI/mL, la muestra se considera “sospechosa” de un consumo de hCG. En este caso, una nueva alícuota de la misma muestra se evalúa usando el instrumento Cobas e411.
Ensayo de screening. Analizador Elecsys cobas e411
El analizador Elecsys cobas e411 de la firma Roche® (Alemania) es un analizador totalmente automatizado que utiliza una tecnología patentada de electroquimio luminiscencia (ECL) para el análisis de inmunoensayos. Está diseñado para determinaciones de ensayos in vitro cuantitativos y cualitativos para una amplia gama de aplicaciones (ejemplo: anemia, marcadores óseos, cardíacos y tumorales, cuidados intensivos, fertilidad y hormonas, entre otras). Entre las ventajas que ofrece el instrumento se encuentran: alta sensibilidad, fiabilidad y reproducibilidad de resultados gracias a la tecnología ECL; puede ejecutar hasta 18 ensayos con un rendimiento de hasta 86 pruebas por hora. Posee un flujo de trabajo de “muestra inteligente” que incluye: pipeteo de muestras sin arrastre para evitar la contaminación cruzada, y capacidad automatizada de repetición de muestras. 38
El analizador basa la ejecución de los ensayos en el principio sándwich. Durante la primera incubación, los anticuerpos capturan la hormona presente en la muestra y en el segundo paso, se añaden micropartículas paramagnéticas recubiertas de estreptavidina. Durante una segunda incubación, el anticuerpo biotinilado se adhiere a la superficie recubierta de estreptavidina de las micropartículas. La mezcla de reacción que contiene los complejos inmunes se transporta hasta la célula de medición. Los complejos inmunes quedan atrapados magnéticamente sobre el electrodo de trabajo, mientras que el reactivo y la muestra libre se eliminan con la solución de limpieza. En la reacción de ECL, el conjugado es un derivado basado en rutenio y la reacción quimioluminiscente se estimula eléctricamente para producir luz. La cantidad de luz producida es directamente proporcional a la cantidad de hCG presente en la muestra. La evaluación y el cálculo de la concentración del antígeno, se realiza mediante una curva de calibración creada a partir de estándares con concentraciones conocidas. 38
Al igual que en el ensayo de prescreening, el ensayo incluye los controles del kit y los controles “in-house” analizados simultáneamente con las muestras de orina de atletas masculinos (en triplicado). Igualmente, se controlan los parámetros de la calidad de la medición siguiendo las recomendaciones del fabricante y las desviaciones en cartas de control.
Si el resultado del análisis muestra una concentración de hCG superior o igual a 5 mUI/mL, se comprueba la gravedad específica (GE) de la muestra. Si la misma excede los 1,018 g/L, el valor experimental de hCG se ajusta aplicando un factor de corrección según el valor de consenso de 1,020 g/L. La muestra se considera positiva de dopaje con hCG si la concentración de la hormona, una vez corregida por la GE, supera los 5 mUI/mL. En caso contrario, la muestra se reporta como negativa. 8
Validación de los métodos analíticos en los laboratorios acreditados
La validación de un método consiste en su adecuación a requisitos previamente establecidos, con el objetivo de resolver un problema analítico particular. Estos requisitos son los que definen los parámetros o criterios de calidad que debe poseer un ensayo. Entre los parámetros de validación se encuentran: la exactitud, la precisión, especificidad, límite de detección, límite de cuantificación y linealidad, entre otros. 60
Con el objetivo de armonizar los ensayos entre los laboratorios antidopaje, el DT TD2021CG/LH establece que los inmunoensayos para detectar hCG deben mostrar valores de repetibilidad y precisión intermedia menores o iguales a 10 % y 15 %, respectivamente, al nivel de concentración de 5 mUI/mL, así como el límite de cuantificación menor o igual a 3 mUI/mL con una incertidumbre combinada máxima del 20 %. 8
En el proceso de validación de ambos ensayos se evaluaron la precisión, la exactitud y la incertidumbre combinada en muestras de orina contaminadas con hCG en concentraciones de 5 mUI/mL y 15 mUI/mL. Igualmente se evaluaron muestras de orina de voluntarios masculinos con una amplia variedad en los valores de GE, pH y presencia de sedimentos. Los voluntarios declararon no haber consumido medicamentos en los 7 días antes de colectar la muestra.
Validación de la tecnología SUMA con el kit UMELISA HCG
El material de referencia usado fue proporcionado por el Centro de Investigación y Desarrollo de Medicamentos (CIDEM). El mismo contenía 80 % de hCG intacta, 10 % de cadena β libre de hCG y 10 % de otros fragmentos de hCG, corroborado por el Laboratorio Antidoping acreditado de Roma (Italia), según describe la documentación interna del sistema de gestión de calidad del laboratorio.
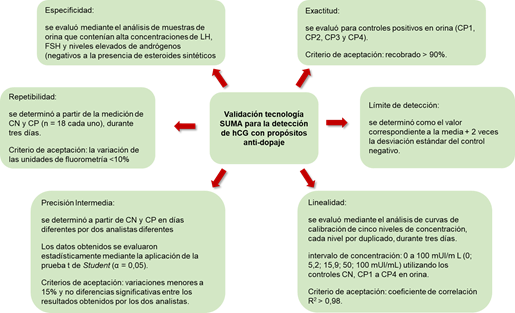
Los controles negativos (CN) y positivos (CP) se prepararon en el mismo laboratorio a partir del material de referencia. El CN mostró una concentración indetectable de hCG-intacta por STAT HCG (Elecsys cobas e411, Roche) y se utilizó como matriz para obtener los controles CP1 (5,20 ± 0,3 mIU/mL), CP2 (15,9 mIU/mL ± 2,5 mIU/mL), CP3 (50,1 ± 0,82 mIU/mL) y CP4 (99,7 mIU/mL ± 0,73 mIU/mL). Los CN y CP en suero proporcionados en el kit también se incluyeron en la evaluación de los parámetros de validación (CP5: 50 mUI/mL, control de embarazo y CP6: 100 mUI/mL, control positivo). En el proceso de validación se verificaron los parámetros de especificidad, precisión, exactitud, límite detección y linealidad. La estrategia de validación se muestra en la figura 3.
La capacidad de discriminación entre muestras negativas y positivas (cercanas a 5 mUI/mL) se evaluó mediante la aplicación de una prueba t-Student (α = 0,05) comparando la fluorescencia obtenida de los CN y CP1.
Los resultados mostraron una precisión (repetibilidad) entre 9 % y 9,7 % para el control CP1, mientras que la precisión intermedia fue del 9,9 %. En concentraciones más altas, ambos parámetros de precisión oscilaron entre 6,7 % y 10,5 %. Además, no se encontraron diferencias significativas entre los resultados obtenidos por 2 analistas (t-Student, α = 0,05).
La linealidad del método se evaluó durante 3 d y los resultados se ajustaron a una regresión lineal y = ab + x (niveles de hCG entre 0 mIU/mL y 100 mUI/mL) mostrando coeficientes de correlación superiores a 0,99. La parte inferior de la curva (0 mUI/mL a 15,9 mUI/mL) mantuvo igualmente el comportamiento lineal de los datos.
El recobrado reportado por el fabricante del kit UMELISA es de 97 % a la concentración de 35 mUI/mL. En el proceso de validación en el LAH, se observaron resultados similares, siendo el valor más bajo el obtenido para el control CP1 (91 %), probablemente causado por un efecto de matriz más pronunciado. La especificidad se evaluó en muestras que contenían concentraciones elevadas de LH, TSH y niveles altos de andrógenos (pero negativos a la presencia de esteroides sintéticos). En todos los casos las respuestas fluorométricas fueron comparables a las del control negativo.
 Fuente: Laboratorio Antidoping de La Habana
Fuente: Laboratorio Antidoping de La Habana Fig. 3 . Esquema aplicado por el laboratorio para la validación del ensayo para la detección de hCG total en muestras de orina aplicando la tecnología SUMA. Leyenda: control negativo (CN); controles positivos de bajas concentraciones de hCG (CP1 y CP2), controles positivos de altas concentraciones de hCG (CP3 y CP4).
Los resultados obtenidos son coherentes con el trabajo de Del Valle y cols, que describe detalladamente la preparación y validación del kit UMELISA para mediciones de hCG según la tecnología SUMA, usado en los servicios de salud pública de Cuba. 37
Los resultados de la validación le permitieron al LAH la aplicación del método SUMA UMELISA HCG para determinar la fracción total de hCG en orina, cumpliendo con los requisitos según el TD2021CG/LH de la AMA con una alta relación costo beneficio. 8 Los resultados de esta aplicación del SUMA UMELISA fueron publicados por Martínez y cols. 56
Validación del ensayo usando el analizador Elecsys cobas e411
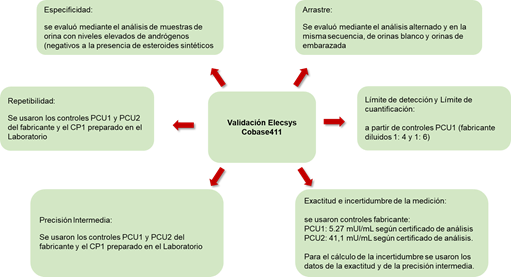
A diferencia del kit UMELISA HCG, el analizador Elecsys cobas e411 y su kit STAT HCG están diseñados para niveles bajos de hCG. Por tanto, los resultados de la validación se encontraron en línea con lo reportado por el fabricante. Además de los controles del kit, se adicionaron los controles CP1, una orina de embarazada con altas concentraciones de hCG y el control del fabricante PCU1 diluido 1:4 y 1:6. En el proceso de validación se verificaron la especificidad, precisión, exactitud, arrastre, límites de cuantificación y detección e incertidumbre combinada estándar. En la figura 4 se muestra el esquema general del proceso de validación aplicado.
 Fuente: Laboratorio Antidoping de La Habana.
Fuente: Laboratorio Antidoping de La Habana.Fig. 4 . Esquema aplicado por el laboratorio para la validación del ensayo para la detección de hCG total en muestras de orina aplicando la tecnología SUMA. Leyenda: PCU: control precicontrol universal; BLOR: blanco de orina, ORP2: orina positiva 2, ORP3: orina positiva 3
Los resultados de validación mostraron que bajo las condiciones del LAH, la precisión (repetibilidad) se mantiene entre 1,9 % y 8,4 % y la precisión intermedia entre 5,6 %y 9,9 % para las 3 concentraciones ensayadas. La exactitud se encontró entre 90 % y 92 % y la incertidumbre combinada fue de 13,8 % (equivalente a 0,73 mUI/mL) al nivel umbral y para concentraciones superiores fue de 13,6 % (equivalente a 0,56 mUI/mL). El análisis de alícuotas de orina de embarazada (concentración de hCG superior a 6000 mUI/mL) intercaladas con muestras negativas, no mostró signos de contaminación del sistema de medición. El límite de cuantificación (1,16 mUI/mL, CV = 9.3 %, n = 9) cumplió con el requisito del TD2021GH/LH (debe ser ≤ 2 mUI/mL, CV ≤ 20 %). El LD fue de 0,61 mUI/mL (CV = 9,5 %, n = 9).
Evaluación de la concordancia entre ambos ensayos
La aplicación de la tecnología SUMA con propósitos del control del dopaje se realizó por primera vez en el LAH en el año 2016. Teniendo en cuenta que las bajas concentraciones exigidas por la AMA para detectar hCG (5 mUI/mL) son inferiores a la aplicabilidad del kit UMELISA, se evaluó la eficacia y equivalencia del método con el analizador Elecsys cobas e411; según la metodología descrita por el Prof. Dr. Ochoa del Instituto Carlos J. Finlay en 2008. 61
La capacidad diagnóstica del SUMA se evaluó mediante la determinación de la sensibilidad relativa, la especificidad relativa, el valor predictivo positivo, el valor predictivo negativo y el nivel de eficacia y concordancia (equivalencia) en comparación con el ensayo del Elecsys cobas e411. La eficacia y concordancia del método se evaluaron usando el índice Kappa de Cohen, un parámetro estadístico robusto utilizado en las pruebas de fiabilidad, para evaluar el nivel de concordancia entre 2 ensayos. La sensibilidad del ensayo puede definirse como la proporción de muestras positivas identificadas correctamente por el ensayo utilizado, mientras que la especificidad es la proporción de muestras negativas identificadas correctamente.
El “valor predictivo positivo” (VPP) se define como la probabilidad de que, para cualquier muestra positiva real, la prueba produzca resultados positivos, mientras que el “valor predictivo negativo” (VPN) es la probabilidad de que, para cualquier muestra negativa real, las pruebas produzcan resultados negativos.
La “eficiencia” es la capacidad de un ensayo para detectar correctamente todos los positivos y negativos. Es decir, se alcanza una eficiencia óptima en un ensayo que no produzca falsos positivos ni falsos negativos. Los resultados obtenidos en la evaluación de la eficacia del método SUMA UMELISA HCG en comparación con el método de referencia usando el analizador Elecsys cobas e411-STAT HCG fue publicado por Martínez y cols. 56
Para esta evaluación se emplearon muestras de CN y CP del ensayo, orina de embarazada en diferentes diluciones, muestras de atletas masculinos y los controles empleados en la validación. Los parámetros de sensibilidad relativa (100 %), especificidad relativa (97,1 %), VPP (88,1%, VPN (100 %) y la eficacia (97,6 %) mostraron resultados óptimos. El valor del índice Kappa de 0,92 mostró la fiabilidad del ensayo SUMA UMELISA.
El parámetro con menor valor fue el VPP con 88,1 %. Este resultado se relacionó con 12 muestras clasificadas como positivas cuando se aplicó el ensayo SUMA UMELISA, pero resultaron negativas después del análisis con el ensayo HCG STAT. Mientras que UMELISA mide la hCG total, incluyendo la cadena β- libre y los fragmentos de la hCG, la STAT solo mide la hCG intacta. Por tanto, una muestra con alta concentración de fragmentos (ejemplo: muestra degradada), será positiva por el método SUMA-UMELISA HCG, pero negativa al aplicar el método Elecsys cobas e411 STAT HCG. La aplicación de la segunda técnica reduce el riesgo de reportar un resultado falso positivo por el laboratorio.
Control de la calidad de los ensayos
Las cartas o gráficos de control son un método ampliamente usado en la industria, en los laboratorios de ensayo, clínicos y de calibración para monitorear las desviaciones de un ensayo. Las mismas son representaciones gráficas de datos de acuerdo con determinadas reglas de construcción que permiten: demostrar el estado del control estadístico del sistema analítico, realizar el seguimiento de un proceso de medición, diagnosticar problemas de la medición y aportar información sobre la incertidumbre de la medición. 58,60
En instrumentos modernos como el Elecsys, la confección, el uso y la interpretación de las cartas de control, son ejecutadas por el software del instrumento. Las desviaciones de los valores son dados a conocer al usuario mediante mensajes en la pantalla que son señalizados en color rojo. Si la desviación atenta contra la calidad de los resultados, el instrumento automáticamente se bloquea, y para su uso se requiere de una revisión del sistema en su conjunto. 38
En el caso del ensayo SUMA-UMELISA HCG, el laboratorio desarrolló las cartas de control para observar las desviaciones en el análisis del control negativo BLOR y los controles positivos ORP3 y ORP2. Utilizando los valores de fluorescencia obtenidos para el BLOR, se construyó una gráfica de control con un intervalo de aceptación de la media + 2 veces la desviación estándar (X + 2 DE). Al comparar las respuestas del BLOR y el ORP3, se observaron diferencias significativas entre los valores de fluorescencia (prueba t-Student, α = 0,05), confirmando la capacidad del ensayo para detectar hCG en concentraciones cercanas a 5 mUI/mL y diferenciarlo de las respuestas de fondo (figura 5).
Además, el valor X-2DE de la respuesta del ORP3 no se superpone con el valor correspondiente X + 2 DE del BLOR, y se distinguen fácilmente entre sí (95 % de confianza). Basado en estos datos de fluorescencia, el límite de detección del ensayo se puede estimar como el valor XBLOR + 2 DEBLOR, es decir; 2,7 mUI/mL de hCG total. Este valor se considera adecuado para el ensayo de prescreening.
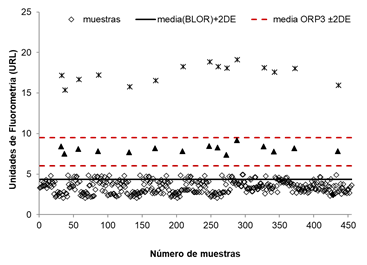 Fuente: Martinez y cols, 2018 56
Fuente: Martinez y cols, 2018 56
Fig. 5 . Carta de control simultaneo del control negativo BLOR y positivos ORP3 (triángulo negro), ORP2 (asterisco) y muestras (rombos).
Conclusiones
La hCG continúa siendo una opción para los atletas que intentan doparse. La recuperación gradual y rápida de los niveles endógenos de T favorece el equilibrio hormonal y disminuye las probabilidades de detección debido a su capacidad de no alterar ciertos biomarcadores de dopaje.
Los ensayos de detección de la hormona descritos en la literatura abarcan una amplia gama de inmunoensayos. La introducción de la cromatografía líquida acoplada a espectrometría de masas se ha convertido en una técnica atrayente por la posibilidad de diferenciar la forma recombinante de la forma fisiológica de la hormona, todavía por establecerse.
La estrategia de análisis del LAH, siguiendo la normativa de la AMA, se basa en un ensayo de prescreening usando la tecnología SUMA-UMELISA de producción nacional, que determina la fracción total de la hormona mediante la técnica de fluorometría. Con ello se descartan las muestras negativas en un ensayo rápido, efectivo y menos costoso. En caso de sospecha de dopaje de hCG, la cuantificación de la fracción intacta de la hormona se realiza mediante un ensayo electroquimioluminiscente con el uso del analizador Elecsys cobas e411 de la firma alemana Roche]®. Aunque ambos ensayos abarcan un rango de detección acorde a la normativa vigente por la AMA, el laboratorio posee capacidad analítica para la implementación de la técnica CL-EM para la detección de la hormona lo cual aumentaría la exactitud y la precisión de los resultados.