Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina General Integral
versión impresa ISSN 0864-2125
Rev Cubana Med Gen Integr vol.27 no.2 Ciudad de La Habana abr.-jun. 2011
TRABAJOS ORIGINALES
Eventos adversos de la vacuna cubana antimeningocóccica
Adverse events of antimeningococcal Cuban vaccine
Georgina Cruz Martínez,I Denis Verdasquera Corcho,II Adealvys Corcho Quintero,III Olga Lidia Delgado Díaz,IV Consuelo Díaz Fuentes,V Marlenis Carbó RiverónVI
IEspecialista de I Grado en Higiene y Epidemiología. Máster en Enfermedades Infecciosas. Instructora. Unidad Municipal de Higiene y Epidemiología. Caimito, Artemisa, Cuba.
IIDoctor en Ciencias Médicas. Máster en Enfermedades Infecciosas. Especialista de II Grado en Higiene y Epidemiología. Profesor e Investigador Auxiliar. Instituto de Medicina Tropical "Pedro Kourí". La Habana, Cuba.
IIILicenciada en Enfermería. Máster en Enfermedades Infecciosas. Instructora. Policlínico "Flores Betancourt". Caimito, Artemisa, Cuba.
IVEspecialista de I Grado en Pediatría. Máster en Genética Clínica. Asistente. Policlínico "Flores Betancourt". Caimito, Artemisa, Cuba.
VEspecialista de I Grado en Pediatría. Instructora. Policlínico "Flores Betancourt". Caimito, Artemisa, Cuba.
VIEspecialista de I Grado en Dermatología y Medicina General Integral. Máster en Enfermedades Infecciosas. Instructora. Policlínico "Flores Betancourt". Caimito, Artemisa, Cuba.
RESUMEN
Introducción: en nuestro país hay un sistema de vigilancia exhaustivo que brinda información estadística sobre los eventos adversos a vacunas graves, menos graves y leves. Esta vigilancia es llevada a cabo por el Equipo Básico de Salud; no obstante, en muchas ocasiones al presentar estos eventos una sintomatología poco definida y de poca gravedad, pueden quedar sin diagnóstico y sin investigación.
Objetivo: caracterizar los eventos adversos a la vacuna antimeningocóccica VAMENGOC-BC® en los lactantes del municipio Caimito durante el año 2006.
Métodos: con un diseño de estudio descriptivo retrospectivo, se analizaron los 381 lactantes de 3 y 5 meses de edad que recibieron de forma programada la vacuna VAMENGOC-BC® según esquema nacional en el año 2006. El instrumento que se empleó para la recogida de la información de las historias clínicas fue la Encuesta Epidemiológica de Eventos Adversos a la Vacunación, establecida por el Programa Nacional de Inmunización.
Resultados: de los 381 lactantes que recibieron la vacuna en ese año, hubo 17 con eventos adversos. El mayor porcentaje fue después de administrar la primera dosis (3,01 %). Las manifestaciones locales más frecuentes fueron dolor en el sitio de la inyección con un 50,00 % después de la primera dosis y la induración (66,67 %) después de la segunda. Los eventos adversos sistémicos más frecuentes en la primera dosis fueron la fiebre (54,55 %) e irritabilidad (27,27 %). La incidencia de lactantes con eventos adversos fue mayor en las primeras 72 horas (3,41 %) y en la primera dosis (2,46 %). Sin embargo, la mayoría de las manifestaciones desaparecieron en las primeras 72 horas (3,41 x cada 100 lactantes vacunados), es decir que la recuperación fue rápida.
Conclusiones: los eventos adversos locales y sistémicos fueron discretos, con predominio de los segundos, para ambas dosis de la vacuna, y fue la fiebre el evento más frecuente después de aplicadas las dos dosis. No existieron eventos adversos graves que requirieran de hospitalización, ni hubo secuelas.
Palabras clave: Eventos adversos, vacuna antimeningocóccica, eventos adversos locales, eventos sistémicos, vigilancia epidemiológica.
ABSTRACT
Introduction: in our country there is a surveillance exhaustive system offering statistical information on the severe, less severe and slight adverse events related to vaccines. This surveillance system is carried out by the Basic Health Staff; however, in many occasions, if these events have a poor defined and of less severity symptomatology they could remain without diagnosis and without research.
Objective: using the design of retrospective and descriptive study, it was possible to analyze the 381 infants aged 3 and 5 months received the programmed VAMNGOC-BC® vaccine according the national scheme in 2006. The tool used for collection of information from medical records was the Epidemiological Survey of Adverse Events of Vaccination, established by the National Immunization Program.
Results: from the 381 infants received vaccine that year, there were 17 with adverse events. The great percentage was after administration of the first dose (3,01 %). The more frequent local manifestations was pain in the injection site with 50,00 % after the first dose and induration (66,67 %) after the second one. The more frequent systemic adverse effects in the first dose were fiver (54,55 %) and irritability (27,27 %). The incidence of infants with adverse events was higher at the first 72 h (3,41 %) and in the first dose (2,46 %). However, most of manifestation disappeared during the first 72 h (3,41 by each 100 vaccinated infants, that is, that recovery was fast.
Conclusions: the local and systemic adverse events were discrete with predominance of the second ones for both doses of vaccine and the fever was the more frequent event after applied the two doses. There was neither severe adverse event requiring admission nor sequelae.
Key words: Adverse events, antimeningococcal vaccine, local adverse events, systemic events, epidemiological surveillance.
INTRODUCCIÓN
La práctica de la inmunización es tal vez la más importante intervención de salud pública sobre las enfermedades infecciosas, luego de la provisión de agua potable a la población (Cuevas I. Estudio documental retrospectivo sobre eventos adversos asociados a VAMENGOC-BC® en tres municipios de Ciudad de la Habana. Instituto Finlay; 1998). Ocupa un lugar destacado en todos los programas de salud en el mundo entero y en especial en países en desarrollo.
En 1988 fue incluida en el Programa de Inmunización la vacuna contra la meningitis meningocócica grupos B y C denominada VAMENGOC-BC®. Esta posee la proteína de la membrana externa del meningococo B y el polisacárido C, la cual induce la actividad bactericida del suero contra las cepas de los meningococos B y C, el componente proteico de VAMENGOC-BC® estimula también la actividad opsonofagocítica contra el meningococo serogrupo B. Tanto la actividad bactericida sérica como la opsonización son mecanismos importantes para la protección contra los meningococos. VAMENGOC-BC® logró controlar el primer problema de salud en Cuba en la década de los 80, la enfermedad meningocócica. La incidencia por esta enfermedad ha sufrido un descenso marcado desde 1982 hasta nuestros días. La morbilidad disminuyó un 93 % y su mortalidad en un 98 % después del período posvacunal (Cuevas I. Estudio documental retrospectivo sobre eventos adversos asociados a VA-MENGOC-BC® en tres municipios de Ciudad de la Habana. Instituto Finlay; 1998).
La introducción de la inmunización permitió beneficios al igual que en otras ocasiones: ahorro de los costos del tratamiento, reducción en la incidencia de las enfermedades y la reducción de la mortalidad. Se obtiene, además, una disminución de costos intangibles como el sufrimiento de niños y familias, una reducción del riesgo de infección, e incremento en la accesibilidad a un cuidado de salud efectivo, entre otros. No obstante, trae consigo eventos adversos, que en muchas ocasiones son a los componentes de la vacuna. La vigilancia farmacológica permite detectar, registrar, notificar y obtener información de los eventos adversos, su frecuencia de aparición, y las gravedades ocasionadas por los medicamentos después de su introducción al mercado.1-4
Nuestro país tiene un programa de inmunización con gran prestigio a escala mundial, con un sistema de vigilancia exhaustivo que brinda información estadística sobre los eventos adversos graves, menos graves y leves.1 Esta vigilancia es llevada a cabo por el Equipo Básico de Salud, no obstante, en muchas ocasiones al presentar estos eventos una sintomatología poco definida y de poca gravedad, pueden quedar sin diagnóstico y sin investigación. La razón por la que se decide realizar este estudio, específicamente en la vacuna antimeningocóccica cubana VAMENGOC-BC® es porque es una vacuna que se produce en nuestro país, y además, la única en la que se mantiene su administración por separado con relación al resto de las vacunas del esquema nacional, que permite una buena identificación de sus posibles eventos adversos. Se decide comenzar esta investigación en nuestro municipio por la escasa información y el bajo reporte de eventos adversos por parte de médicos y enfermeras de la familia por más de 5 años, que nos lleva a realizarnos la interrogante de que si existen o no eventos adversos a la vacuna antimeningocóccica cubana VAMENGOC-BC® en los lactantes vacunados del municipio Caimito. En este artículo se describen algunas características de los lactantes vacunados que presentaron eventos adversos a la vacuna, así como aquellos que requirieron ingreso hospitalario.
MÉTODOS
Bajo un diseño de estudio descriptivo retrospectivo, se analizaron los 381 lactantes de 3 y 5 meses de edad que recibieron de forma programada la vacuna referida según esquema nacional en el año 2006. Se estudiaron variables como las características sociodemográficas de los lactantes, la presencia de eventos adversos locales y sistémicos. Para la obtención de la información se revisaron las historias clínicas individuales de los consultorios, las de los hospitales (en caso de los eventos adversos que requirieron de ingreso hospitalario) y las que estaban en poder de los padres. El instrumento que se empleó para la recogida de la información de las historias clínicas fue la Encuesta Epidemiológica de Eventos Adversos a la Vacunación. Este mismo modelo se empleó para completar la información a través de las entrevistas no estructuradas realizadas a los padres.
Los eventos adversos se clasificaron según su localización: los que se presentaron en el sitio de la inyección se clasificaron como locales, y fuera de este se clasificaron como sistémicos. En el análisis de los resultados se utilizaron frecuencias absolutas, relativas y tasas como medidas de resumen de variables cualitativas.
Tasa: cada vez que se haga referencia a esta medida de frecuencia significa:
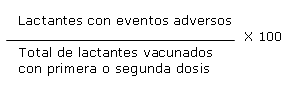
Proporción: cada vez que se haga referencia a esta medida de frecuencia significa:

RESULTADOS
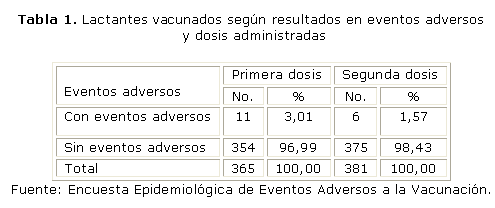
Se observaron 381 lactantes que recibieron la vacuna antimeningocóccica VAMENGOC-BC®. De ese total se registraron 17 lactantes con eventos adversos. En la tabla 1 se muestra los lactantes vacunados según resultados de eventos adversos y dosis administradas. Se puede apreciar que después de aplicada la primera dosis hubo 11 lactantes con eventos adversos para un 3,01 %, cifra superior a la registrada después de la administración de la segunda dosis, cuando hubo entonces 6 lactantes que presentaron eventos adversos, para el 1,57 %. Hay que destacar que la mayoría de los lactantes vacunados con la primera y segunda dosis no presentaron eventos adversos (primera dosis 96,99 % y segunda dosis 98,43 %).
En la tabla 2 se muestran los lactantes con eventos adversos según dosis administradas y período de inicio. En ella se observa que las tasas fueron mayores en las primeras 72 h (3,41 %) y en la primera dosis (2,46 %). La incidencia de lactantes con eventos adversos en el período de 73 h a 10 días, fue similar en ambas dosis (0,55 % en la primera dosis y 0,52 % en la segunda dosis).
Los lactantes con eventos adversos según dosis administradas y tiempo de duración se aprecian en la tabla 3. Las mayores tasas de lactantes con eventos adversos fueron aquellas en que las manifestaciones desaparecieron en las primeras 72 h (3,41 x cada 100 lactantes vacunados), y fueron menores aquellas en que las manifestaciones duraron de 73 h a 10 días (1,05 x cada 100 lactantes vacunados). No se registraron lactantes con manifestaciones que tuvieran una duración mayor de 10 días, y se comportó de igual manera después de la aplicación de ambas dosis. Del total de eventos adversos ocurridos en 2006, los sistémicos fueron los que tuvieron una mayor expresión, con un 72,0 %, y le siguen los locales con un 28,0 %. Los eventos con manifestaciones sistémicas tuvieron valores similares para ambas dosis (73,33 % y 70,0 %), y los locales se incrementaron en la segunda dosis (30 %).
En la tabla 4 se muestran los eventos locales según diagnóstico y dosis administradas. El comportamiento de los eventos adversos locales fue prácticamente similar tras la aplicación de ambas dosis, con la diferencia solamente de un evento. Los eventos adversos predominantes fueron el dolor y la induración en el sitio de la inyección, con un 42,86 % en ambos casos. Después de la aplicación de la primera dosis las manifestaciones más frecuentes fueron, en orden decreciente, el dolor en el sitio de la inyección con un 50,00 %, y la induración y el eritema en el sitio de la inyección con un 25,00 % cada uno. En la segunda dosis fue la induración el evento adverso de mayor cuantía con un 66,67 %.
En la tabla 5 se aprecian los eventos adversos sistémicos según diagnóstico y dosis administradas. Hubo un predominio de eventos adversos posterior a la primera dosis en relación con la segunda dosis. Del total de eventos adversos registrados, los eventos que mayores valores presentaron fueron la fiebre y la irritabilidad para un 50,00 % y 22,22 % respectivamente. Los eventos adversos sistémicos más frecuentes en la primera dosis fueron la fiebre (54,55 %) y la irritabilidad (27,27 %). El evento adverso sistémico que en mayor por ciento se registró después de aplicada la segunda dosis fue la fiebre (42,84 %), la irritabilidad, la pérdida del apetito, el rash y la tos aportaron solo un caso, para un 14,29 % respectivamente después de aplicada la segunda dosis. No existieron eventos adversos graves que requirieran de hospitalización, ni hubo secuelas de los mismos.
DISCUSIÓN
La mayor parte de los lactantes que presentaron eventos adversos lo hicieron después de la administración de la primera dosis (3,01 %). Al comparar este resultado con el estudio nacional llevado a cabo en 3 municipios de La Habana sobre los eventos adversos a VAMENGOC-BC®, pudimos observar que los eventos ocurridos después de la administración de la primera dosis también fueron mayores que los observados con la segunda dosis.1 Es probable que exista una relación con la respuesta inmune del organismo a la primera dosis, ya que después de su administración es cuando ocurre el primer contacto del antígeno vacunal con el sistema inmunológico del organismo, y por ello, la respuesta es mucho mayor con respecto a la segunda dosis, aunque existen estudios que refieren que los eventos adversos se incrementan a medida que se incrementan las dosis.1,3-6 Cuando ello no ocurre (efecto dosis-respuesta), la posibilidad de una asociación entre el medicamento y el evento, disminuye.
De los 17 lactantes con eventos adversos, 9 se presentaron en el sexo masculino y 8 en el femenino, para un 52,94 % y un 47,06 % respectivamente. Existió una diferencia mínima entre ambos sexos después de la administración de las 2 dosis de la vacuna. Este resultado no ha sido estudiado en investigaciones nacionales e internacionales para el caso particular de la vacuna antimeningocóccica.
El Centro de Control de Enfermedades (CDC) de Atlanta ha referido que al parecer los eventos adversos de las vacunas inactivadas no guardan relación con el sexo.6 El riesgo de que los lactantes tuvieran eventos adversos en las primeras 72 h fue mayor (3,41 x cada 100 lactantes vacunados), que para el período de 73 h a 10 días, y fue en la primera dosis en la que hubo más lactantes con eventos adversos en la primeras 72 h (2,46 x cada 100 lactantes vacunados). Las mayores tasas de lactantes con eventos adversos fueron aquellas en que las manifestaciones desaparecieron en las primeras 72 h (3,41 x cada 100 lactantes vacunados).
Del total de eventos adversos ocurridos en 2006, los solicitados sistémicos fueron los que tuvieron una mayor expresión, con un 52,94 %, y le siguen los no solicitados (26,47 %). Los eventos con manifestaciones sistémicas tuvieron valores similares para ambas dosis (52,38 % y 53,84 %), mientras los no solicitados fueron superiores en la primera dosis (28,57 %) y los locales se incrementaron en la segunda dosis (23,08 %).
Lo observado en el estudio en La Habana fue similar a lo obtenido en este estudio. En investigación realizada en Nueva Zelandia con la vacuna antimeningocócica A+C los valores de eventos sistémicos estuvieron en 0,16 %,7 y fueron, a su vez, las manifestaciones predominantes.
En niños vacunados con la vacuna cuadrivalente A/C/Y/W135 en Atlanta, Estados Unidos hubo un 2 % de eventos sistémicos,7 y en Pittsburgh, fueron también las manifestaciones locales las que mayores tasas mostraron.8,9 El comportamiento de los eventos adversos locales fue prácticamente similar tras la aplicación de ambas dosis, con la diferencia solamente de un evento. Los eventos adversos predominantes fueron el dolor y la induración en el sitio de la inyección con un 42,86 % en ambos casos. Después de la aplicación de la primera dosis, las manifestaciones más frecuentes fueron, en orden decreciente, el dolor en el sitio de la inyección, con un 50,00 %, y la induración y el eritema en el sitio de la inyección, con un 25,00 % cada uno. En la segunda dosis fue la induración el evento adverso de mayor cuantía, con un 66,67 %. Estos resultados difieren a los registrados en el estudio nacional anterior de VAMENGOC-BC®, en el que el eritema en el sitio de la inyección, el edema y el dolor en el sitio de la inyección fueron las manifestaciones que mostraron valores más altos.
En Filadelfia, en un estudio realizado con la vacuna antimeningocóccica, se observó que la induración fue la manifestación más frecuente,6 mientras en España2 lo más frecuente fue el dolor en el sitio de inyección, y en Nueva York6 el eritema, la inflamación y el dolor. Los eventos adversos locales pueden aparecer en algunos casos, posiblemente relacionados al adyuvante de hidróxido de aluminio. Este producto no presenta ningún peligro para el hombre, a veces van seguido de nódulos persistentes, y en los casos excepcionales de abscesos locales estériles. La formación de un pequeño granuloma es inevitable con las vacunas con adyuvantes, y debe ser considerado como una condición necesaria a la eficacia de la vacunación. Las soluciones de antígenos precipitados por el coadyuvante provocan el desarrollo de un granuloma local en el sitio de la inyección, conteniendo esencialmente macrófagos. El antígeno liberado de este depósito da lugar a una reacción inflamatoria local secundaria en el punto de inyección,8 razón por la cual consideramos que este producto pudiera estar influyendo en que estas manifestaciones locales sean las que con mayor frecuencia se presentan.
Del total de eventos adversos sistémicos registrados, los eventos que mayores valores presentaron fueron: la fiebre y la irritabilidad para un 50,00 % y 22,22 % respectivamente, comportándose de forma similar después de aplicada la primera dosis, la fiebre con un 54,55 % y la irritabilidad con un 27,27 %. El evento adverso sistémico que en mayor por ciento se registró después de aplicada la segunda dosis fue la fiebre (42,84 %). Estos datos son mayores a los observados en el estudio nacional previo (Cuevas I. Estudio documental retrospectivo sobre eventos adversos asociados a VA-MENGOC-BC® en tres municipios de Ciudad de la Habana. Instituto Finlay; 1998).
En España la fiebre fue el evento sistémico más reportado a la vacuna antimeningocócica A+C.9 En Canadá, en un estudio realizado para la antimeningocócica A+C en infantes de 2 y 3 meses, se registró la fiebre y la irritabilidad como las manifestaciones más comunes.10 En Islandia, después de la administración de la vacuna antimeningocócica para el serogrupo B, fue reportada la fiebre como el evento predominante.11 En otros estudios a escala internacional se han presentado otras manifestaciones sistémicas no registradas en nuestra investigación, como son la anafilaxia con la vacuna antimeningocócica AC en Canadá.10
Con todos estos resultados se pudo concluir que en el municipio existen eventos adversos a la vacuna antimeningocóccica, con predominio de los eventos adversos sistémicos, y de estos, la fiebre como el que más prevaleció. De los eventos adversos locales, el dolor y la induración en el sitio de la inyección fueron los eventos más frecuentes. No existieron diferencias apreciables por sexo. La mayoría de los eventos se iniciaron en las primeras 72 h, y se resolvieron en 72 h también. No existieron eventos adversos graves que requirieran de hospitalización, ni hubo secuelas de estos. Queda demostrado que la vigilancia en la APS debe mejorar con relación a esta pesquisa y se deben trazar estrategias encaminadas a este fin.
REFERENCIAS BIBLIOGRÁFICAS
1. Rosenstein N. Efficacy of meningococcal vaccine and barriers to vaccination [monografía en internet]. Abstracts February 11, 2005 [citado 22 de octubre de 2009]. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/9466635
2. González EJ. Efficacy of the meningococcal vaccine from group C capsular plysaccharide. Agencia de evaluación de tecnologías sanitarias. Rev Española Salud Pública. 2006;71(2):103-26.
3. Gonzáles Enriquez J. Efficacy of the meningococcal vaccine from Group C capsular polysaccharide. Rev Española Salud Pública. 2005;71(2):103-26.
4. Rosenstein N. Efficacy, Safety, and Immunogenicity of a Meningococcical Group B. Inquire. 2005;15(3):1-3.
5. Renault P. Meningococal diseases in Holiday settings: Summer 1998. Eurosurveillance weekly. 2004;2:98-111.
6. Meningococcal Disease [homepage en internet]. Atlanta: Centers for Diseases Control and prevention; 2006 [citado 20 de octubre de 2009]. Disponible en: http://www.cdc.gov/mmwr/preview/mmwrhtml/rr5407a1.htm
7. Hood DA, Edwards IR. Meningococcal vaccine do some chlidren experience side effects? Med J. 2004;102(862):65-7.
8. Ajjan N. Los coadyuvantes de la inmunidad. Las vacunaciones. 2da. edición. París: Institut MÉRIEUX, Un líder de la Biolog; 2006. p. 16.
9. Diez DJ, Albert A, Valdivieso C, Ballestes A, Diez LV, Morant A. Adverse events after polysaccharide meningococcal A & C vaccine. Vaccine Institute of Valencia. Scand J Infect Dis. 2007;30(6):636-8.
10. Halperin SA. Safety and Immunogenicity of two a cellular pertussis vaccines with different pertussis toxoid and filamentous hemagglutinin content in infants 2-6 months old. Scand J Infect Dis. 2005;27(3):279- 87.
11. Brien H. Reactogenicity of two outer membrane protein- based serogroup B meningococcal vaccines among young adults in Reykjauík, Iceland. Proceedings of the Ninth International Pathogenic Neisseria Conference. England; 2005;5-7.
Recibido: 8 de enero de 2010.
Aprobado: 28 de enero de 2010.
Georgina Cruz Martínez. Unidad Municipal de Higiene y Epidemiología de Caimito. Avenida 43 s/n, entre 34 y 36 A, Caimito, Artemisa, Cuba. Correo electrónico: georcruz@infomed.sld.cu