Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Cirugía
versión On-line ISSN 1561-2945
Rev Cubana Cir v.36 n.3 Ciudad de la Habana sep.-dic. 1997
Hidroxiapatita en la estabilización y fusión intervertebral cervical baja
Dr. Ramiro Pereira Riverón, Dr. Enrique de Jongh Cobo, Dr. Juan Carlos Bermejo Sánchez2 y Dra. Susana A. Fernández Benítez1 Doctor en Ciencias Médicas. Especialista de II Grado en Neurocirugía.
2 Especialista de I Grado en Neurocirugía.
3 Especialista de I Grado en Neurología.
RESUMEN
Se realizó ensayo clínico el cual incluyó a 10 pacientes con lesiones cervicales bajas (C3/7), traumáticas o degenerativas y que requirieron implantes para sustituir discos intervertebrales, y en los que se utilizaron láminas de hidroxiapatita de 3 y 6 mm de espesor y porosidad de 50 %, de fabricación nacional. En 9 casos se obtuvo estabilidad y osteoconducción adecuadas, evaluadas por medio de controles clínicos y radiológicos. Se verificó en nuestro medio, la eficacia de la hidroxiapatita como implante para lograr la fusión intersomática vertebral, como sustituta eficiente de los injertos óseos autógenos, al evitar sus complicaciones habituales. Se recomienda su empleo y la fabricación de implantes de hidroxiapatita de configuración y dimensiones más específicas.Descriptores DeCS: IMPLANTE ENDOOSEO/métodos; HIDROXIAPATITAS/uso terapéutico; VERTEBRAS CERVICALES/cirugía; DISCO INTERVERTEBRAL/trasplante.
En las intervenciones sobre la columna cervical, tanto por lesiones traumáticas como no traumáticas, es frecuente la necesidad de emplear injertos, para sustituir cuerpos vertebrales o discos incompetentes. Los de mayor uso son los que se obtienen de fragmentos de hueso autógeno, de cresta ilíaca, bóveda craneal o costillas.
Hay varios problemas con estos injertos óseos: requieren una operación adicional sobre el paciente, con mayor pérdida de sangre; hay más posibilidades de sepsis y dolor. En el posoperatorio pueden aparecer inestabilidad pélvica, fractura por fatiga, hernia del músculo ilíaco, fístulas y lesión ureteral, complicaciones que pueden provocar un retraso en la rehabilitación del paciente.1-5
Es por todo ello que se ha experimentado con el uso de materiales biocompatibles y biointegrales que sean sustituidos por hueso endógeno y entre ellos, ocupan un lugar muy importante las cerámicas de fosfatos de calcio.
La hidroxiapatita (HA) ha sido empleada con éxito como implante en operaciones de la columna, en los últimos 10 años,6-9 pero, en Cuba, no hay experiencia documentada sobre su empleo en este tipo de operaciones.
Motivados por los buenos resultados de su empleo en cirugía maxilofacial en nuestros hospitales, decidimos en 1990 obtener bloques de HA para emplearlos como implantes, en sustitución de cuerpos vertebrales o discos incompetentes; verificar su resistencia y capacidad para orientar y facilitar que el hueso nuevo llegue hacia la región afectada, es decir, sus posibilidades osteoconductoras.
Su aplicación práctica sólo se pudo comenzar en 1993, al obtener láminas de HA fabricadas por el Centro de Biomateriales de la Universidad de La Habana.
En este trabajo se informan las primeras experiencias de su empleo en un ensayo clínico, para verificar si las láminas de HA de 3 y 6 mm de espesor y porosidad del 50 % tienen la resistencia necesaria para ser empleadas como implantes en la columna cervical baja (C3 a C7), para sustituir discos intervertebrales incompetentes.
MÉTODOS
Ensayo clínico prospectivo que incluyó a todos los pacientes atendidos en el Servicio de Neurocirugía del Hospital Universitario "General Calixto García", por el grupo de trabajo integrado por los autores; con lesiones cervicales de C3 a C7 que requirieron sustitución quirúrgica de discos intervertebrales para lograr fusión somática y, en algunos casos, estabilización con fijación interna, por lesiones traumáticas o no traumáticas (mielopatía espondilótica o hernias discales cervicales), en pacientes operados durante 1994 y 1995.Los implantes utilizados en nuestra serie, fueron fabricados a partir de bloques de HA sintética denominada POROSIT, que se produce en el Centro de Biomateriales de la Universidad de La Habana. Este material ha pasado satisfactoriamente una serie de ensayos "in vitro" e "in vivo" que demostraron su carencia de citotoxicidad10 y de actividad hemolítica, así como su biocompatibilidad.11
Para la obtención de éstos se emplearon como materias primas el hidróxido de calcio, y el ácido ortofosfórico, los que se hicieron reaccionar en condiciones controladas de acuerdo con la siguiente ecuación química:
10Ca (OH)2(n) + 6H3PO4 (an) -Ca 10 (PO4)6 (OH) 2(n) + 10 H20
y se obtuvo un polvo que posteriormente fue modelado en láminas, con una porosidad del 50 % y las siguientes medidas: largo 22 mm; ancho 9 mm y espesor 3 mm, y bloques de 22 x 9 x x 6 mm.
DESCRIPCIÓN DE LA TÉCNICA QUIRÚRGICA
Se realizó abordaje anterolateral a la región cervical. Después de exponer la cara anterior de los cuerpos vertebrales y de haber identificado el interespacio lesionado, se realizó discectomía y descompresión, en dependencia del caso y se colocaron las láminas de HA (figura), después de modelarlas y se
ajustaron a la profundidad del espacio, en sustitución del disco intervertebral. Sólo se empleó la técnica de instrumentación con osteosíntesis, en pacientes con inestabilidad de columna cervical. En estos casos se utilizaron láminas metálicas tipo A-O "Senegas" y tornillos que incluyeron las corticales anteriores y posteriores de los cuerpos vertebrales adyacentes.
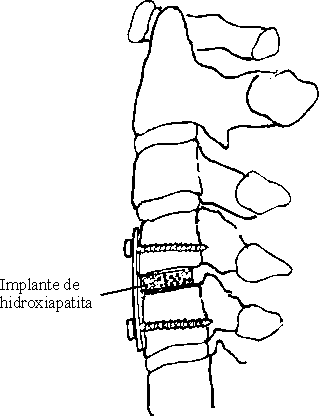
DESCRIPCIÓN DE LOS CONTROLES
Control clínico bimensual para detectar deformidades y/o posturas anormales cervicales y posibles reacciones indeseables: irritación local, infecciones o evidencias de compresión neural por incompetencia del implante.Control radiológico: radiografías simples en igual tiempo que el control
clínico, para detectar signos de resorción u osteomielitis, desplazamientos y/o aplastamientos del implante, luxación vertebral, cifosis u otras alteraciones atribuibles al implante, así como "osteo-conducción aparente", y se aceptó como tal, la desaparición imagenológica de la interfase hueso-implante y desaparición o disminución de la porosidad de la HA.
ESCALA DE RESULTADOS
Excelentes: Estabilidad y osteoconducción aparente adecuada.Buenos: Se logró estabilidad pero la osteoconducción fue parcial.
Regulares: Se logró estabilidad u osteoconducción aparente.
Malos: No se obtuvo ninguna de las 2 anteriores o el cuadro clínico del paciente empeoró por causa atribuible a incompetencia del implante.
RESULTADOS
En esta serie se incluyeron 10 pacientes. El promedio de edad fue de 39 años: el menor con 21 y el mayor con 53 años. Predominó el sexo masculino, con 8 pacientes. El tipo de lesión mayoritaria en esta serie fue traumática, con 7 pacientes y, en 3, fue no traumática.El injerto fue colocado en el espacio C3/4 en 2 pacientes, C4/5 en 3 casos, C5/6 en 3 y C6/7 en 4 pacientes (tabla 1).
| No | | ||||
| Trauma Paciente | | | | | |
| 1. AAG | | | | | |
| 2. JRP | | | | | |
| 3. IGM | | | | | |
| 4. RMG | | | | | |
| 5. AHD | | | | | |
| 6. GLT | | | | | |
| 7. MMD | | | | | |
| 8. APA | | | | | |
| 9. REG | | | | | |
| 10. JGR | | | | | |
No trauma: lesión degenerativa del disco.
En 2 pacientes (4 y 8), se colocó implante en 2 espacios contigüos.
La tabla número 2, muestra las complicaciones detectadas en los controles clínicos y radiológicos.
En la tabla número 3, se presenta la evaluación de la estabilidad y osteoconducción aparente, realizada en los controles clínicos y radiológicos.
En la tabla número 4, se relacionan los resultados obtenidos en el conjunto de la serie: excelentes en 9 pacientes y buenos en 1.
| Evaluación | | |
| Excelentes | | |
| Buenos | | |
| Regulares | | |
| Malos | | |
| Total | | |
DISCUSIÓN
En la neurocirugía la HA se ha utilizado en reparación del cráneo, operaciones craneofaciales y en las fusiones espinales. Cook et al.13 en 1986 usando la HA porosa en operaciones de la columna cervical en perros, llegaron a la conclusión de que aunque se había producido infiltración vascular y neoformación ósea, su uso no era prudente en las operaciones de columna cervical, por el alto porcentaje de desplazamientos y compresiones que se observaron en su trabajo.12Koyama y Handa,7,8 sin embargo, utilizaron la HA porosa para laminoplastia en 60 pacientes con estenosis del canal, sin complicaciones con los implantes.
Recientemente Senter et al.9 investigaron el uso de la HA densa en forma de bloques en disectomía cervical anterior y fusión; compararon los resultados en 75 pacientes con injertos de hueso ilíaco, con los obtenidos en 84 casos con injertos de HA densa; encontraron que en el primer grupo había 2 pacientes con desplazamientos o compresión de los fragmentos óseos, mientras que en el segundo grupo existían 5 casos. No obstante, observaron que en los pacientes en los que se empleó hueso como injerto, ocurrieron numerosas complicaciones asociadas con la zona de donde se extrajo el injerto como: infecciones, parestesia dolorosa y dolores crónicos. Los autores concluyeron en que el empleo de HA densa en forma de bloques, puede ser superior al uso de hueso autógeno en las fusiones cervicales anteriores.
Entre 1981 y 1986 Heise et al.13 usaron HA porosa (con poros entre 200 y 600?m) para la fusión espinal en 18 pacientes, y concluyeron en que su uso era de utilidad.
La HA por sí misma no es osteogénica, pues no induce la formación de hueso en sitios ectópicos, ni estimula un crecimiento óseo más rápido en los sitios de implante.14 Pero constituye una matriz física, en la que se deposita hueso nuevo y tiene propiedades de orientación que hacen posible que el hueso llegue a sitios que, de otro modo, no hubiese alcanzado. Por eso se usa el término de osteoconducción.
La acumulación de iones de fósforo y calcio en la superficie de los implantes ocurre por la libre difusión con el hueso adyacente, por ser idénticos al del hueso natural.
Este proceso toma parte en la formación de hueso nuevo entre la superficie del implante y el tejido óseo adyacente.
Un factor importante que se tendrá en cuenta en la formación ósea es el grado de porosidad del implante. A medida que el implante es más poroso presenta más posibilidades de formación de tejido fibrovascular que posteriormente se osifica, pero también es menos resistente a la compresión y viceversa.15 En el caso de la utilización de implantes artificiales en la columna vertebral, donde existen grandes fuerzas de compresión, es necesario lograr un implante que sea lo suficientemente resistente para soportar la compresión y lo suficientemente poroso para permitir una buena restauración ósea. Es por eso que en este estudio utilizamos láminas de HA con una porosidad del 50 %.
Lo limitado de nuestra serie, de sólo 10 pacientes, impide realizar un análisis porcentual significativo. Sin embargo, la obtención de excelentes resultados en 9 de ellos y bueno en 1, es un indicador muy interesante.
Cinco de nuestros pacientes tenían una evolución posoperatoria entre 12 y 15 meses al realizar este informe. De los 5 restantes uno tiene 8 meses de evolución, 3 tienen 6 meses y uno, sólo 3.
Tres de nuestros pacientes presentaron complicaciones. En los últimos controles radiológicos del pacientes número 4, se observó el aflojamiento de uno de los 5 tornillos, pero esto no tiene relación con el implante, ni produjo cambios en su estabilidad y osteoconducción, que fueron excelentes.
El paciente número 8, en el que se emplearon implantes en 2 interespacios (C4/5/6), mostró fragmentación y migración parcial lateral de la lámina de
HA del interespacio superior; complicación informada también por otros autores.6,12 En este caso no hubo repercusión clínica y se mantuvo la estabilidad, pero la osteoconducción fue considerada parcial, en el momento del último control, porque se produjo sólo a partir de los fragmentos no migrados (tablas 2 y 3).
| Paciente | | | | | Complicación |
| 1. AAG | | | | | |
| 2. JRP | | | | | |
| 3. IGM | | | | | |
| 4. RMG | | | | | Aflojamiento de un tornillo |
| 5. AHD | | | | | |
| 6. GLT | | | | | |
| 7. MMD | | | | | Parálisis N. Recurrente |
| 8. APA | | | | | Fragmentación y migración parcial de lámina C4/5 |
| 9. REG | | | | | |
| 10. JGR | | | | |
| Paciente | | | | | | |
| 1. AAG | | | | | | |
| 2. JRP | | | | | | |
| 3. IGM | | | | | | |
| 4. RMG | | | | | | |
| 5. AHD | | | | | | |
| 6. GLT | | | | | | |
| 7. MMD | | | | | | |
| 8. APA | | | | | | |
| 9. REG | | | | | | |
| 10. JGR | | | | | | |
O: Osteoconducción aparente.
Op: Osteoconducción parcial.
En un futuro próximo, esperamos obtener implantes con la configuración y dimensiones específicas, que permitan una correlación más exacta entre las interfases injerto-hueso y una distribución vectorial más uniforme de las fuerzas dinámicas en el interespacio.
En conclusión podemos decir, que logramos utilizar HA sintética en forma de láminas y bloques de configuración y dimensiones no específicas que fueron adaptados, transoperatoriamente, para sustituir discos intervertebrales incompetentes en la columna cervical baja; verificamos que las láminas de HA de 3 y 6 mm de espesor, 9 mm de ancho y 50 % de porosidad, tienen la resistencia necesaria para ser empleadas como implantes en la columna cervical baja (C3-7) y es recomendable la fabricación de láminas y bloques de HA de configuración y dimensiones específicas para la sustitución de discos intervertebrales incompetentes.
SUMMARY
It was conducted a clinical assay of 10 patients with cervical low (C3/7), traumatic or degenerative injuries that required implants to substitute intervertebral disks. Hydroxyapatite laminae 3-6 mm thick with a porosity of 50% made in Cuba were used. Adequate stability and osteoconduction were attained in 9 cases that were evaluated by clinical and radiological controls. The efficiency of hydroxyapatite as an implant to achieve the intersomatic vertebral fusion, and as an efficient substitute of the autogenous bone grafts, was verified in our environment, on preventing its habitual complications. It is recommended its use and the making of hydroxyapatite implants of more specific configuration and dimensions.Subject headings: DENTAL IMPLANTATION, ENDOSSEOUS/methods; HYDROXYAPATITES/therapeutic use; CERVICAL VERTEBRAE/surgery; INTERVERTEBRAL DISK/ transplantation.
REFERENCIAS BIBLIOGRÁFICAS
- Blakemore ME. Fractures at cancellous bone graft donor sites. Injury 1983;14:519-30.
- Fiedlander GE. Current concepts review: bone banking. J Bone Joint Surg 1982;64A:307-11.
- Coley SP, Anderson LD. Hernias through donor sites for iliac-bone grafts. J Bone Joint Surg 1983;65A:1023-5.
- Challis JH, Lyttle JA, Stuart AE. Strangulated lumbar hernia and volvulus following removal of iliac crest bone graft. Acta Orthop Scand 1975;46:230-3.
- Escalas F, DeWald RL. Combined traumatic arteriovenous fistula and ureteral injury: a complication of iliac bone-grafting. J Bone Joint Surg 1977;59A:270-1.
- Boker DK. Anterior cervical discectomy and vertebral interbody fusion with hydroxyapatite ceramics. Preliminary results. Acta Neurochir (Wien) 1993;121:3-4.
- Koyama T, Handa J. Cervical laminoplasty using apatite beads as implants: experiences in 131 patients with compressive myelopathy due to developmental canal. Surg Neurol 1985;24:663-7.
- Koyama T. Porous hydroxyapatite ceramics for use in neurosurgical practice. Surg Neurol 1986;25:71-3.
- Senter HJ, Kortyna R, Kemp WR. Anterior cervical discectomy with hydroxyapatite fusion. Neorosur- gery 1989;25:39-43.
- Ríos M. Evaluación de la actividad citotóxica del APAFIL Departamento. de Bioquímica, Instituto Nacional de Oncología y Radiobiología;1971.
- .Evaluación de la actividad hemolítica de productos dentales. Departamento de Bioquímica, Instituto Nacional de Oncología y Radiobiología;1971.
- Cook SD, Reynolds MC, Whitecloud TS, Routman AS, Harding AF, Kay JF, et al. Evaluation of hydroxyapatite graft materials in canine cervical spine fusions. Spine 1986;11:305-9.
- Heise U, Osborn JF, Duwe F. Hydroxyapatite ceramic as a bone substitute. Int Orthop 1990;14:329-38.
- Herskovits J, Malagrino S. Calcium phosphate materials. Rev Asoc Odontol Argent 1991;36-40
- Groot K de. Effect of porosity and physicochemical properties on the stability, resortion, and strength of calcium phosphate ceramics. Ann NY Acad Sci 1988;523:227-33.
Dr. Ramiro Pereira Riverón. Hospital Universitario "General Calixto García". Calle 29 esquina a J, municipio Plaza de la Revolución. Ciudad de La Habana, Cuba.














