Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Cirugía
versión On-line ISSN 1561-2945
Rev Cubana Cir v.43 n.1 Ciudad de la Habana ene.-mar. 2004
Reporte de casos
Hospital Provincial "José Ramón López Tabrane", Matanzas
Larga sobrevida en 5 pacientes con astrocitomas malignos
Dra. Letyer Pérez Ortiz,1 Dr. Armando Rodríguez Fuentes,1 Dr. Javier Figueredo Méndez,1 Dr. Jorge Luis Rodríguez Loureiro,1 Dra. Esperanza Barroso García2 y Dra. Naydi de Armas Hernández3
Resumen
Históricamente el tiempo de supervivencia promedio de los pacientes con glioblastoma multiforme y astrocitoma anaplásico ha sido de 6 a 12 meses y de 2 a 4 años respectivamente. Muy pocos pacientes alcanzan los 5 años de operados. El propósito fue identificar algún denominador común en los pacientes con larga sobrevida y diagnóstico histológico confirmado de astrocitoma anaplásico o glioblastoma multiforme. Se estableció comunicación con los familiares de 67 pacientes operados en el Instituto de Neurología y Neurocirugía entre los años 1983 a 1992. Se analizaron la edad de los pacientes al momento del diagnóstico, la localización del tumor, el estado neurológico en el comienzo de la enfermedad y el tiempo de evolución de esta, así como el tipo de tratamiento realizado. Se halló 5 pacientes con un tiempo de supervivencia mayor de 7 años. La edad menor de 35 años, la ubicación de la lesión en el lóbulo frontal derecho y el inicio clínico sin defecto neurológico focal, así como la exéresis quirúrgica total fue la norma en el 80 % de estos casos. El Karnofsky inicial mayor de 70 puntos y el empleo de radioterapia y quimioterapia posquirúrgica fue común a todos. Los pacientes jóvenes con gliomas astrocíticos de alta malignidad ubicados en el lóbulo frontal derecho, que comienzan con un Karnofsky mayor de 70 puntos y son sometidos a exéresis quirúrgica total, radioterapia y quimioterapia posquirúrgica, tienen mayor probabilidad de prolongar su tiempo de sobrevivencia.
DeCS: GLIOBLASTOMA;SUPERVIVENCIA SIN ENFERMEDAD
Los tumores primarios del sistema nervioso central (SNC) constituyen una causa frecuente de muerte en la población adulta de cualquier lugar del mundo.1-10 Los gliomas representan más del 50 % de ellos y a pesar de múltiples estudios realizados, la historia natural de los pacientes con esta enfermedad es muy corta.
Actualmente, la Biología Molecular y la Ingeniería Genética dan pasos firmes y esperanzadores en la identificación de genes supresores tumorales y oncogenes, principales representantes en la patogénesis de los tumores cerebrales.
El astrocitoma anaplásico y el glioblastoma multiforme son lesiones astrocíticas malignas generalmente incurables. La utilización de tratamientos coadyuvantes ha prolongado la supervivencia y la calidad de vida de los pacientes con este tipo de lesión que han sido sometidos a tratamiento quirúrgico, pero la mayoría fallece antes de los 2 años de diagnosticados y tratados. Pocos pacientes están vivos a los 5 años, y el que algunos lo hagan nos motivó a buscar algún denominador común en estos enfermos, que venciendo la regla para los pacientes con diagnóstico histológico de astrocitoma anaplásico y glioblastoma multiforme se mantienen vivos después de 7 años de tratamiento multidisciplinario.
Métodos
Estudiamos retrospectivamente 67 pacientes operados en el Instituto de Neurología y Neurocirugía (INN) desde enero de 1983 hasta diciembre de 1992, con diagnóstico histológico definitivo de astrocitoma anaplásico y glioblastoma multiforme de localización intracraneal.
El estudio culminó en 1992, porque nuestro propósito fue conocer la sobrevida de los enfermos hasta 7 años después de operados. Para la selección de los pacientes que conformaron la muestra se tuvo en cuenta el diagnóstico certero de Anatomía Patológica y para ello se revisó cada informe histológico, así como las preparaciones microscópicas de aquellos pacientes que sobrevivieron 7 años después del diagnóstico definitivo.
El tiempo de sobrevida lo consideramos como el período que transcurrió desde la fecha de la operación hasta día de cierre del trabajo (31-12-99).
Los datos se obtuvieron a través de una planilla realizada al efecto y por comunicación telefónica o telegráfica con los pacientes o sus familiares.
Reporte de casos
Caso 1
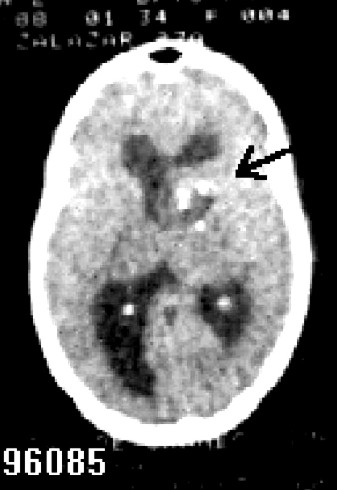
Paciente femenina, raza negra, 27 años de edad, con antecedentes de cefalea generalizada de 1 mes de evolución, que ingresa en el INN el 10-03-88 por papiledema bilateral. No historia de crisis comiciales. Escala de Karnofsky (EK) de 90 puntos. No defecto motor. No paresia de nervios craneales. Se le realizó tomografía axial computadorizada (TAC) y resonancia magnética nuclear (RMN) de cráneo, donde se observó lesión tumoral paraventricular frontal derecha, con deformidad del ventrículo ipsolateral e hidrocefalia (figs.1,2 ).
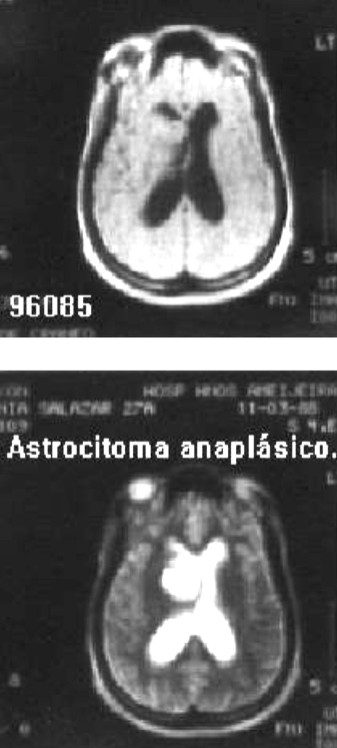
Fig. 1 a y b. A: renosancia magnética nuclear de una paciente de 27 años de edad que comienza con hipertensiòn endocraneana; B: se observa lesión tumoral paraventricular frontal derecha que provoca hidrocefalia y deformidad ipsolateral del ventrículo lateral.
Fig. 2. Tomografía axial computadorizada de cráneo de la misma paciente, portadora de un astrocitoma anaplásico que se extirpò, y recibió posteriormente radioterapia y quimioterapia. A los 11 años de diagnóstico y tratamiento se mantiene asintomática y con buena calidad de vida.
Se realizó craneotomía osteoplástica frontal derecha y exéresis total de la lesión que resultó ser un astrocitoma anaplásico. Recibió radioterapia y quimioterapia. A los 11 años de operada vive con una EK de 90 puntos.
Caso 2
Paciente de 66 años de edad, masculino, negro, con antecedentes de salud hasta 3 meses previo a su ingreso, que comenzó a quejarse de trastornos del equilibrio e hipoacusia izquierda. En el examen físico neurológico se detectó dismetría izquierda, ataxia y la hipoacusia referida. Se realizó RMN de cráneo, donde se apreció en el hemisferio cerebeloso izquierdo una lesión hipointensa en T1 e hiperintensa en T2, de bordes regulares y con crecimiento al ángulo pontocerebeloso ipsolateral. Se efectuó craneoctomía de fosa posterior izquierda y exéresis tumoral total. Anatomía Patológica informó que se trataba de un astrocitoma anaplásico. Recibió radioterapia y quimioterapia. Tiempo de supervivencia: 10 años.
Caso 3
Paciente masculino, blanco, de 22 años de edad, con antecedentes de epilepsia tonicoclónica generalizada de 6 años de evolución. Ingresa en el INN el 24-07-90 por incremento en la frecuencia de las crisis. En el examen físico neurológico no se detectaron signos focales. No evidencia de hipertensión endocraneana (HEC) ni paresia de nervios craneales. Reflectividad normal. TAC de cráneo con lesión hiperdensa frontal derecha con poco edema perilesional y sin desplazamiento de las estructuras de la línea media. Se le realizó craneotomía osteoplástica frontal derecha el 1-08-90 y exéresis total de la lesión que resultó ser un glioblastoma multiforme. Recibió radioterapia y quimioterapia. A los 9 años del diagnóstico y tratamiento vive con una EK de 90 puntos y sin evidencia de recidiva tumoral en los estudios imagenológicos evolutivos.
Caso 4
Varón de 34 años de edad, negro, que ingresa el 29-03-91 con el antecedente de crisis parciales motoras de hemicuerpo izquierdo de 4 años de evolución. Examen físico neurológico sin evidencia de defecto motor focal. No trastorno de la esfera psíquica. No alteración de nervios craneales. No clínica de HEC. TAC de cráneo en 1987, 1988 y 1989 sin evidencia de lesión tumoral. El 25-03-91 se realizó nuevo estudio tomográfico y se observó lesión hipodensa frontal derecha, de bordes regulares, sin edema peritumoral y sin desplazamiento de las estructuras de la línea media. No modificación de la lesión posterior a la administración de contraste endovenoso. El 1-04-01 se le hizo biopsia de la lesión y resultó ser un astrocitoma anaplásico. Veintiún días después se decidió reintervenir, y se le efectúa exéresis de aproximadamente el 50 % de la lesión tumoral. Recibió radioterapia y quimioterapia. Tiempo de supervivencia: 8 años. EK en 80 puntos.
Caso 5
Paciente femenina, blanca, de 20 años de edad con antecedentes de cefalea generalizada difícil de aliviar con la terapéutica habitual y de 7 meses de evolución. Ingresó el 1-5-92 y se le detecta en el examen físico neurológico una hemiparesia izquierda con hiperreflexia ipsolateral y en la fundoscopia ambas papilas de bordes borrosos, sin latido venoso presente. No evidencia de otra alteración en el examen físico. TAC de cráneo con lesión hiperdensa frontoparietal derecha y edema peritumoral que desplazaba las estructuras de la línea media > de 5 mm. Se le realizó craneotomía osteoplástica frontoparietal derecha y exéresis total. El diagnóstico histológico definitivo fue de un glioblastoma multiforme. Recibió radioterapia y quimioterapia. Actualmente vive con una EK de 90 puntos y a los 7 años de operada no existe evidencia clínica ni imagenológica de recidiva tumoral (tablas 1 y 2).
Tabla 1. Sumario clínico de los 5 pacientes con sobrevida mayor de 7 años.
| No. caso | Edad(años) | Raza | Clínica preoperatoria | Tiempo de evolución | Localización de la lesión |
| 1 | 27 | N | Papiledema | 1 mes | Frontal derecho |
| 2 | 66 | N | Síndrome cerebeloso | 3 meses | Cerebelo |
| 3 | 22 | B | Crisis convulsivas generalizadas | 72 meses | Frontal derecho |
| 4 | 34 | N | Crisis convulsivas parciales | 48 meses | Frontal derecho |
| 5 | 20 | B | Defecto motor | 7 meses | Fronto - Parietal derecho |
Fuente: Planillas de recopilación de datos.
Tabla 2. Características generales de los 5 pacientes con larga sobrevida.
| No. de caso | Karnofsky inicial | Resección quirúrgica | Diagnóstico histológico | Radioterapia y quimioterapia | Tiempo de supervivencia (años) |
| 1 | 90 | Exéresis total | Astrocitoma anaplásico | Sí | 11 |
| 2 | 70 | Exéresis total | Astrocitoma anaplásico | Sí | 10 |
| 3 | 80 | Exéresis total | Glioblastoma multiforme | Sí | 9 |
| 4 | 90 | Exéresis parcial | Astrocitoma anaplásico | Sí | 8 |
| 5 | 70 | Exéres total | Glioblastoma multiforme | Sí | 7 |
Fuente: Planillas de recopilación de datos.
Discusión
El astrocitoma anaplásico y el glioblastoma multiforme son los más frecuentes de los tumores astrocíticos. Históricamente la media del tiempo de supervivencia para los pacientes con este diagnóstico ha sido de 6 a 12 meses y de 2 a 4 años respectivamente.1-3, 8-14 En nuestro estudio 5 pacientes sobrepasaron los 7 años de diagnosticados y tratados.
Muchos factores se han invocado para predecir pronóstico y tiempo de supervivencia en los pacientes con gliomas malignos. La edad menor de 40 años, la alta graduación de la EK inicial y el grado histológico de la neoplasia son los más universalmente aceptados,1-3,7-11,15-21 y fue la epilepsia como forma de comienzo de la enfermedad, el empleo de radioterapia y quimioterapia posterior a la cirugía, la resección quirúrgica extensa, la duración de los síntomas más de 6 meses, la presentación clínica con ausencia de trastornos de la esfera psíquica o defecto motor y la localización del tumor en la región frontal u occipital, menos constantes.
De nuestros 5 pacientes, sólo 1 era mayor de 40 años, por lo que defendemos la fuerte relación recíproca entre la edad joven al momento del diagnóstico de la enfermedad y un mayor tiempo de supervivencia.
Estudios moleculares han identificado en los pacientes jóvenes con glioblastoma, una mayor incidencia de deleciones en el cromosoma 17p y mejor pronóstico que en los pacientes ancianos con este tipo de tumor, donde lo que ha predominado es la amplificación del gen receptor del factor de crecimiento epidérmico (EGF).1
Desde 1940 Scherer notó una corta duración en el tiempo de sobrevida de los pacientes con glioblastoma de novo, precisamente porque esta lesión denominada como primaria aparecía ausente de componentes bien diferenciados, de calcificaciones, de cambios microquísticos y homogéneamente compuesta por células anaplásicas pequeñas.
Este tipo de neoplasia, en un estudio realizado por Burger y Green17 estuvo relacionada con una corta sobrevida y fue más frecuente en los pacientes de mayor edad, donde además existe una disminución de la resistencia del huésped a la enfermedad. En este trabajo los autores hallaron una diferencia significativa en la curva de supervivencia de los pacientes jóvenes y ancianos que tenían necrosis intratumoral, y fue ésta más frecuente y determinante de una corta sobrevida en los pacientes mayores de 65 años.17-19
La necrosis intratumoral en las neoplasias astrocíticas es una evidencia histológica certera de malignidad máxima. En 1996, Barker y otros18 publicaron un estudio sobre la supervivencia de 299 pacientes con tumores diagnosticados como glioblastoma multiforme, para conocer la relación entre la presencia de necrosis y el tiempo de sobrevida promedio. Concluyeron que los pacientes que no tenían necrosis tumoral tuvieron una sobrevida de 12,5 meses y aquellos que sí tenían, la supervivencia promedio fue de 10,9 meses. Es decir que la necrosis constituyó un factor pronóstico estadísticamente significativo, pero la magnitud de la diferencia en la sobrevida no fue clínicamente importante.
Consideramos que desde el punto de vista histológico existen variables que correlacionadas con la edad, han devenido como factores pronósticos desfavorables, como son la ausencia de seudoempalizada en los casos con necrosis, el tamaño nuclear y celular pequeño, y la ausencia de áreas bien diferenciadas.17-19, 22-25
Burger y Vollmer19 en un estudio histológico realizado en 184 casos con glioblastoma multiforme buscaron algún factor de significado pronóstico en este tipo de tumor. Definieron que la presencia de células gigantes tuvo un valor positivo significativo, pues aunque el tamaño monstruoso de estas células puede alarmar y usualmente sugerir un comportamiento maligno. Existen evidencias de que estas formas grotescas de células gigantes son mitóticamente inactivas e indolentes desde el punto de vista biológico.
Es decir, la neuropatología ha desempeñado un papel fundamental en el estudio de los tumores intracraneales, y la introducción de técnicas inmunohistoquímicas y métodos de medición de la capacidad de proliferación celular, han sido formas novedosas de obtener información acerca del pronóstico de los pacientes con gliomas.
En relación con la presentación clínica en el comienzo de la enfermedad, el defecto motor ha sido identificado como un signo negativo en relación con una supervivencia prolongada, lo cual consideramos está estrechamente relacionado con una baja puntuación en la EK inicial, otro indicador pronóstico en estos enfermos.
La EK prequirúrgica alta (mayor de 70) ha sido defendida por la mayoría de los autores como un elemento positivo en la supervivencia.1, 9, 11, 14, 20, 26-32 En el estudio de Kowalczuk y otros,30 la alta graduación de la EK previo a la cirugía fue uno de los 3 factores más importantes relacionado con la supervivencia, criterio apoyado por Black,11Thomas,20 Coffey y otros,28 y Chang y otros.33 Nuestros 5 pacientes se presentaron con una EK mayor de 70 puntos y así se mantuvieron posterior a la cirugía y a la terapia radiante.
Brem14 considera que entre los factores que mejoran el pronóstico de los pacientes con astrocitomas de alto grado de malignidad están: la edad al diagnóstico (menor de 45 años), la presentación de los síntomas por más de 6 meses, la epilepsia como forma de debut de la enfermedad, y la falta de trastornos de la personalidad en la presentación clínica. Dos de nuestros enfermos comenzaron con epilepsia, elemento clínico reconocido como de buen pronóstico en los pacientes con gliomas, quizás porque su presencia pudiera facilitar el diagnóstico más temprano de la enfermedad, sobre todo antes de que aparezcan manifestaciones clínicas de una lesión que ocupa espacio.1,14, 20, 26, 31,33-35
Las crisis epilépticas son producidas por una actividad anormal e hipersincrónica de neuronas ubicadas en cualquier parte del cerebro. Habitualmente cuando éstas aparecen después de los 25 años de edad, tiempo en que los síndromes epilépticos idiopáticos ya han sido expresados,36 se debe buscar la causa tumoral, conociendo que los tumores de bajo grado de malignidad tienen un potencial epileptogénico elevado, y su tratamiento a tiempo puede impedir una transformación anaplásica condicionada por mutaciones cromosómicas y del gen de la p53,36 quizás lo sucedido al caso 4 (tablas 1 y 2 ).
El intervalo de tiempo entre el inicio de los síntomas y el diagnóstico de la enfermedad es variable para los diferentes tipos de tumores. Este depende del grado de crecimiento e invasividad de la lesión. Para los astrocitomas anaplásicos es usualmente entre 6 a 24 meses y para los pacientes con glioblastoma multiforme, menor de 6 meses. Hoy se conoce, a partir de los estudios moleculares y de ingeniería genética, que el glioblastoma multiforme puede desarrollarse por 2 vías genéticas,27, 37, 38 a través de la transformación anaplásica de un astrocitoma de bajo grado, lo cual sugiere un mayor intervalo de tiempo entre los síntomas y el diagnóstico, o como un glioblastoma multiforme de novo, donde existe pérdida de heterocigosidad del cromosoma 10 y amplificación del gen del EGF, sin alteración del gen de la p53. La mutación de este gen asociado a pérdida de la heterocigosidad del cromosoma 17p, 9p,13q o 19q se observa en el proceso de progresión anaplásica de un glioma de bajo grado a glioblastoma multiforme, transición que termina con amplificación de los genes del EGF o MDM2. 38
Sobre la localización del tumor, 4 de los 5 pacientes se presentaron con lesión en el lóbulo frontal, signo de buen pronóstico citado por Tatter.1 Para Coffey y otros,28 los gliomas malignos confinados a un lóbulo tuvieron una supervivencia más prolongada que los que ocuparon más de uno o los situados a nivel talámico.
Consideramos que las lesiones situadas en zonas del cerebro poco elocuentes, fundamentalmente en el hemisferio derecho, permiten una resección quirúrgica más amplia y probablemente sea éste otro factor relacionado con larga sobrevida.
El papel de la cirugía como forma de obtener muestra de tejido tumoral para diagnóstico histológico y mejorar el efecto de masa producido por el tumor, está bien demostrado. La polémica surge en la influencia que tiene el grado de resección quirúrgica en relación con la supervivencia en los pacientes con gliomas malignos. Se conoce que pacientes con resección parcial o subtotal no muestran diferencias significativas en cuanto a supervivencia;20,39 sin embargo, en los pacientes jóvenes con gliomas frontales u occipitales en hemisferio no dominante y con marcado efecto de masa, la resección quirúrgica amplia es superior a la biopsia en términos de prolongar la supervivencia.29, 39-42 A su vez, pacientes con volumen tumoral pequeño que produce poco efecto de masa y ubicado especialmente en la profundidad del hemisferio, son manejados mejor con biopsia estereotáxica combinada con braquiterapia o radiocirugía estereotáxica.28, 43-48 Kowalczuk y otros,30 realizaron una revisión de la literatura médica publicada antes de 1990 y encontraron que en 16 de 20 estudios incluyendo 5 691 pacientes, no se mostró relación entre la extensión de la cirugía y la supervivencia. Otros autores, sin embargo, han defendido la exéresis quirúrgica amplia como factor de buen pronóstico. 1,11,35,41,42,49-53 Nosotros consideramos que el tratamiento quirúrgico de los pacientes con gliomas malignos depende de las características clínicas e imagenológicas particulares de cada enfermo. No todos los pacientes necesitan de citorreducción extensa. La complejidad del problema está dada por la acción simultánea de varios factores que pueden actuar favorablemente o no en la prolongación de la supervivencia de estos enfermos.
Defendemos el criterio de que cuando está indicado, se debe realizar una exéresis quirúrgica amplia que permita el diagnóstico histológico certero, la descompresión tumoral con alteración de la cinética celular, el alivio del efecto de masa provocado por la lesión y por tanto la mejoría clínica consecuente, que favorece también el efecto de las terapias coadyuvantes. Un principio que siempre se debe respetar es el no provocar daño a pesar de la tumorrectomía amplia. Salcman plantea41 que no existen evidencias de que la lobectomía en los tumores malignos, sea superior a la tumorrectomía.
Un aspecto importante en la valoración del grado de resección quirúrgica está en la definición tomográfica cuantitativa pre y posquirúrgica del volumen tumoral. En este sentido debe tenerse en cuenta la relación entre el volumen tumoral residual y el pronóstico, más que la relación entre la extensión de la resección tumoral y el pronóstico. Esto impedirá crear falsas expectativas, al pensar haber extirpado más tumor que el realmente resecado.
En relación con el uso de terapias coadyuvantes y la prolongación del tiempo de supervivecia existen diferentes criterios. Sin dudas, entre los años 70 y 80 el empleo de las terapias coadyuvantes permitió un incremento en la calidad de vida y la supervivencia de estos enfermos. Walker y otros,26 señalaron un tiempo de supervivencia promedio para el glioblastoma multiforme de 9 meses, Chang y otros,33 reportaron en 1983 un tiempo de sobrevida promedio de 8 meses para el glioblastoma multiforme y de 27 meses para el astrocitoma anaplásico.
El empleo de radioterapia y quimioterapia posterior a la cirugía produce un incremento en la media de supervivencia en la mayoría de las series.1-3, 7-11, 14, 20 - 22, 27,30, 32, 33, 35, 38, 41,42, 46, 49, 54 - 64
Sobre el efecto beneficioso de la quimioterapia han existido más dudas que sobre la eficacia de la radioterapia, fundamentalmente con la demostración de Walker y otros,26 del incremento de la supervivencia de 14 a 36 semanas en los pacientes tratados con radioterapia posterior a la cirugía, y los trabajos de García y otros,62 que evidencian que el tiempo de supervivencia de los pacientes operados tratados con radioterapia fue el doble (5 años) que el de los pacientes tratados solamente con cirugía (2,2 años). En el glioblastoma multiforme específicamente, la radioterapia ha incrementado la supervivencia hasta 18 meses
Los resultados obtenidos con el uso de la quimioterapia de forma complementaria a la cirugía y la radioterapia, muestran un incremento en la media de supervivencia entre 40 a 50 semanas.1 Para algunos autores los resultados no son suficientes para aconsejar su uso rutinario, aunque pensamos que su empleo en los casos con mejor pronóstico sí está indicado.
Ensayos clínicos realizados por Chang y otros,33 han mostrado que en los pacientes entre 40 a 60 años el uso de agentes quimioterapéuticos produce un incremento significativo de la sobrevida promedio.
En los 5 pacientes de nuestro estudio esto se ratifica. Todos recibieron este tipo de tratamiento, específicamente cobaltoterapia a dosis de 40 Gy en la línea media del encéfalo y 20 Gy en el área tumoral. En la poliquimioterapía se empleó cisplatino y dibromodulcitol.
Confiamos que el progreso que ahora tiene lugar en el entendimiento de las anomalías genéticas de los gliomas, dé lugar en el futuro a un nuevo y probablemente menos invasivo tratamiento para los pacientes con gliomas cerebrales malignos.
Finalmente, en relación con los pacientes con una larga sobrevida, Imperato y otros, 32 definen como largo tiempo de supervivencia a los pacientes con glioblastoma multiforme y astrocitoma anaplásico que viven al menos 100 % más que la supervivencia promedio de los controles históricos. Es decir, 2 años para los pacientes con glioblastoma multiforme y 4 años para los pacientes con astrocitoma anaplásico. En su estudio, el 5,6 % de los casos tuvieron larga sobrevida (9 pacientes).
Betty65 en 1964, señaló como el mayor tiempo de supervivencia de un paciente con glioma anaplásico, 3 años y 6 meses. En la serie de Roth y Elvidge54 el 5 % de los pacientes con glioblastoma multiforme sobrevivieron 3 años y aproximadamente el 3 % vivió 5 años.
En un estudio de Salford y otros,59 de 1 147 pacientes con astrocitomas supratentoriales anaplásicos se reportó el 0,5 % de pacientes vivos a los 18 años de tratados,y fue el único denominador común de todos los casos la edad joven al tiempo de la operación (menor de 38 años). El grado de extensión quirúrgica, el tiempo de duración de los síntomas y la localización del tumor no fueron determinantes.
Tatter y otros,1 en 1996 reportaron que menos del 5 % de los pacientes con glioblastoma multiforme tienen una larga sobrevida. Bhagwati66 en 1997 planteó que el promedio de vida para un paciente con un glioma anaplásico es de 18 a 24 meses y para el glioblastoma multiforme entre 9 a 12 meses, por lo que muy pocos pacientes pueden sobrevivir más de 3 a 5 años después del tratamiento multidisciplinario.
Nosotros obtuvimos resultados superiores a los reportados en la literatura médica. El 7,4 % (5 casos) tuvo una sobrevida mayor de 7 años, e incluso hasta el cierre de nuestro trabajo todos estaban vivos con un Karnofsky mayor de 70.
Entre los factores pronósticos que encontramos en estos pacientes, la edad menor de 35 años, el comienzo clínico sin defecto neurológico, la localización de la lesión en el lóbulo frontal derecho y la exéresis quirúrgica total, estuvieron presentes en el 80 % de los casos. El Karnofsky inicial mayor de 70 y el empleo de radioterapia y quimioterapia posquirúrgica fue común a todos.
Summary
Historically, the average time of survival of the patients with glioblastoma multiforme and anaplastic astrocytoma has ranged from 6 to 12 months and from 2 to 4 years, respectively. A few patients survive 5 years after surgery. The aim of this paper was to identify some common denominator in patients with long survival and confirmed histological diagnosis of anaplastic astrocytoma or multiform glioblastoma. Communication was established with the relatives of 67 patients operated on at the Institute of Neurology and Neurosurgery between 1983 and 1992. The age of the patients, the localization of the tumor, the neurological state at the onset of the disease, the time of evolution and the treatment used were analyzed. 5 patients had a time of survival over 7 years. The youngest patient was 35. The localization of the injury on the right frontal lobule, the clinical beginning without focal neurological defect, as well as the total exeresis was the norm in 80 % of these cases. The initial scoring over 70 in Karnofsky scale (KS) and the use of radiotherapy and chemotherapy after surgery was common to all of them. Young patients with highly malignant astrocytic gliomas located in the right frontal lobule that begin with a KS over 70 points and undergo total exeresis, postsurgery radiotherapy and chemotherapy have greater probabilities of prolonging their time of survival.
Subject headings: GLIOBLASTOMA; DISEASE-FREE SURVIVAL
Referencias bibliográficas
- Tatter SB, Wilson CB, Harsh IV GR. Neuroepithelial tumors of the adult brain. En: Youmans JR, ed. Neurological Surgery: a comprehensive reference guide to the diagnosis and management of neurosurgical problems. Philadelphia: WB Saunder; 1996:2 612-84.
- Solans JG, Massó JFM. Quimioterapia de los tumores cerebrales. Neurología 1988; 3:19-25.
- Kornblith PL, Walker MD, Cassady JR. Tumores del Sistema Nervioso Central. En: Devita VT, Hellman S, Rosenberg SA, eds. Cáncer. Principios y prácticas de Oncología. La Habana: Revolucionaria; 1984:1 085 -149.
- Brem S, Rozental JM, Moskal JR. What is the etiology of human brain tumor? A report on the first Lebow conference. Cancer 1995; 76:709 -13.
- Polednak AP, Flannery JT. Brain, others tumors of the central nervous system and eye cancer. Cancer 1995; 75:330-7.
- Walker AE, Robis M, Weinfeld F. Epidemiology of brain tumors: the national survey of intracraneal neoplasms. Neurology 1985; 35:219-26.
- Butler AB, Netsky MG. Classification and biology of brain tumors. En: Youmans JR, ed. Neurological Surgery: a comprehensive reference guide to the diagnosis and management of neurological problems. Philadelphia: WB Saunders; 1973: 1 297-339.
- Young HF. Brain tumors. En: Grossman RG, ed. Principles of neurosurgery. New York: Raven Press; 1991: 113 - 63.
- Parisi JE. The astrocytomas. 34th Annual Neuropathology Review. Maryland, USA; 1996.
- Burger PC. Clinical radiological and pathological analysis of CNS tumors. 34 th Annual Neuropathology Review. Maryland, USA; 1996.
- Black PM. Brain tumors. (First of two parts). N Engl J Med 1991; 324:1 471-6.
- Kirby S, Brothers M, Irish W, Florell R. Evaluating glioma therapies: modeling treatments and predicting outcomes. J Natl Cancer Inst 1995; 87:1 884 - 8.
- Rosenfeld MR, Gutin PH, Dalmau J. Aspectos prácticos en el diagnóstico y tratamiento de los gliomas cerebrales. Neurología 1999;14:111 - 21.
- Brem H. Malignant glioma. En: Long DM, ed. Current therapy in Neurological Surgery-2. Philadelphia: Decker; 1988: 43-5.
- Burger PC, Vogel S, Green SB, Strike TA. Glioblastoma multiforme and astrocitoma anaplasico. Pathologic criteria and prognostic implications. Cancer 1985; 56:1 106 -11.
- Whittle IR. The biology of glioma. In Teasdale GM, Miller JD, eds. Current Neurosurgery. Edinburgh: Churchill Livingstone; 1992: 255-84.
- Burger PC, Green SB. Patient age, histologic features and lenght of survival in patients with glioblastoma multiforme. Cancer 1987; 59: 1 617-25.
- Barker FG, Davis RL, Chang SM, Prados MD. Necrosis as a prognostic factor in glioblastoma multiforme. Cancer 1996; 77: 1 161-6.
- Burger PC, Vollmer RT. Histologic factors of prognostic significance in the glioblastoma multiforme. Cancer 1980; 46:1 179 - 86.
- Thomas DGT. Treatment of malignant cerebral glioma. En: Teasdale GM, Miller JD, eds. Current Neurosurgery. Edinburgh: Churchill Livingstone; 1992: 285 - 93.
- Roth JG, Elvidge AR. Glioblastoma multiforme: a clinical survey. J Neurosurg 1960;17:736 - 50.
- Burger PC, Scheithauer BW. Tumors of the Central Nervous System. Atlas of tumor pathology. Washington DC: Armed Forces Institutes of Pathology; 1994: 25-161.
- Calvo W. Diferenciación y desdiferenciación glial en el desarrollo de los tumores del sistema nervioso. En: Obrador Alcalde S, Sanz Ibañez J, eds. Tumores intracraneales. Monografía del Instituto Nacional de Oncología. Madrid: Santander; 1955: 71-87.
- Daumas-Duport C, Scheithauer BW, O`Fallon J, Kelly P. Grading of astrocytomas. A simple and reproductible method. Cancer 1988; 62: 2 152-65.
- Russell SD, Rubinstein LJ. Pathology of tumors of the nervous system. London: Edward Arnold; 1959: 93-169.
- Walker MD, Alexander E, Hunt WE, MacCarty CS, Mahaley MS, Mealy J, et al. Evaluation of BCNU and/or radiotherapy in the treatment of anaplastic gliomas. A cooperative clinical trial. J Neurosurg 1978; 49:333-43.
- Yasargil MG. Microneurosurgery of CNS tumors. New York: Thieme Medical Publishers; 1996.
- Coffey RJ, Lunsford LD, Taylor FH. Survival after stereotactic biopsy of malignant gliomas. Neurosurg 1988; 22: 465-73.
- Fadul C, Wood J, Thaler H, Galicih J, Patterson RH, Posner JB. Morbility and mortality of craniotomy for excision of supratentorial gliomas. Neurology 1988;38:1 374-79.
- Kowalczuk A, Macdonald RL, Amidei CH, Dohrmann III G, Erickson RK, Hekmatpanah J, et al. Quantitative imaging study of extent of surgical resection and prognosis of malignant astrocytomas. Neurosurg 1997; 41:1 028-38.
- Hutton JL, Smith DF, Chadwick DW. Prospective evaluation of a prognostic index for intrinsic supratentorial tumors. J Neurol Neurosurg Psychiatry 1995; 59: 92- 4.
- Imperato JP, Paleologos NA, Vick NA. Effects of treatment on long-term survivors with malignant astrocytomas. Ann Neurol 1990; 28: 818-22.
- Chang CH, Horton J, Schoenfeld D, Salazar O, Pérez-Tamayo R, Kramer S, et al. Comparison of postoperative radiotherapy and combined postoperative radiotherapy and chemotherapy in the multidisciplinary management of malignant gliomas. Cancer 1983; 52: 997-7.
- Patronas NG, DiChiro G, Kufta C, Bairamiand D, Kornblith PL, Simon R, et al. Prediction of survival in glioma patients by means of positron emission tomography. J Neurosurg 1985; 62: 816-22.
- Devaux BC, O`Fallon JR, Kelly PJ. Resection, biopsy and survival in malignant glial neoplasms. A retrospective study of clinical parameters, therapy and outcome. J Neurosurg 1993; 78:767-75.
- Pérez-Ortiz L, Zaldívar-Vaillant T, Tamayo-Suárez J.D. Gliomas malignos. Apuntes oncogenéticos. Rev Neurol 2000; 31: 49-52.
- Kim DH, Harsh IV GR. Advances in brain tumor biology: the genetics of astrocytoma. En: Salcman M, ed. Current techniques in neurosurgery. Philadelphia: Current Medicine; 1993:1.1-1.6.
- Rosenfeld MR, Dalmau J. Tumores cerebrales primarios: realidad y bases moleculares de futuros tratamientos. Neurología 1997; 12 :185-96.
- Kelly PJ. Reoperation for recurrent malignant gliomas: What are your indication? (comments). Surg Neurol 1997; 47: 39-40.
- Karaguiosov L. Técnica neuroquirúrgica. La Habana: Ed. Científico -Técnica; 1977: 76-81.
- Salcman M. Intrinsic Cerebral Glioma. En: Apuzzo MLJ, ed. Brain surgery. Complication, avoidance and management. New York: Churchill Livingstone; 1993: 379-90.
- Ciric JS, Weinsweig D. Internal decompression of intra-axial supratentorial tumor (malignant supratentorial gliomas and metastatic tumors). En: Apuzzo MLJ, ed. Brain surgery. Complication, avoidance and management. New York: Churchill Livingstone; 1993: 431-42.
- Heilbrun MP, Brockmeyer D, Sunderland P. Stereotactic surgery for mass lesions of the cranial voult. In Apuzzo MLJ, ed. Brain surgery. Complication, avoidance and management. New York: Churchill Livingstone; 1993: 390-5.
- Gutin PA, Leibel SA, Wara WH, Choucair A, Levin VA, Philips TL, et al. Recurrent malignant gliomas: survival following interstitial brachytherapy with high-activity iodine-125 sources. J Neurosurg 1987; 67: 864-73.
- Sneed PK, Prados MD, Mc Dermott MW, Larson DA, Malec MK, Lamborn KR, et al. Large effect of age on the survival of patients with glioblastoma treated with radiotherapy and brachytherapy boost. Neurosurgery 1995; 36: 898-4.
- Salcman M. Recent advances and future directions in interstitial brachytherapy. En: Salcman M, ed. Current techniques in neurosurgery. Philadelphia: Current Medicine; 1993: 4.1 - 4.12.
- Kondziolka D, Lunsford LD. Stereotactic radiosurgery for brain tumors. En: Salcman M, ed. Current techniques in neurosurgery. Philadelphia: Current Medicine; 1993: 5.1 - 5.11.
- Kondziolka D, Flickinger JC, Bissonette DJ, Bozik M, Lunsford LD. Survival benefit of stereotactic radiosurgery for patients with malignant glial neoplasm. Neurosurgery 1997; 41:776-85.
- Jelsma R, Bucy PC. The treatment of glioblastoma multiforme of the brain. J Neurosurg 1967; 27: 388-00.
- Nitta T, Sato K. Prognostic implications of the extent of surgical resection in pàtients with intracranial malignant gliomas. Cancer 1995; 75: 2 727-31.
- Ammirati M, Vick N, Liao Y, Ciric J, Mikhael M. Effect of the extent of surgical resection on survival and quality of life in patient with supratentorial glioblastomas and anaplastic astrocytomas. Neurosurgery 1987; 21: 201-6.
- Frankel SA, William JG. Glioblastoma multiforme. Review of 219 cases with regard to natural history, pathology, diagnostic, method and treatment. J Neurosurg 1958; 5: 489-3.
- Heideman RL, Kuttesch J, Gajjar AJ, Walter AW. Supratentorial malignant gliomas in chilhood. Cancer 1997; 80: 497-4.
- Pérez-Ortiz L, Galarraga J, Gómez-Suárez H, Tamayo-Suárez JD. Clasificación de los gliomas astrocíticos. Breves consideraciones. Rev Neurol 2000;31:1180-3.
- Kornblith PK, Weich WC, Bradley MK. The future of therapy for glioblastoma. Surg Neurol 1993; 39:538-43.
- Greenberg HS, Ensminger WD, Chandler WF, Layton PB, Junck L, Knake J, et al. Intra-arterial BCNU chemotherapy for treatment of malignant gliomas of the CNS. J Neurosurg 1984; 61: 423-9.
- Wara WM. Radiation therapy for brain tumors. Cancer 1985; 55: 2 291-8.
- Young WK. New approaches to molecular therapy of brain tumors. Curr Opin Neurol 1994;7: 501-5.
- Salford LG, Brun A, Nirfalk S. Ten-year survival among patients with supratentorial astrocytomas grade III and IV. J Neurosurg 1988; 69: 506-9.
- Burger PC, Stephen M, Mahaley M, Dudka L, Stephen F. The morphologic effects of radiation administered therapeutically for intracranial gliomas. A postmortem study of 25 cases. Cancer 1979; 44: 1 256-72.
- Ramsey RG, Brand WN. Radiotherapy of glioblastoma multiforme. J Neurosurg 1973; 39:197-2.
- García DM, Fulling KH, Marks JE. The value of radiation therapy in addition to surgery for astrocytomas of the adult cerebrum. Cancer 1985; 55: 919-27.
- Walter KA, Tamargo RJ, Olivi A, Burger PC, Brem H. Intratumoral chemotherapy. Neurosurgery 1995; 37:1129-45.
- Mc Keever PE. New Method of brain tumors analysis. 34 th Annual Neuropathology Review. Maryland; 1996.
- Betty MJ. Quality of survival in treated patients with supratentorial glioma. J Neurol Neurosurg Psychiatry 1964; 27:556-61.
- Bhagwati SN. Reoperation for recurrent malignant gliomas: What are your indication? (comments). Surg Neurol 1997; 47: 40-1.
Recibido: 3 de septiembre de 2003. Aprobado: 2 octubre de 2003.
Dra. Letyer Pérez Ortiz. Calle 145, No. 4028, entre 140 y 142, reparto Reynold García, Matanzas, CP: 40500, Cuba.
1Especialista de I Grado en Neurocirugía.
2 Doctora en Ciencias Médicas. Especialista de II Grado en Radiología. Profesora Titular. Jefa del Servicio de Radiología del INN.
3 Especialista de I Grado en Medicina General Integral.