Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Cirugía
versión On-line ISSN 1561-2945
Rev Cubana Cir v.45 n.2 Ciudad de la Habana abr.-jun. 2006
Universidad del Zulia (Venezuela)
Niveles de interleucina-2 y su receptor soluble en pacientes operados y transfundidos
Lic. Maczy González Rincón,1 Lic. Ana Ruiz Medina,2 Dra. Melvis Arteaga de Vizcaíno,3 Dr. Felipe Díaz Araujo4 y Dr. Jesús Weir Medina5
RESUMEN
Se realizó un estudio aleatorio para determinar los niveles de interleucina-2 (IL-2) y su receptor soluble (RsIL-2) en pacientes operados y transfundidos, antes de la cirugía, en el hemoderivado y 24 h después de la transfusión y para relacionar los niveles de IL-2 y RsIL-2 con cada período. Mediante inmunoensayo enzimático se determinaron los niveles de de IL-2 y RsIL-2 en 40 pacientes operados, antes de la cirugía, en los derivados sanguíneos y 24 horas después de la transfusión. Se obtuvieron valores promedio de 3,98 U/mL; 3,18 U/mL e indetectable para IL-2 y de de 678,2; 1 402 y 90,34 pg/mL para RsIL-2, en los períodos respectivos. El declive de la función linfocitaria después de cirugía y transfusión se atribuye a cambios intrínsecos o a la redistribución de células T reactivas de la sangre hacia los tejidos, a factores séricos como prostaglandinas y corticoesteroides, inhibidores de IL-2 que, con los elevados valores de RsIL-2 hallados en la bolsa, explican los niveles indetectables de IL-2 a las 24 horas de la transfusión.
Palabras clave: IL-2, RsIL-2, cirugía, transfusión.
La base común de la respuesta inflamatoria sistémica al trauma quirúrgico es la activación de la cascada de las citocinas, acompañada de la liberación de sus receptores solubles. El eje principal de las citocinas estimula la liberación de las proteínas de fase aguda desde el hígado, las cuales modulan las vías metabólicas y la respuesta hormonal.1 La supresión de la inmunidad celular es secundaria a la disminución de la función inmunitaria, como respuesta biológica inducida por el estrés quirúrgico.2
Las células del sistema inmunitario expresan una serie de antígenos de superficie tales como los del complejo mayor de histocompatibilidad (CMH), receptores de células T y de citocinas como interferón α, IL-2 e IL-12. Se ha comprobado que la expresión de antígenos del CMH de clase II por los monocitos y la producción de citocinas por parte de las células T CD4 se encuentra disminuida después del estrés quirúrgico.2
La cirugía mayor, y en algunos casos la cirugía menor (p. ej., colecistectomía, histerectomía, entre otras), pueden causar cambios en la inmunidad mediada por células.3 Esta situación se puede intensificar si el paciente además recibe transfusión sanguínea. Al respecto se ha reportado que la transfusión perioperatoria de sangre alogénica incrementa el riesgo de complicaciones infecciosas y reduce la supervivencia libre de enfermedad a largo plazo en pacientes operados por cáncer.4
De manera que, atendiendo a estos antecedentes, surgió la necesidad de determinar las concentraciones de IL-2 y su receptor soluble en pacientes operados que necesitaron transfusión de derivados sanguíneos y comparar estas concentraciones antes y 24 horas después de la cirugía y transfusión, tanto en el paciente como en la bolsa del derivado sanguíneo administrado.
MÉTODOS
Se realizó un estudio aleatorio en 40 pacientes adultos de uno y otro sexo, con edades comprendidas entre 17 y 59 años de edad, sin desórdenes inmunitarios ni trastornos neoplásicos, que fueron operados mediante diferentes procedimientos, tales como histerectomía (20), tiroidectomía (6), colecistectomía (8) y laparotomía exploratoria (6), con una duración promedio por cirugía de 45 minutos, y que fueron atendidos en el servicio de Cirugía del Hospital Chiquinquirá, en Maracaibo, Estado Zulia, Venezuela, durante un período de 4 meses del 2005. Ningún paciente presentó complicación postoperatoria.
A cada uno de ellos se les solicitó por escrito su consentimiento para participar en el estudio y también se contó con la aprobación del Comité de Ética de la institución y se procedió de acuerdo a los principios de la declaración de Helsinki de 1975 (actualizado en el 2000).
Para la determinación de los niveles séricos de IL-2 y RsIL-2, se extrajeron de los pacientes, 6 mL de sangre venosa antes de la cirugía y 24 horas después de ésta. Se separo el suero por centrifugación a 1000 g durante 10 minutos, mientras que de cada bolsa de sangre completa para emplear en transfusión (una bolsa por cada paciente e intervención), se extrajo 6 mL antes de ser administrada al paciente. El plasma fue separado por centrifugación y al igual que las muestras séricas fueron alicuotadas y almacenadas a –70 ºC en un ultracongelador vertical.
El análisis de los especímenes obtenidos para IL-2 y RsIL-2 se realizó mediante la técnica de inmunoensayo enzimático de captura (ELISA) del laboratorio Biosource, catálogo # KAC 1241, lote N.o 0344045. Los valores obtenidos se expresaron como media ± error estándar (EE), aplicando la prueba t de Student no pareada y la correlación de Pearson, con un índice de confiabilidad estadística al 95 % (p < 0,05).6
RESULTADOS
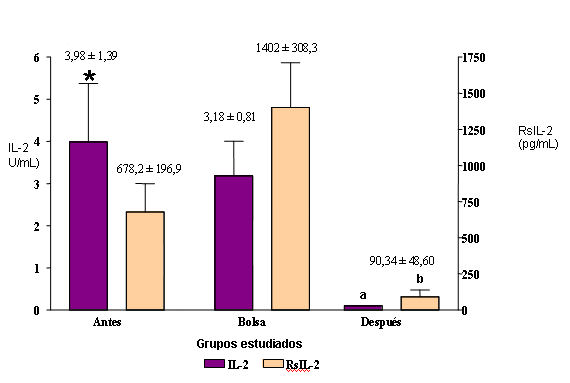
En la figura se muestran las concentraciones séricas de IL-2 y RsIL-2 obtenidas en pacientes operados que recibieron transfusión antes y después de la intervención. Se observa que los niveles de IL-2 se hicieron indetectables 24 horas después de la cirugía. Asimismo, el RsIL-2 experimentó un descenso en el período postoperatorio (678,2 pg/mL antes y 90,34 pg/mL después). Al compararlos con los valores obtenidos para la citocina y su receptor en la bolsa del hemoderivado administrado (IL-2: 3,18 U/mL y RsIL-2: 1402 pg/mL) se encontraron diferencias estadísticamente significativas entre los grupos antes y en la bolsa para ambas citocinas.
Figura. Concentraciones séricas de IL-2 y RsIL-2 en pacientes operados con transfusión antes y después de la cirugía.
* Las columnas representan el promedio ± error estándar de 40 individuos.
a Diferente significativamente de los grupos Antes (p < 0,01) y Bolsa (p < 0,05).
b Diferente significativamente de los grupos Antes (p < 0,05) y Bolsa (p < 0,001).
DISCUSIÓN
Se ha sugerido que las transfusiones sanguíneas perioperatorias inducen inmunosupresión inespecífica en el receptor, en respuesta a los diversos antígenos celulares y solubles presentes en el hemoderivado administrado. Diversos mecanismos se han propuesto como posibles responsables de la falta de respuesta inmunitaria, entre los cuales se pueden mencionar la inducción de células supresoras, la producción de anticuerpos antiidiotipos, la sensibilización como resultado de la deleción clonal, el incremento de la producción de prostaglandinas y la alteración en la generación y secreción de citocinas.7,8
La transfusión perioperatoria de sangre alogénica, además del trauma provocado por una cirugía, induce a una inmunosupresión transitoria, la cual parece contribuir a aumentar el riesgo de complicaciones infecciosas durante el postoperatorio. Los mecanismos de la inmunosupresión inducida por la cirugía y transfusión parecen estar mediados por los antígenos presentes en los glóbulos blancos, así como por los componentes del plasma provenientes del derivado sanguíneo transfundido.7 Por otro lado, se han reportado alteraciones inmunológicas después de la transfusión llevada a cabo tras una cirugía electiva, traumas diversos y quemaduras.9
Se ha descrito, además, que numerosos anestésicos deprimen la función óptima del sistema inmunitario y las actividades de las células que lo constituyen, como monocitos, linfocitos, y mediadores solubles, como las citocinas. Estos efectos parecen ser menos prominentes que aquellos inespecíficos como el estrés quirúrgico y la transfusión, pero sin embargo suelen ejercer un efecto inmunsupresor acumulativo.10
Los resultados obtenidos en este trabajo parecen apoyar la hipótesis de que la transfusión induce inmunosupresión, observada en particular a las 24 horas con niveles indetectables de IL-2 y muy bajos de RsIL-2. Esto podría originarse debido al posible declive de la función linfocitaria periférica que sigue a la cirugía y a la transfusión, que seria atribuible en parte a la generación de cambios linfocitarios intrínsecos o a la redistribución de células T reactivas desde la sangre hacia los tejidos, así como a los efectos inhibitorios de sustancias como las prostaglandinas y corticoesteroides de reconocido efecto negativo sobre la producción de IL-2.11,12 Asimismo, es de hacer notar que en esta investigación los niveles de RsIL-2 en la bolsa del hemoderivado transfundido se encontraron elevados (1402 pg/mL), lo cual indicó una activación linfocitaria (figura). Los niveles elevados de RsIL-2 en la bolsa, podrían haber unido la IL-2 a nivel celular (en el paciente) y generar señales de regulación negativa para la producción posterior de IL-2 (24 horas).4
En cuanto a los niveles de IL-2 y RsIL-2 y su relación con pacientes operados y transfundidos, algunos investigadores como Lahat y cols., en 1993, condujeron un estudio en 20 pacientes con cirugía mayor, 10 de los cuales recibieron transfusión y el resto no la recibió. Se encontró que los niveles séricos de RsIL-2 aumentaron 24 horas después de la cirugía y transfusión y alcanzaron un pico al quinto día postoperatorio, mientras que la IL-2 se elevó antes del primer día y luego disminuyó significativamente al mismo tiempo que los niveles de RsIL-2 se incrementaban, lo que pudo interferir con la respuesta inmunitaria dependiente de IL-2.3 Estos resultados concuerdan en gran parte con los obtenidos en nuestra investigación, donde los niveles séricos de IL-2 se hicieron indetectables luego de la transfusión, mientras que el RsIL-2 se encontró elevado significativamente en la bolsa del hemoderivado administrado (figura).
Esto hace pensar que los niveles elevados de RsIL-2 presentes en la bolsa del hemoderivado administrado posiblemente ejercieron una regulación negativa en la función y producción de IL-2 y ocasionaron, en consecuencia, una inmunosupresión transitoria compatible en algunos casos con complicaciones infecciosas postoperatorias descritas en algunos pacientes.7,13-15 Sin embargo, es importante hacer notar que el estrés quirúrgico pudo ejercer un efecto acumulativo a la inmunosupresión observada en los pacientes estudiados, por lo cual se sugiere que este estudio sea ampliado con investigaciones donde se maneje la variable cirugía sin transfusión.
REFERENCIAS BIBLIOGRÁFICAS
1. Maruna P, Gurlich R, Frasko R., Chachkhiani I, Marunova M, Owen K, et al. Cytokines and soluble cytokine receptors in the perioperative period. Uztav Patologie Fyziologie. 2003; Sb Lek. 2002; 103 :273-282.
2. Ono S, Mochizuki H. Mechanism of immune suppression after surgical stress and host defense against infection. Nippon Geka Gakkai Zasshi. 2003; 104 (12):822-7.
3. Lahat N, Shtiller A, Zlotnick K, Merin G. Early/sIL-2R surge following surgery leads to temporary immune refractoriness. Clin Exp immunol. 1993; 92: 482-486.
4. Hisatomi K, Isomura T, Kawana T. Changes in lymphocyte subsets, mitogen responsiveness and interleukin 2 production after cardiac operations. J Thorac Cardiovasc Surg. 1989; 98: 580-91.
5. Engvall E, Perlman P. Enzyme-linked immunosorbent-assay (ELISA). Immunochem. 1971, 8(9): 871-874.
6. Wayne W. Daniel. Bioestadística. En: Wayne WD. Base para el análisis de las ciencias de la salud. Tercera Edición. México, D.F.: Editorial Noriega Limusa; 1991. pp. 503-557.
7. Nielsen HJ, Reimert CM, Pedersen AN, Brunner N, Edvardsen E, Dybkler H, et al. Time-dependent spontaneous release of white cell-and platelet-derived bioactive substances from stored human blood. Transfusión. 1996; 36: 960-965.
8. Kalechman Y, Gafter U, Sobelman D, Sredni B. The effect of a single whole-blood transfusion on cytokine secretion. Clin Immunol. 1990; 10(2): 99-105.
9. Shao W, Edelman L, Sullivan D, Nelson E, Shelby J. Long-term cytokine alterations following allogeneic blood transfusion. J Investigative Medicine. 1996; 46(4): 161-167.
10. Schriemer P, Longnecker D, Mintz P. The possible immunosuppressive effects of perioperative blood transfusion in cancer patients. Anesthesiology. 1988; 68: 422-428.
11. Chouaib S, Chatenoud L, Klatzmann D, Fradelizi D. The mechanisms of inhibition of human IL-2 production. II. PGE2 Induction of suppressor T lymphocytes. The Journal of Immunology 1984; 132(4):1851-1857.
12. Wood M, Gottschalk R, Monaco A. Effect of blood transfusion on IL-2 production. Transplantation. 1988; 45(5): 930-935.
13. Gooding R, Riches P, Dadían G, Moore J, Gore M. Increased soluble interleukin-2 receptor concentration in plasma predicts a decreased cellular response to IL-2. British Journal of Cancer. 1995; 72: 452-455.
14. Mynster T, Dybjoer E, Kromborg G, Nielsen H. Immunomodulating effect of blood transfusion: Is storage time important? Vox sanguinis. 1998; 74: 176-181.
15. Blumberg N, Heal J. Transfusion and recipient immune function. Arch Pathol Lab Med. 1989; 113; 246-253.
Recibido: 12 de abril de 2006. Aprobado: 24 de mayo de 2006.
Lic. Maczy González Rincón. Instituto de Investigaciones Clínicas de la Facultad de Medicina, Universidad del Zulia. Maracaibo 4000-A, Estado Zulia, Venezuela. Apartado postal: 1151.
Correo electrónico: maczygonzalez@hotmail.com
1 Licenciada en Bioanálisis. Máster en Inmunología Básica. Profesor Titular.
2 Licenciada en Bioanálisis. Máster en Inmunología Experimental. Profesor Asociado.
3 Doctora en Ciencias Médicas. Especialista en Hematología. Profesor Titular.
4 Doctor en Ciencias Médicas. Profesor Titular.
5 Doctor en Ciencias Médicas. Especialista en Hematología. Profesor Titular.