Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Cirugía
versión On-line ISSN 1561-2945
Rev Cubana Cir vol.54 no.3 Ciudad de la Habana jul.-set. 2015
ARTÍCULO DE REVISIÓN
La neoplasia sólida-pseudopapilar del páncreas como entidad enigmática
The solid tumor-the pancreas pseudopapillary as enigmatic entity
Dr. Eduardo Blanco Faramiñán, Dr. Orlando Zamora Santana
Hospital Clinicoquirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
RESUMEN
El tumor sólido-pseudopapilar del páncreas, conocido también como tumor de Frantz, es una rara enfermedad. Afecta principalmente a mujeres jóvenes, no blancas. Tiene componentes sólidos y quísticos. Constituye una neoplasia maligna con un pronóstico, generalmente alentador. Realizamos una revisión de la literatura con el objetivo de actualizar algunos puntos clave acerca del tema. Se incluyeron para la búsqueda las siguientes palabras claves: “tumor sólido-quístico”, “tumor quístico papilar”, “pseudopapilar”, “sólido y quístico”, “tumor de páncreas”, “tumor pancreático”, “neoplasia del páncreas”, “neoplasia pancreática”, “sólido pseudopapilar” y “tumor de Frantz”. Los acápites que desarrollamos son patogénesis, biología molecular, patología, características clínicas, imaginología y diagnóstico, tratamiento y por último pronóstico. Existen algunos aspectos no bien dilucidados en estos tumores. Por ejemplo, se necesitan más investigaciones en áreas como patogénesis, biología molecular y tratamiento no quirúrgico.
Palabras clave: tumor de Frantz, quiste pancreático, tumor, malignidad, neoplasia, cáncer pancreático, cirugía, neoplasia sólida - pseudopapilar, páncreas.
ABSTRACT
Solid-pseudopapillary of the pancreas, also known as Frantz tumor, is a rare disease. It mainly affects non-Caucasian young women; it has solid and cystic components and represents a malignant neoplasm with generally encouraging prognosis. To this end, a literature review was made to update some key points on the subject. The following keywords were used: “solid-cystic turmor”, “papillary cystic tumor”, “pseudopapillary”, “solid and cystic”, “pancreas tumor”, “pancreatic tumor”, “pancreas neoplasm”, “pancreatic neoplasm”, “solid-pseudopapillary” and Frantz’ tumor”. The sections that we further developed were pathogenesis, molecular biology, pathology, clinical characteristics, imaging and diagnosis, treatment and finally prognosis. There are some poorly clarified in these tumors, so more research work is needed in pathogenesis, molecular biology and non-surgical treatment.
Keywords: Frantz’s tumor, pancreatic cyst, tumor, malignancy, neoplasm, pancreatic cancer, surgery, solid-pseudopapillary neoplasm, pancreas.
INTRODUCCIÓN
En 1954, Frantz reportó por primera vez la neoplasia sólida-pseudopapilar (NSP) del páncreas. Sin embargo, su patología la describió Hamoudi (1970) y Klöppel (1981) la describió como una entidad clínica particular.1-4 Este tumor es infrecuente y de bajo grado de malignidad.1,5,6 Comprende entre 0,13 – 2,7 % de las neoplasias pancreáticas primarias, menos de 4 % de los tumores quísticos pancreáticos resecados y 8 - 17 % de los tumores de páncreas en niños.3,6,7
Se identificaron 2 744 pacientes con neoplasias sólidas-pseudopapilares (NSP) en 484 estudios publicados entre 1961 y 2012; de estas 87,8 % se reportaron entre 2000 y 2012.8 Este incremento se debe probablemente al mayor conocimiento acerca de esta entidad por parte de médicos e imagenólogos, así como a su mejor descripción clínico-patológica.6
La NSP también se conoció como “tumor sólido y papilar”, “tumor sólido-quístico”, “tumor quístico papilar”, “neoplasia epitelial sólida y pseudopapilar”, “neoplasia epitelial papilar”, neoplasia sólida-papilar de células acinares”, “tumor papilar del páncreas”, “tumor papilar de bajo grado” y “tumor de Frantz”. En 1996 la Organización Mundial de la Salud la definió como “tumor sólido-pseudopapilar” (TSP) del páncreas según la Clasificación Histológica Internacional de Tumores del Páncreas Exocrino.4,6,7,9,10
Nuestro propósito fue realizar una revisión de la literatura a fin de actualizar el tema.
ASPECTOS GENERALES DE LA NEOPLASIA SÓLIDA - PSEUDOPAPILAR DEL PÁNCREAS
Patogénesis
La NSP es un tumor enigmático en cuanto a su origen celular y fenotipo. Su preponderancia en mujeres jóvenes plantea la posibilidad de una influencia hormonal en su desarrollo.7,11-13 A pesar de exhaustivas investigaciones, solo se han demostrado receptores de progesterona (RP) en estos tumores y algunos reportes sugieren la presencia de formas beta de receptores de estrógenos (RE).7,11,12 Tognarini y otros 14 afirman haber aportado la primera evidencia de que los estrógenos pueden influir en el crecimiento de la NSP, de esta forma ofrecen estrategias futuras para controlar estas neoplasias a través de moduladores selectivos de los receptores de estrógenos.
La coexistencia de NSP con embarazo en tres de diecinueve pacientes, con ovarios poliquísticos en dos y con un tumor de células de Sertoli-Leydig en una; tiende a apoyar la patogénesis endocrina.4 También se piensa que la preponderancia en mujeres (> 90 %) sea resultado del posible origen de la NSP a partir de la cresta genital muy próxima al esbozo pancreático en la 7ma semana durante la organogénesis, por la inclusión de células ováricas primitivas dentro del parénquima pancreático. Por eso, se especula que las NSP surgen de precursores celulares pluripotenciales en esta área, las cuales pueden desarrollar características epiteliales, mesenquimatosas y neuroendocrinas.4,11,12,15,16
Existen escasas referencias de NSPs extrapancreáticas. Se piensa que estas raras formas provienen de tejido pancreático ectópico presente en cada sitio en específico.11
Se ha reportado, además, que 62,5 % de los pacientes están infectados por el virus de la hepatitis B (VHB), el cual puede inducir una sobreexpresión de β-catenin en las células tumorales. Esto indica que la infección por el VHB pudiera estar involucrada en la patogénesis de la NSP. Sin embargo, esto no se ha confirmado.7
I. Biología molecular
Las NSPs se caracterizan desde el punto de vista genético por la activación de β-catenin y sus células blanco. En 95 % de los casos, las NSPs muestran alteraciones de las vías del gen de la poliposis adenomatosa del colon (APC)/β-catenin y de la cyclin-D1, con mutaciones activadoras en el exón 3 del gen de la β-catenin, lo que conlleva a la acumulación nuclear y tinción positiva para β-catenin en la mayoría de las NSP. A diferencia del adenocarcinoma ductal del páncreas, las NSPs no se asocian con alteraciones en los genes K-ras, p53 ni DPC4. 11,15,17,18
Además de receptores de progesterona, las células de la NSP también pueden mostrar inmunorreactividad para synaptophysin y otros marcadores neuroendocrinos, pero solo de manera focal. Asimismo, expresan galectin-3 y CD10, lo cual es útil para diferenciar estos tumores de los neuroendocrinos.18
Aún se desconoce mucho acerca de los tumores sólidos-pseudopapilares (TSP) y es necesario continuar las investigaciones sobre su citogenética molecular. Sería muy útil, para definir conductas ante estas neoplasias, el desarrollo de un biomarcador molecular que identificase tumores potencialmente agresivos.
Patología
Los “tumor sólido-pseudopapilar” (TSP), por lo general, son neoplasias de lento crecimiento, no agresivas pero malignas, habitualmente con pronóstico muy favorable. Presentan componentes tanto sólidos como quísticos. Se distribuyen de manera equitativa en todo el páncreas, aunque algunos han reportado un ligero predominio en las porciones distales del mismo. Al examen macroscópico, por lo general son masas solitarias, bien delimitadas, separadas del resto del tejido pancreático adyacente por una cápsula fibrosa. Con frecuencia tienen gran tamaño, con un diámetro promedio de 6 cm (0,5 – 34,5 cm). Es probable que alcancen tales dimensiones debido a su curso biológico “silencioso”. Su consistencia es blanda, con material hemorrágico friable, gris necrótico en el centro. Los tumores más pequeños pueden ser completamente sólidos e imitar neoplasias endocrinas, mientras que en los más grandes los cambios degenerativos quísticos son más evidentes. En ocasiones, presentan calcificaciones (periféricas o centrales en cáscara de huevo) en las paredes quísticas. A veces presentan características atípicas. Por ejemplo, pueden formar una masa pequeña predominante sólida que produzca dilatación del conducto pancreático principal o ser extrapancreática.
Como ya mencionamos, existen algunos reportes de TSPs extrapancreáticos: mesocolon, mesenterio, hígado, omento mayor, peritoneo, retroperitoneo, duodeno, yeyuno y ovario. Miyazaki y otros realizaron una adrenalectomía laparoscópica a través de un puerto único. El estudio anatomopatológico reveló que el tumor en realidad era una NSP del retroperitoneo. La glándula adrenal izquierda estaba cerca pero separada del tumor, y plantearon que quizás esta fuera la primera NSP del retroperitoneo reportada.2-6,7,9-12,15,19-23
Desde el punto de vista histológico son lesiones encapsuladas con áreas sólidas y quísticas. La apariencia pseudopapilar se encuentra alrededor de un tallo fibrovascular. Las células tumorales monomorfas poligonales forman áreas sólidas o se agrupan en pseudorrosetas. El estroma puede ser mixoide o hialino pero con frecuencia es imperceptible. Los macrófagos espumosos son ácido periódico de Schiff (PAS) positivos. A veces el aspecto global de la NSP hace recordar una neoplasia pancreática endocrina pero sin incremento de las mitosis ni atipia celular. 3,7,9,11,12
Este aspecto puede deberse a alteraciones en las moléculas de adhesión celular provocando descohesión de las células de su vascularización, especialmente en las áreas más lejanas de la irrigación sanguínea.7,11 En las células neoplásicas suele observarse un citoplasma eosinófilo con vacuolas evidentes. El núcleo es redondo u oval, de tinción uniforme, y con frecuencia presenta digitaciones longitudinales y una cromatina con moteado fino.11
Las áreas quísticas están formadas por sangre, detritos necróticos y macrófagos espumosos. Los “quistes” dentro del TSP no son verdaderos quistes porque no tienen revestimiento epitelial, y son producto de necrosis y degeneración quística. En las proximidades de los espacios quísticos hay células espumosas, depósitos de colesterol y células gigantes a cuerpo extraño.
La microscopia electrónica también puede ayudar a diferenciar la NSP de los tumores endocrinos, pues estos últimos tienen gránulos neurosecretores característicos que están ausentes en la NSP.11
Las NSP muestran un patrón inmunohistoquímico característico con expresión nuclear de β-catenin, vimentin, CD56, CD10, RP, alfa-1 antitripsina, alfa-1 antiquimotripsina, enolasa neuron -específica y galactin-3, keratin, cromogranina (el marcador más específico de diferenciación neuroendocrina), antígeno epitelial de membrana, insulina, glucagón y las enzimas pancreáticas (tripsina y quimiotripsina); generalmente no se expresan o se encuentran solo de manera focal como habíamos mencionado.4,7,9,11,12,15
La mayoría de las NSP (>90 %) se comportan de manera “benigna”. No existen criterios morfológicos establecidos de malignidad, la cual solo pudiera definirse por la presencia de metástasis (5 % - 15 %); principalmente al hígado, peritoneo, mesenterio u omento o por invasión directa extrapancreática (estómago, duodeno, grandes vasos y bazo).13,24,25 El íctero obstructivo es infrecuente, incluso cuando la lesión se localiza en la cabeza pancreática, debido a que el colédoco rara vez está comprometido. Estos tumores, generalmente desplazan a las estructuras vecinas en lugar de infiltrarlas. En menos de 20 % de estas neoplasias hay invasión vascular o perineural. Las metástasis a ganglios linfáticos son extremadamente raras. Una revisión de 292 NSP reportó 43 (15 %) como “malignas” y de estas, los ganglios linfáticos se encontraban afectados en solo 5 pacientes (2 %).2-4,7,9,11,12,19,20
Manifestaciones clínicas
La mayoría (hasta 90 %) de los pacientes son mujeres (relación mujer: hombre de 10:1), principalmente no blancas y en la segunda o tercera década de la vida (edad promedio 22 años). Cerca de 20 – 25 % de los casos se ven en edades pediátricas. Solo 6 % se presenta en pacientes mayores de 50 años. Las NSP en hombres, por lo general, se presentan a edades más avanzadas y tienden a ser más agresivas que en las mujeres.2-4,7,8,11,15,24,26-28
Las NSP se diagnostican, con frecuencia, como hallazgos en estudios imaginológicos realizados por otras razones porque estos tumores causan escasa sintomatología hasta que alcanzan grandes dimensiones. En ocasiones hay dolor abdominal, distensión, saciedad precoz, anorexia, náuseas, pérdida de peso, pancreatitis, ictericia (1 %) o masa palpable relacionados con la compresión de órganos vecinos. Como ya mencionamos, es rara la obstrucción biliar o del conducto pancreático, incluso cuando se localizan en la cabeza del páncreas, porque son tumores suaves y no es habitual que infiltren estas estructuras. Se han reportado raros casos de hemorragia intraabdominal por ruptura del tumor. Inclusive, aquellos que se diseminan al hígado o ganglios linfáticos, pueden tener un curso clínico silente.3,6-9,11,12,15,20
Los tumores extrapancreáticos son raros y a veces no se demuestra tejido pancreático ectópico. Dentro de las presentaciones inusuales se incluyen los tumores multicéntricos en el páncreas.6,12
Imagenología y diagnóstico
No existen exámenes de laboratorio que sean específicos. Los marcadores tumorales normales en suero o en el líquido de los quistes pueden ser útiles en el diagnóstico diferencial con otras neoplasias.15
El TSP en el ultrasonido aparece como una masa heterogénea, encapsulada, bien delimitada con componentes sólido ecogénico y quístico hipoecoico, en ocasiones con calcificaciones. A veces, se manifiesta como hipoecoico puro o masas sólidos debido a hemorragias o sombras acústicas por calcificaciones. El ultrasonido endoscópico (USE) es útil para el diagnóstico imagenológico y para obtener muestras para el diagnóstico anatomopatológico.15,20
El ultrasonido contrastado (USC) es la única técnica de imágenes que permite una evaluación dinámica en tiempo real e identificación precisa de la circulación del tumor. Puede mostrar de manera adecuada las características “histológicas” de estas lesiones al reflejar su perfusión, lo cual es útil para diferenciarlas de los carcinomas pancreáticos, de las masas inflamatorias o de los tumores pancreáticos hipervascularizados. En el USC, las NSPs tiene un anillo periférico con reforzamiento uniforme (relacionado con la cápsula de tejido fibroso y el parénquima pancreático vecino comprimido) y un reforzamiento interno heterogéneo, incluso sitios sin reforzamiento, durante la fase arterial con lavado rápido del contraste durante la fase venosa. Por esto, el USC es mejor que el convencional para visualizar la cápsula, la hemorragia intratumoral y la degeneración quística.12,20,29-35 La presencia de la cápsula y de la hemorragia intratumoral son indicadores importantes para el diagnóstico de la NSP.20,35
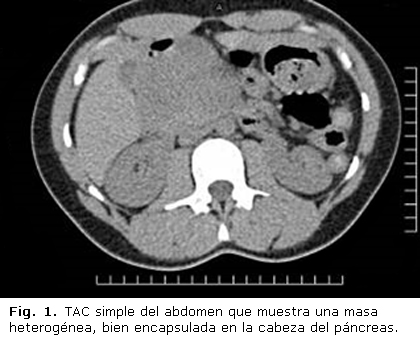
La TAC (Fig. 1) y la resonancia magnética nuclear (RMN) se usan con frecuencia. La NSP se clasifica en dos subgrupos: grande (> 3 cm) y pequeña (< 3 cm):11
I. Tumor grande: Aparece en la TAC como una masa bien delimitada, encapsulada, heterogénea e hipovascular con una cápsula periférica y gruesa que capta contraste. En la TAC contrastada, el realce ocurre durante la fase arterial precoz (Fig. 2). Esta compleja apariencia se debe a la presencia de cantidades variables de degeneración quística/necrosis y hemorragia intraquística. La extensión de la necrosis y la hemorragia varía mucho, y por ende, la NSP puede parecer casi quística o sólida en su totalidad, pero una masa que capta poco contraste con necrosis central en parches es lo más frecuente. La calcificación irregular (sobre todo periférica aunque puede ser central) se presenta en hasta 65 % de los pacientes. Puede verse el desplazamiento de estructuras contiguas por efecto de masa. La RMN muestra intensidad variable en las imágenes T1, señal de intensidad alta heterogénea en las imágenes T2 y realce heterogéneo periférico precoz con un llenado progresivo en la RMN dinámica contrastada con gadolinio. Con ella se ven mejor las hemorragias y supera a la TAC en la detección de los componentes sólidos y quísticos. La TAC muestra mejor las calcificaciones que la RMN. Estas características ayudan en el diagnóstico diferencial de este raro tumor con otros cánceres pancreáticos.2,4,7,11,12,15,20
II. Tumor pequeño: Es una masa pequeña menos frecuente, homogénea, predominantemente sólida, que puede producir dilatación del conducto pancreático principal. Tienen menos calcificaciones que las lesiones más grandes.2,3,7,11,20
Por lo general, la angiografía muestra un tumor avascular o hipovascular y puede ayudar a delimitarlo de otras estructuras vecinas.12
La necesidad de obtener una citología preoperatoria ha sido tema de debate. Algunos defienden el uso de la citología aspirativa con aguja fina (CAAF). Estos plantean que la CAAF guiada por USE es un método de diagnóstico mínimamente invasivo, seguro y confiable. La CAAF es de mucha ayuda para diferencial estos tumores de otras lesiones quísticas pancreáticas y diagnostica cerca de 75 % de los casos.3,15,29
Por otra parte, hay quienes consideran que la NSP puede diseminarse fuera del páncreas, principalmente en el peritoneo. Esto puede deberse a traumas, incluyendo la CAAF y las biopsias del tumor (por laparotomías o laparoscópicas). Además, se han visto complicaciones como sangrado y fístulas biliares y/o pancreáticas por el proceder.3,7,26
Nosotros consideramos que la apariencia imagenológica es característica y puede sugerir el diagnóstico. Las imágenes por TAC y RMN, junto con la edad y el sexo, deben ser suficientes para decidir la realización de la intervención quirúrgica. Las intervenciones diagnosticas como la CAAF deben ser realizadas en casos dudosos, cuando la imagenología no es diagnóstica, para evitar un tratamiento neoadyuvante no indicado.2,7,12,15,26
Tratamiento
Las NSPs se consideran tumores de bajo grado de malignidad. Se recomienda la cirugía en todos los pacientes.7,8,11,13,25,26,28 Debe realizarse una resección oncológica, con bordes quirúrgicos negativos para lograr el control local de la enfermedad, prevenir la recurrencia y las metástasis, aliviar los síntomas y asegurar un buen pronóstico a largo plazo. La biopsia por congelación intraoperatoria asegura bordes de sección negativos. Por lo general, las lesiones en la cabeza del páncreas requieren duodenopancreatectomía, en el cuerpo/cola pancreatectomía distal con preservación esplénica y en el cuello/cuerpo proximal resección del cuerpo.2,7,10,15,28
Existen autores que han propuesto la enucleación como tratamiento. Sin embargo, esta debe evitarse, debido al riesgo de diseminación del tumor de desarrollar una fístula pancreática, y a la gran tasa de recurrencia (73 %) si el tumor no es resecado completamente. Además, disminuye dramáticamente la tasa de supervivencia cercana a 100 % que se alcanza con la resección R0.7,12,15
Dado que las metástasis linfáticas son extremadamente raras (< 2 %) pueden considerarse las técnicas con conservación pancreática, esplénica y la pancreatectomía con preservación del píloro. Peng-Fei Yu y otros.7 encontraron metástasis a ganglios linfáticos en solo 3 pacientes (0.61 %). La linfadenectomía formal no está indicada. Las resecciones pancreáticas centrales son muy útiles, y las fístulas pancreáticas en estos pacientes jóvenes, por lo general, se controlan mejor. En ocasiones, la preservación esplénica se torna difícil por el gran tamaño que pueden alcanzar estas neoplasias.7,12,13,28
La invasión a órganos vecinos y/o estructuras vasculares es rara, pero pudiera estar presente y requerir resecciones extensas. Las resecciones masivas, en grandes bloques del tumor primario con órganos vecinos, de sus recurrencias y las metástasis se justifican debido a los excelentes resultados a largo plazo. El tamaño del tumor no debe considerarse un predictor de irresecabilidad, tumores mayores de 30 cm se han extirpado. Sin embargo, la derivación quirúrgica puede ser la única opción en pacientes en los cuales la resección en masa se acompañaría de una excesiva morbilidad. Si la vena porta, mesentérica y/o el confluente venoso están infiltrados entonces puede realizarse un baipás con injerto sintético o de vena yugular.1,5,7,9,10,12,13,15,25,36 Sperti y otros, 37 reportaron 17 pacientes con resección y reconstrucción vasculares sin mortalidad. En las recurrencias y metástasis se pueden realizar incluso múltiples resecciones.5,9 Martin y otros,9 reportaron que cuatro a pacientes se les realizó resección del tumor primario y de metástasis hepáticas y dos de ellos sobrevivieron al menos 6 y 11 años respectivamente.
También se han empleado otras modalidades terapéuticas para las metástasis hepáticas, como la inyección de alcohol, quimioembolización transarterial (QUETA), la ablación por radiofrecuencia (ARF) y la terapia con radiación γ.8,12,46,47
Cada vez se emplean más las resecciones pancreáticas laparoscópicas por neoplasias quísticas, especialmente las pancreatectomias distales, incluso con preservación esplénica. Este es un proceder seguro y factible que pudiera convertirse en el tratamiento de elección de las NSPs del páncreas.3,26 Según Cavallini y otros,26 solo se habían reportado 17 pacientes con TSP, a los que se les ha realizado pancreatectomias distales laparoscópicas y no existen datos de seguimientos a largo plazo.
La carcinosis peritoneal (CP) es rara con solo 11 pacientes reportados hasta el año 2012. Honore y otros,39 describieron un 12 vo caso que ocurrió 13 años después de la resección de un TSP con ruptura intraoperatoria. Esta paciente de 35 años de edad recibió entonces una cirugía citorreductora (CCR) y presentó recaída a los 8 meses. Posteriormente, la CCR se combinó con quimioterapia hipertérmica intraperitoneal (QHI) empleando oxaliplatin e irinotecan. Hasta que se publicó su artículo, la paciente vivía y tenía 31 meses libre de enfermedad. Ellos afirman que el tratamiento quirúrgico de la CP por una NSP aún tiene resultados desalentadores con un 58 % de recurrencia entre 1 y 19 años. Como ninguno de estos pacientes desarrolló metástasis a otros sitios, lo cual indica enfermedad peritoneal exclusiva, la QHI puede ser una solución para prevenir las recurrencias. No hemos visto ningún paciente con NSP y CP.
No hay datos concluyentes respecto al tratamiento neoadyuvante. En algunos estudios se ha visto regresión de la NSP tras diferentes regímenes de quimioterapia y radioterapia pero en otros no.12,40,41 Por ejemplo, Hah y otros,42 reportaron una niña de 14 años con una NSP irresecable. Ella recibió quimioterapia preoperatoria con ARF intraoperatoria de metástasis hepáticas y el tumor primario se resecó con éxito. A los 3 años no existían recurrencia ni metástasis. Sugito y otros,43 describieron una niña de 11 años con una NSP gigante entre 10,0 – 13,7 cm. La QUETA y la ARF disminuyeron el tumor a 8,3 – 6,7 cm en dos años. Luego se realizó la resección completa del tumor y no se ha observado recurrencia al año de seguimiento. Todavía se debe estudiar el papel de la quimioterapia y radioterapia. En conclusión, no existe un tratamiento específico para lograr la migración de estadios. 7,13,38
Pronóstico
La NSP tiene bajo potencial maligno y su curso natural es indolente, no agresivo, de lento crecimiento y mortalidad inferior a 2 %. Cerca de 85 % de los pacientes presentan enfermedad local al momento del diagnóstico, y por tanto entre 10 - 15 % tienen enfermedad diseminada. Cuando la resección es completa el pronóstico a largo plazo es excelente, con una supervivencia a los 5 años de 95 %.7,8,12,13,15,24-26,37 En pacientes con enfermedad metastásica el pronóstico sigue siendo bueno, con mortalidad de solo 18,2 % con una media de seguimiento de 6,3 años (intervalo de 1 - 16). Las imágenes posoperatorias se obtienen cada 6 meses durante 2 años y luego anualmente de por vida; debido al comportamiento indolente de estos tumores.7,13,44
Dado el pronóstico favorable y larga supervivencia de los pacientes con NSP primaria, recurrencia o metástasis, es difícil identificar factores predictivos de supervivencia o recurrencia.7,9,11,24,27 Sin embargo, algunos autores asocian mayor riesgo de recurrencia y peor pronóstico (10 - 15 % de los casos) con sexo masculino, edad avanzada, patrón de crecimiento infiltrante difuso, ruptura de la cápsula tumoral, tumor grande (> 6,0 cm), localización en cola de páncreas, metástasis, invasión vascular, pleomorfismo nuclear, necrosis extensa, actividad mitótica elevada, aneuploidía, pérdida doble de los cromosomas X, trisomía del cromosoma 3, traslocación no balanceada entre los cromosomas 13 y 17, invasión perineural o del parénquima pancreático vecino.12,15,16,24,45-48 Por el contrario, tumores con calcificaciones amorfas o dispersas y todos los casi sólidos pudieran tener menor agresividad.11
En las recurrencias, es posible que el tumor se disemine al hígado o peritoneo y, en raros casos a ganglios linfáticos, pulmones o piel. El índice de recurrencia local es menor de 10 % y, por lo general, aparecen entre los primeros 4 años después de la cirugía. 6,7,15,25,26,37 La recurrencia de metástasis hepáticas se ha visto hasta después de 15 años y principalmente en mujeres de edad avanzada.13,49
En algunos pacientes se ha reportado transformación anaplásica con un curso clínico agresivo.15,50
CONCLUSIÓN
La NSP es infrecuente y de bajo grado de malignidad, con pronóstico favorable. La mayoría de los pacientes son mujeres, principalmente no caucásicas en la segunda o tercera décadas de vida. Como tratamiento, se recomienda la resección oncológica sin linfadenectomía formal. El tamaño del tumor no es criterio de irresecabilidad. Se requieren más investigaciones en cuanto a su patogénesis, biología molecular y tratamiento con quimio y radioterapia.
REFERENCIAS BIBLIOGRÁFICAS
1. Campanilea M, Nicolasb A, LeBelc S, Delarue a A, Guysa JM, de Lagausiea P. Frantz's tumor: Is mutilating surgery always justified in young patients? Surg Oncol. 2011;20(2):121-5.
2. de Castro SMM, Singhal D, Aronson DC, Busch ORC, van Gulik TM, Obertop H, et al. Management of Solid-pseudopapillary Neoplasms of the Pancreas: a Comparison with Standard Pancreática Neoplasms. World J Surg. 2007;31(5):1130-5.
3. Farrell JJ, Fernández - del Castillo C. Pancreática Cystic Neoplasms: Management and Unanswered Questions. Gastroenterology. 2013;144(6):1303 -15.
4. Cantisani V, Mortele KJ, Angela L, Glickman JN, Ricci P, Passariello R, et al. MR imaging features of solid pseudopapillary tumor of the pancreas in adult and pediatric patients. Am J Roentgenol. 2003;181(2):395-401.
5. El Nakeeb A, Wahab MA, Elkashef WF, Azer M, Kandil T. Solid pseudopapillary tumour of the pancreas: Incidence, prognosis and outcome of surgery (single center experience). Internat J Surg. 2013;11(6):447-57.
6. Miyazaki Y, Miyajima A, Maeda T, Yuge K, Hasegawa M, Kosaka T, et al. Extra-pancreatic solid pseudopapillary tumor: case report and review of the literature. Int J Clin Oncol. 2012;17(2):165-8.
7. Peng-Fei Y, Zhen-Hua H, Xin-Bao W, Jian-Min G, Xiang-Dong Ch, Yun-Li Z, et al. Solid pseudopapillary tumor of the pancreas: A review of 553 cases in Chinese literature. World J Gastroenterol. 2010;16(10):1209 -14.
8. Law JK, Ahmed A, Singh VK, Akshintala VS, Olson MT, Raman SP, et al. A systematic review of solid-pseudopapillary neoplasms: are these rare lesions? Pancreas. 2014;43(3):331-7.
9. Martin RC, Klimstra DS, Brennan MF, Conlon KC. Solid-Pseudopapillary Tumor of the Pancreas: A Surgical Enigma?. Ann Surg Oncol. 2002;9(1):35-40.
10. Li J, Wu H, Huang J, Pankaj P, Zeng Y. Synchronous intraoperative radiofrequency ablation for multiple liver metastasis and resection of giant solid pseudopapillary tumors of the pancreas. Chin Med J. 2012;125(9):1661-3.
11. Ganeshan DM, Paulson E, Tamm EP, Taggart M, Balachandran A, Bhosale P. Solid pseudo-papillary tumors of the pancreas: current update. Abdom Imaging . 2013;38(6):1373-82.
12. Nikolaos V, Agaimy A, Klein P, Hohenberger W, Croner S. Solid-pseudopapillary neoplasm (SPN) of the pancreas: case series and literature review on an enigmatic entity. Int J Clin Exp Pathol. 2013;6(6):1051-9.
13. Del Chiaro M, Verbeke C, Salvia R, Klöppel G, Werner J, McKay C, et al. The European Study Group on Cystic Tumours of the Pancreas. European experts consensus statement on cystic tumours of the pancreas. Digest and Liver Dis. 2013;45(9):703-11.
14. Tognarini I, Tonelli F, Nesi G, Martineti V, Galli G, Gozzini A, et al. In vitro effects of oestrogens, antioestrogens and SERMs on pancreatic solid pseudopapillary neoplasm-derived primary cell culture. Analytical Cell Pathol. 2010;32(5-6):331-43.
15. Sakorafas GH, Smyrniotis V, Reid-Lombardo KM, Sarr MG. Primary pancreatic cystic neoplasms of the pancreas revisited. Part IV: Rare cystic neoplasms. Surg Oncol. 2012;21(3):153-63.
16. Jinhua Y, Mingzhe M, Dongfeng Ch, Fei Y, Xiaxing D, Qian Z, et al. P. Solid-pseudopapillary tumor of the pancreas: Clinical features, pathological characteristics and origin. J Surg Oncol. 2012;106(6):728 -35.
17. Abraham SC, Klimstra DS, Wilentz RE, Yeo ChJ, Conlon K, Brennan M, et al. Solid-pseudopapillary tumours of the pancreas are genetically distinct from pancreatic ductal adenocarcinomas and almost always harbor beta-catenin mutations. Am J Pathol. 2002;160(4):1361-9.
18. Chetty R, Serra S. Loss of expression of E-cadherin in solid pseudopapillary tumors of the pancreas. Pancreas. 2009;38(3):338.
19. Choi JY, Kim MJ, Kim JH, Kim SH, Lim JS, Oh YT, et al. Solid pseudopapillary tumor of the pancreas: typical and atypical manifestations. Am J Roentg. 2006;187(2):178-86.
20. Tang SS, Huang LP, Wang Y, Ma Y. Solid Pseudopapillary Tumors of the Pancreas. Contrast-Enhanced Sonographic Features. J Ultrasound Med. 2012;31(2):257-63.
21. Syriac S, Kesterson J, Izevbaye I, de Mesy Bentley KL, Lele S, Mhawech-Fauceglia P. Clinically aggressive primary solid pseudopapillary tumor of the ovary in a 45-year-old woman. Ann Diag Pathol. 2012; 16(6):498-503.
22. Slidell MB, Schmid EF, Jha RC, Rossi CT, Becker TE, Guzzetta PC. Solid pseudopapillary tumor in a pancreatic rest of the jejunum. J Pediatr Surg. 2009;44(4):25-7.
23. Cheuk W, Beavon I, Chui DT, Chan JK. Extrapancreatic solid pseudopapillary neoplasm: report of a case of primary ovarian origin and review of the literature. Int J Gynecol Pathol. 2011;30(6):539-43.
24. Tipton SG, Smyrk TC, Sarr MG, Thompson GB. Malignant potential of solid pseudopapillary neoplasm of the pancreas. Br J Surg. 2006;93(6):733-7.
25. Papavramidis T, Papavramidis S. Solid pseudopapillary tumors of the pancreas: review of 718 patients reported in English literature. J Am Coll Surg. 2005;200(6):965-72.
26. Cavallini A, Butturini G, Daskalaki D, Salvia R, Melotti G, Piccoli M, et al. Laparoscopic Pancreatectomy for Solid Pseudo-Papillary Tumors of the Pancreas is a Suitable Technique; Our Experience with Long-Term Follow-up and Review of the Literature. Ann Surg Oncol. 2011;18(2):352-7.
27. Reddy S, Cameron JL, Scudiere J, Hruban RH, Fishman EK, Ahuja N, et al. Surgical management of solid-pseudopapillary neoplasms of the pancreas (Frantz or Hamoudi tumors): a large single-institutional series. J Am Coll Surg. 2009;208(5):950-7.
28. Butte JM, Brennan MF, Gönen M, Tang LH, D’AngelicaMI, Fong Y, et al. Solid pseudopapillary tumors of the pancreas. Clinical features, surgical outcomes, and long-term survival in 45 consecutive patients from a single center. J Gastrointest Surg. 2011;15(2):350-7.
29. Stoita A, Earls P, Williams D. Pancreática solid pseudopapillary tumours - EUS FNA is the ideal tool for diagnosis. ANZ J Surg. 2010;80(9):615-8.
30. Kersting S, Konopke R, Kersting F, Volk A, DistlerM, Bergert H, et al. Quantitative perfusion analysis of transabdominal contrast-enhanced ultrasonography of pancreatic masses and carcinomas. Gastroenterol. 2009;137(6):1903-11.
31. D’Onofrio M, Gallotti A, Principe F, Mucelli RP. Contrast-enhanced ultrasound of the pancreas. World J Radiol. 2010;2(3):97-102.
32. Faccioli N, Crippa S, Bassi C, D’Onofrio M. Contrast-enhanced ultrasonography of the pancreas. Pancreatology. 2009;9(5):560-6.
33. Malagò R, D’Onofrio M, Zamboni GA, Faccioli N, Falconi M, Boninsegna L, et al. Contrast-enhanced sonography of nonfunctioning pancreatic neuroendocrine tumors. Am J Roentgenol. 2009;192(2):424-30.
34. D’Onofrio M, Zamboni G, Faccioli N, Capelli P, Mucelli RP. Ultrasonography of the pancreas, contrast-enhanced imaging. Abdom Imaging. 2007;32(2):171–81.
35. Xu M, Xie XY, Liu GJ, Xu HX, Xu ZF, Huang GL, et al. The application value of contrast-enhanced ultrasound in the differential diagnosis of pancreatic solid-cystic lesions. Europ J Radiol. 2012;81(7):1432-37.
36. Lee JS, Han HJ, Choi SB, Jung CW, Song TJ, Choi SY. Surgical outcomes of solid pseudopapillary neoplasm of the pancreas: a single institution’s experience for the last ten years. Am Surgeon. 2012;78(2):216-9.
37. Sperti C, Berselli M, Pasquali C, Pastorelli D, Pedrazzoli S. Aggressive behaviour of solid-pseudopapillary tumor of the pancreas in adults: a case report and review of the literature. World J Gastroenterol. 2008;14(6):960-5.
38. Sumida W, Kaneko K, Tainaka T, Ono Y, Kiuchi T, Ando H. Liver transplantation for multiple liver metastases from solid pseudopapillary tumor of the pancreas. J Pediatr Surg. 2007;42(12):27-31.
39. Honore C, Goere D, Dartigues P, Burtin P, Dumont F, Elias D. Peritoneal carcinomatosis from solid pseudopapillary neoplasm (Frantz's tumour) of the pancreas treated with HIPEC. Anticancer Res. 2012;32(3):1069-73.
40. Maffuz A, Bustamante F de T, Silva JA, Torres-Vargas S. Preoperative gemcitabine for unresectable, solid pseudopapillary tumour of the pancreas. The Lancet Oncol. 2005;6(3):185-6.
41. Romics LJr, Oláh A, Belágyi T, Hajdú N, Gyűrűs P, Ruszinkó V. Solid pseudopapillary neoplasm of the pancreas-proposed algorithms for diagnosis and surgical treatment. Langenbeck’s Arch of Surg. 2010;395(6):747-55.
42. Hah JO, Park WK, Lee NH, Choi JH. Preoperative chemotherapy and intraoperative radiofrequency ablation for unresectable solid pseudopapillary tumor of the pancreas. J Pediatr/ Hematol Oncol. 2007;29(12):851-53.
43. Sugito K, Kusafuka T, Hoshino M, Inoue M, Ikeda T, Hagiwara N, et al. Application of radiofrequency ablation for giant solid pseudopapillary tumor of the pancreas. Pediatrics International. 2010;52(1):29-31.
44. Lennon AM, Wolfgang C. Cystic Neoplasms of the Pancreas. J Gastrointest Surg. 2013;17(4):645-53.
45. Ansari D, Elebro J, Tingstedt B, Ygland E, Fabricius M, Andersson B, et al. Single-institution experience with solid pseudopapillary neoplasm of the pancreas. Scand J Gastroenterol. 2011;46(12):1492-7.
46. Kang CM, Kim KS, Choi JS, Hoguen K, Woo JL, Byong RK. Solid pseudopapillary tumor of the pancreas suggesting malignant potential. Pancreas. 2006;32(3):276-80.
47. Serra S, Chetty R. Revision 2: an immunohistochemical approach and evaluation of solid pseudopapillary tumour of the pancreas. J Clin Pathol. 2008;61:1153-9.
48. Machado MC, Machado MA, Bacchella T, Jukemura J, Almeida JL, Cunha JE. Solid pseudopapillary neoplasm of the pancreas: distinct patterns of onset, diagnosis and prognosis for male versus female patients. Surg. 2008;143(1):29-34.
49. Gomez P, Yorke R, Ayala AG, Ro JY. Solid-pseudopapillary neoplasm of pancreas with long delayed liver metastasis. Ann Diagnostic Pathol. 2012;16(5):380-4.
50. Adsay NV. Cystic neoplasia of the pancreas: Pathology and biology. J Gastrointest Surg. 2008;12(3):401-4.
Recibido: 23 de diciembre de 2014
Aprobado: 28 de enero de 2015
Eduardo Blanco Faramiñán . Hospital Clinicoquirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
Correo electrónico: eduardo.blanco@infomed.sld.cu