Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Estomatología
versión On-line ISSN 1561-297X
Rev Cubana Estomatol v.46 n.4 Ciudad de La Habana oct.-dic. 2009
PRESENTACIONES DE CASOS
Utilización de células madre en el tratamiento de defectos óseos periodontales
Stem-cells used in treatment of periodontal bone defects
Amparo Pérez BorregoI; Libia Domínguez RodríguezII; Zaida Teresa Ilisástigui OrtuetaIII; Porfirio Hernández RamírezIV
IMáster en Urgencias Estomatológicas. Especialista de I y II Grado en Periodoncia.
Profesora Auxiliar. Facultad de Ciencias Médicas "Enrique Cabrera", Ciudad de La Habana, Cuba.
IIEspecialista de I Grado en Periodoncia. Instructora. Facultad de Estomatología. Ciudad de La Habana, Cuba.
IIIDoctora en Ciencias Médicas. Especialista de II Grado en Periodoncia. Profesora Titular y Consultante. Facultad de Estomatología. Ciudad de La Habana, Cuba.
IVDoctor en Ciencias Médicas. Profesor Titular. Investigador Titular. Instituto de Hematología e Inmunología, Ciudad de La Habana, Cuba.
RESUMEN
La periodontitis agresiva puede llevar a la pérdida del diente, de la función y afectar la estética del paciente. Las técnicas para la regeneración del hueso perdido no siempre son exitosas y en ocasiones resultan muy costosas. Desde hace algunos años se trabaja en la regeneración de tejidos mediante la implantación de células madre. El periodonto podría considerarse un potencial para ello. Se presenta el estudio de una paciente femenina de 26 años de edad, con aparente estado de salud y antecedentes de periodontitis agresiva tratada hace 10 años, que acudió a nuestro Servicio por movilidad dentaria que ocasionaba molestias a la masticación. Al realizar el examen clínico observamos encía con inflamación crónica generalizada, movilidad dentaria grados II y III en incisivos y molares, bolsas periodontales de 4 a 8 mm generalizadas y lesiones de furcación en molares inferiores. En las radiografías se observó pérdidas óseas avanzadas y disminución de la densidad ósea generalizada. Después de dar su consentimiento y realizar preparación inicial, se realizó colgajo periodontal en la zona del 35 a 37 donde se colocó el concentrado de células madre, en los defectos óseos de molares superiores (16-17), y previo raspado y alisado radicular, el tratamiento consistió en perfusión de células madre, sin hacer colgajo. No se presentaron efectos adversos posoperatorios. A los siete días la encía tuvo una coloración normal, a los tres meses se observó radiográficamente neoformación ósea y a los seis meses la encía se mantuvo sana, hubo disminución de la movilidad dentaria en los sectores tratados y en la radiografía evolutiva se evidenció formación y aumento de la densidad ósea.
Palabras clave: periodontitis agresiva, células madre, defectos óseos.
ABSTRACT
The aggressive periodontitis might to provoke the tooth loss, of its function and to affect the patient's aesthetics. The techniques used for the lost bone regeneration, not always are successful and in occasions are very expensive. For years it is working in tissues regeneration by stem-cells implantation. Periodontium could be a potential for this task. This is a study of a female patient aged 26 with an apparent health status and aggressive periodontitis backgrounds treated from 10 years ago, seen in our service due to dental mobility producing mastication nuisances. At clinical examination we noted systemic chronic inflammation of gums, grade II and III dental mobility in incisives and molars teeth, 4-8 mm systemic periodontal sacs and furcation lesions in inferior molars. At radiographs advanced bone losses and a decrease of systemic bone density are noted. After written consent and the initial preparation, we carried out a periodontal flap in the 35 and 37 teeth zone, where the stem-cells concentrate was placed, in bone defects of superior molars (16-17) and previous radicular scraping and isolation, treatment consisted in stem-cells perfusion without flap. There were not postoperative side effects. At 7 days there was a normal coloration, at three months on noted at radiograph a bone neoformation, and at six months gum remained healthy, with a decrease of dental mobility in segment treated and in the evolutionary radiograph it was evidenced the formation and increase of density.
Key words: Aggressive periodontitis, stem-cells, bone defects.
INTRODUCCIÓN
La periodontitis agresiva (PA) progresa rápidamente y se caracteriza por su manifestación a una temprana edad, puede afectar severamente a uno o más dientes. Su prevalencia es baja (0,1 % de la población), es más frecuente en personas de piel negra y afecta igualmente a ambos sexos.1
El problema que representa la pérdida ósea en la enfermedad periodontal, que puede llevar a la pérdida dentaria, es objeto de estudio desde hace años. Las técnicas para resolverlo mejoraron con el tiempo, aunque no siempre son totalmente exitosas y en ocasiones resultan sumamente costosas.2-4
Nuevos planteamientos, basados en el conocimiento de la biología celular y molecular en el desarrollo y regeneración periodontal, ofrecen interesantes alternativas a los tratamientos actuales.5
Desde hace algunos años se trabaja en la regeneración de tejidos mediante la implantación de células madre,6-8 el periodonto podría considerarse un potencial para ello, a pesar de que solo se reporta al respecto un estudio en Nagoya, Japón.8
El objetivo de este trabajo es la comunicación de un paciente con PA que presentó ostensible mejoría después del tratamiento con células madre adultas autólogas.
Caso clínico
Paciente femenina de 26 años de edad, color de la piel negra, con antecedentes de salud general e historia de más de 10 años de PA, para lo cual recibió tratamiento quirúrgico en el año 2000. En noviembre del 2007 acudió a la consulta de Periodoncia del servicio de Cirugía Maxilofacial del Hospital "William Soler", donde se le propuso su inclusión en el proyecto de investigación. Al interrogatorio refirió dolor e inseguridad a la masticación, producto de la movilidad dentaria presente. Al realizar el examen clínico se observó que la encía presentó signos de inflamación crónica generalizada, migración y movilidad dentaria grado II y III en incisivos y molares, bolsas periodontales profundas generalizadas (4-8 mm), lesiones de furca grado III subclase A en molares inferiores y el índice de análisis de higiene bucal de Love mostró 36 % de superficies coloreadas, lo cual se consideró aceptable si se tiene en cuenta el grado de movilidad que dificultaba los procedimientos higiénicos. El estudio radiográfico mostró pérdidas óseas angulares avanzadas con imágenes simétricas en región de molares, lesiones de furca, desorganización del trabeculado óseo y amplios espacios medulares. Una vez realizada la evaluación periodontal, se le informó a la paciente ampliamente respecto a los procedimientos quirúrgicos periodontales propuestos, el material de injerto, así como la incertidumbre de emplear un nuevo método de regeneración ósea. Esta dio su consentimiento a la inclusión en el proyecto de investigación, que se recogió en la planilla de consentimiento informado, de acuerdo con lo establecido en la Declaración de Helsinki, sobre las investigaciones en seres humanos con fines terapéuticos.9
Se procedió a realizar evaluación hematológica para determinar si la paciente era idónea para la realización de la técnica. Para la movilización de las células mononucleares a sangre periférica (CMN-SP) la paciente recibió, previamente, tratamiento con 10 µg/kg de factor estimulador de colonias granulocíticas humano recombinante (Leuko CIM, CIMAB S.A. La Habana, Cuba) que se administró por vía subcutánea cada 12 horas hasta un total de cuatro. Tres horas después de la última dosis se obtuvieron 1 500 mL de sangre total. Posteriormente las CMN-SP se concentraron por sedimentación después de la adición a la sangre extraída de hidroxietilalmidón (HES) al 6 % en una proporción de 1 mL de HES × 6 mL de sangre total. Se usó una pequeña fracción de la suspensión de las células para el recuento celular, la determinación de la positividad CD34, la prueba de viabilidad mediante exclusión del azul tripán y para el estudio microbiológico. El recuento celular se efectuó en un contador automático de células sanguíneas (SEAC, Genius, Italia) y el análisis de las células CD34+ se llevó a cabo por un procedimiento inmunocitoquímico previamente descrito,10 para el que se utilizó un anticuerpo CD34 de la Firma Serotec, Ltd, Reino Unido. El volumen del concentrado celular final fue de 33 mL con una viabilidad celular de 92 %.
La conducta que seguimos desde el punto de vista del tratamiento periodontal se basó en el plan maestro de tratamiento, en la fase I y II para un enfermo con periodontitis avanzada, y se adicionó en la fase II la perfusión de células madre en los defectos óseos del sector superior tratado (Fig. 1). La fase correspondiente al tratamiento quirúrgico incluyó colgajo Kirkland tradicional, más la colocación de las células madre en los defectos óseos inferiores antes de suturar el colgajo (Fig. 2), ambas zonas fueron cubiertas con el apósito periodontal en forma de cemento, de producción nacional.
En cada sitio de implantación se infundió de 0,5 a 1 mL del concentrado celular. En total se implantaron 13 mL con 0,52 × 109 de CMN-SP y 5 × 106 de células CD34+.
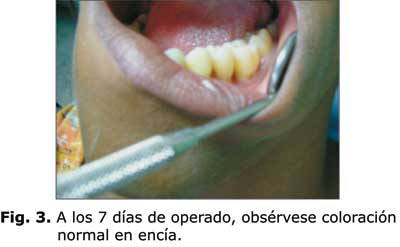
Se le indicó a la paciente colutorios de clorhexidina acuosa al 0,12 % y azitromicina por vía oral durante 6 días. A la semana, previo enjuague bucal con clorhexidina al 0,12 %, se retiraron el apósito y la sutura (Fig. 3).
No se presentaron efectos adversos durante la semana posterior al tratamiento descrito y al examen clínico que se realizó a los siete días, ni se observaron signos de inflamación gingival. A las tres semanas la paciente refirió mayor seguridad durante la masticación que antes del tratamiento. A los tres meses se realizó la evaluación clínica y radiográfica, se observó que la encía se mantuvo normal y la radiografía mostró zona radiopaca en el lugar del defecto, compatible con neoformación ósea. A los 6 meses la encía persistió con características de normalidad, hubo disminución de la movilidad dentaria en los sectores tratados, disminución del número de bolsas y las que se mantuvieron disminuyeron su profundidad a 3 mm y en la radiografía evolutiva se apreció aumento de la densidad ósea (Figs. 4 y 5).
DISCUSIÓN
En la actualidad el tratamiento con células madre se considera un avance de la medicina contemporánea y un pilar fundamental en el surgimiento de la medicina regenerativa. Una contribución a la rápida aplicación de este tipo de medicina fue el conocimiento de que las células madre adultas poseían una capacidad regenerativa mayor de lo que convencionalmente se aceptaba, pues se evidenció que estas podían dar lugar a células de diferentes tejidos del organismo, entre ellas el tejido óseo.6,7,11-13
Estos conocimientos contribuyeron a la aplicación de las células madre adultas como un método muy prometedor de terapia celular regenerativa en diferentes enfermedades que por la terapéutica convencional no tenían curación o los resultados eran muy limitados.6,7 Actualmente se trabaja en la investigación con células madre embrionarias y células madre adultas. Aunque las investigaciones con células madre embrionarias aportan resultados muy prometedores estos, generalmente, se encuentran en fase de investigaciones básicas y ensayos preclínicos, mientras que las células madre adultas pasaron rápidamente a la aplicación clínica y en la actualidad existen diferentes publicaciones que avalan su utilidad.14-18
Sobre la base de estos datos, resulta razonable pensar que la terapia celular regenerativa con células madre adultas puede ser de utilidad en el tratamiento de las periodontitis, si se tiene en cuenta la posibilidad de regeneración ósea que puede derivar de este tratamiento.
Hasta donde conocemos, existe solo un reporte en que se utilizó la terapia celular regenerativa en un paciente con periodontitis y se obtuvieron resultados prometedores.8 Nuestro estudio coincide con estos. Una observación destacada en nuestro caso fue la rápida respuesta inicial que se evidenció en la encía. Todos los signos inflamatorios desaparecieron en solo 7 días. Para la explicación de este hecho debemos tomar en cuenta los posibles mecanismos de acción de las células madre implantadas, que pudieran explicar los rápidos cambios clínicos iniciales, estos podrían estar en relación con la liberación de factores de crecimiento -citocinas entre ellos- con capacidad antinflamatoria, angiogénica y vasodilatadora, entre otras funciones, elementos estos que se señalan pueden tener una capacidad autocrina al actuar sobre las propias células implantadas y también paracrina por su acción sobre las células vecinas en el tejido de implantación. Este mecanismo es en la actualidad un aspecto que se ha destacado para explicar la acción rápida que se reporta en algunos casos después de la implantación celular.
Por otra parte, además de este efecto liberador de sustancias solubles, se plantea la capacidad de transdiferenciación y de fusión celular a las células del tejido enfermo que pueden efectuar las células madre trasplantadas, mecanismo que sería más lógico para explicar los cambios que se observan evolutivamente en el tejido óseo.15,18,19
La observación de inexistencia de manifestaciones secundarias al tratamiento regenerativo, concuerda con lo que reportan otros autores que emplean este proceder terapéutico en otras entidades.7,8,18,19
En general, nuestro reporte apoya la posibilidad de obtener mejoría en los pacientes con periodontitis, con probabilidades de mejores corolarios al año de evolución, y justifica plenamente continuar la investigación con un número mayor de pacientes, que pueda aportar mayores evidencias para la utilización de este nuevo proceder terapéutico.
REFERENCIAS BIBLIOGRÁFICAS
1. Mauricio S, Mombelli A. Periodontitis precoz. En: Lindhe J, Karring T, Lang N. Periodontología clínica e implantología odontológica. Madrid: Médica Panamericana; 2000. p. 229.
2. Valdés H, Sanjurjo VM, Cepero DM. El láser en la regeneración ósea periodontal. Avances Médicos de Cuba. 2002;9:58-60.
3. Marinucci L, Lilli C, Baroni T, Becchetti E, Belcastro S, Balducci C, Locci P. In vitro comparison of bioabsorbable an non-resorbable membranes in bone regeneration. Journal of Periodontology. Jun 2001;72:753-9.
4. Faul BF, Horning GM, Hellstein JW, Schafer DR. The osteoinductive potential of demineralised freeze-dried bone allograft in human non-orthotopic sites: a pilot study. Journal of Periodontology. Aug 2001;72:1064.
5. Shi S, Mark BP, Gronthos S. Las células madre y la regeneración periodontal. Periodontology 2000. 2007;16:164-72.
6. Prósper F, Gavira J, Herreros J, Rábago G, Luquin R, Moreno J, et al. Trasplante celular y terapia regenerativa con células madre. An Sist Sanit Navar. 2006;29(Suppl 2).
7. Velilla LM, Molina ME, Miralles MA, García LJ, Reina PZ, Castellarnau CC. Células madre adultas (mesenquimales y nucleadas). Aplicación al campo de la regeneración ósea maxilar en implantología. Gaceta dental: Industria y profesiones. 2006;173:76-95.
8. Yamada Y, Ueda M, Hibi H, Baba S. Nueva técnica de regeneración de los tejidos periodontales con células madres mesenquimales y plasma rico en plaquetas mediante tecnología de ingeniería tisular. Caso clínico. Revista Internacional Odontología Restauradora & Periodoncia. 2006;10(4):371-7.
9. Declaración de Helsinki de la Asociación Médica Mundial. Principios éticos para las investigaciones médicas en seres humanos. [Citado 1 de agosto. 2008]. Disponible en: http://www.fisterra.com/mbe/investiga/declaracion_helsinki.asp#top
10. Shyu WC, Lin SZ, Lee CC, et al. Granulocyte colony-stimulating factor for acute ischemic stroke: a randomized controlled trial. CMAJ. 2006;174:927-33.
11. Körbling M, Estrov Z. Adult stem cells for tissue repair. A new therapeutic concept? N Engl J Med. 2003;349:570-82.
12. Daley GQ, Goodell MA, Snyder EY. Realistic prospects for stem cell therapeutics. Hematology. 2003;1:398-418.
13. Lagasse E, Connors H, Al-Dhalimy M. Purified hematopietic stem cells can differentiate into hepatocytes in vivo. Nat Med. 2000;6:1229-34.
14. Imai E, Ito T. Can bone marrow differentiate into renal cells? Pediatr Nephrol. 2002;17:790-4.
15. Hughes GC, Annex BH. Angiogenic therapy for coronary artery and peripheral arterial disease. Expert Rev Cardiovasc Ther. 2005;3:521-35.
16. Hernandez P, Cortina L, Artaza H, Pol N, Lam RM, Dorticós E, et al. Autologous bone-marrow mononuclear cell implantation in patients with severe lower limb ischaemia: A comparison of using blood cell separator and Ficoll density gradient centrifugation. Atherosclerosis. 2007;194:52-6.
17. Hernández P, Artaza H, Díaz AJ, Cortina LD, Lam RM, Pol N, et al. Autotrasplante de células madre adultas en miembros inferiores con isquemia crítica. Span J Surg Res. 2007;4:204-11.
18. Grant MB, May S, Caballero S, Brown GA, Guthrie SM, Mames RN, et al. Adult hematopoietic stem cells provide functional hemangioblast activity during retinal neovascularization. Nat Med. 2002;8:607-12.
19. Alvarez-Dolado M, Pardal R, García-Verdugo JM, Fike Jr, Lee Ho, Peffer K, et al. Fusion of bone-marrow-derived cells with Purkinje neurons, cardiomyocytes and hepatocytes. J Nature. 2003;425:968-73.
Recibido: 12 de junio de 2009.
Aprobado: 15 de septiembre de 2009.
Dra. Amparo Pérez Borrego. Facultad de Ciencias Médicas "Enrique Cabrera", Ciudad de La Habana, Cuba. E-mail: amparop.borrego@infomed.sld.cu