Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Estomatología
versión On-line ISSN 1561-297X
Rev Cubana Estomatol v.47 n.1 Ciudad de La Habana ene.-mar. 2010
ARTÍCULOS ORIGINALES
Características clínico-histopatológicas del carcinoma escamocelular bucal, Colombia
Clinical-histopathology features of oral squamous cell carcinoma in Medellin, Colombia
Efraín Álvarez MartínezI; Arelis Preciado UII; Santiago A. Montoya FernándezII; Raúl Jiménez GómezIII; Adriana Posada LópezIV
IEspecialista en Cirugía Bucal y Maxilofacial. Doctor en Odontología. Profesor Titular. Facultad de Odontología, Universidad de Antioquia, Colombia.
IIEspecialista en Cirugía Maxilofacial. Doctor en Odontología. Facultad de Odontología, Universidad de Antioquia, Colombia.
IIIEspecialista en Patología Oral. Doctor en Odontología. Profesor Titular. Facultad de Odontología Universidad de Antioquia.
IVDoctor en Odontología. Facultad de Odontología, Universidad de Antioquia, Colombia.
RESUMEN
El carcinoma escamocelular bucal (CEB), es una neoplasia maligna frecuente en cavidad oral. Objetivo: determinar la incidencia y el comportamiento clínico e histológico de este tipo de cáncer en Antioquia, Colombia. Métodos: éste estudio provee información acerca de las características clínicas e histopatológicas del CEB, proveniente de historias clínicas de 197 personas 112 (56,9 %) hombres y 85 (43,1 %) mujeres atendidas en el hospital Universitario San Vicente de Paúl de Medellín, durante un periodo de 14 años. Resultados: 197 historias fueron estudiadas, el 61,9 % (122) de la población, era mayor de 60 años al momento del diagnóstico, 78,7 % (157) fueron procedentes de Antioquia, el 78,6 % (155), tenían antecedente tabaquismo, el 17,8 % (35) de las personas, reportaron en la historia antecedentes familiares de cáncer. La localización más frecuente del CEB, fue la lengua 45 % (90), seguido de paladar duro 17,1 % (34), paladar blando 9 % (17) y piso de boca 8,5 % (17); la mayoría de estos (74,9 %), fueron diagnosticados en estadios tardíos (III y IV), en cuanto al grado de diferenciación predominaron los carcinomas bien y moderadamente diferenciado, 45,2 % (89) y 42,6 % (84) respectivamente.
Palabras clave: cáncer oral, cavidad oral, factores de riesgo.
ABSTRACT
Buccal squamous cell carcinoma (SCC) is frequent malign neoplasm in oral cavity; however, there isn't information on its incidence and clinical and histological behavior of this type of cancer in Antioquia (Colombia). Methods: Present study supply information on the clinical and histological features of SCC from medical records of 197 persons (56.9 %) (112 of male sex and 85 of female sex (43.1 %) seen in "San Vicente de Paúl" University Hospital of Medellin for 13 years. Results: A total of 197 medical records were studied, the 61.9 % (122) of population aged over 60 at diagnosis, 78.7 % (157) from Antioquia, and the 78.6 % (155) had smoking backgrounds, and the 17.8 % (35) of persons had a family history of cancer. More frequent location of SCC was in tongue for a 45 % (90), followed by hard palate for a 17.1 % (17) and mouth floor for a 8.5 % (17), most of them (7.9 %) were diagnosed with late stages (III and IV) regards the differentiation degree the carcinoma were well and moderately differentiated, 45.2 % (89) and 42.6 % (84), respectively.
Key words: Oral cancer, oral cavity, risk factors.
INTRODUCCIÓN
El cáncer bucal (CAB) es una neoplasia maligna de comportamiento agresivo, que comprende el 4 al 5 % de todos los tumores que afectan al ser humano y se ha convertido en un problema grave de salud a nivel mundial, debido al aumento de su incidencia en los últimos años y su alta tasa de mortalidad.1 La mayoría de los CAB, son del tipo carcinoma escamocelular bucal (CEB), lo que presenta el 91 % de todos los cánceres bucales. Otros autores reportan una incidencia de 93,8 % de todos los canceres orales.2 Afecta principalmente a personas de edad avanzada mayores de 40 años (edad promedio 65), con una mayor presentación en los hombres.3
El pronóstico del CEB es pobre, a pesar de los avances en las terapias quirúrgicas y no quirúrgicas, cerca del 50 % mueren dentro de un período de 5 años después de ser diagnosticado, lo cual empeora considerablemente el pronóstico y la supervivencia;4,5 de los pacientes, desafortunadamente el CEB, en la mayoría de los casos es detectado en estadios tardíos, donde ya ha invadido estructuras vecinas, comprometiendo el estado general de salud y ha hecho metástasis a distancia.4 Esta lesión puede ser detectada en muchas ocasiones en estadios tempranos, ya que suele originarse a partir de alteraciones en la mucosa, como leucoplasias, eritoplasias, o una combinación de ambas.6
Actualmente el CEB, se considera como una enfermedad con alto índice de mortalidad, y ocupa el sexto lugar entre las causas de muerte.3 En los últimos años se ha reportado que su incidencia, se incrementó especialmente en personas jóvenes y mujeres, debido a la exposición de estos a factores de riesgo como el tabaco y el alcohol,7 según datos epidemiológicos de países como Japón, EE. UU., Brasil y Tailandia.8,9
En Colombia el cáncer es la tercera causa de muerte y el CEB ocupa el quinto lugar entre todos los cánceres, con una relación hombre/mujer 2:1.10 Anualmente se presentan aproximadamente 2 000 nuevos casos de cáncer oral, en su mayoría diagnosticados en la población mayor de 60 años y raro en menores de 40 años,10 comúnmente se encuentra asociado a factores de riesgo como el tabaco.
Este estudio pretende proveer información acerca de las características demográficas, clínicas e histopatológicas del CEB, en pacientes atendidos en el Hospital Universitario San Vicente de Paúl, de la ciudad de Medellín, durante un periodo de 14 años, con el fin, de que sirva de patrón o referencia para diseñar programas de promoción y prevención en Colombia.
MATERIALES Y MÉTODOS
Se revisaron las historias clínicas de 355 personas con diagnóstico de CEB que consultaron en el Hospital Universitario San Vicente de Paúl (HUSVP), entre enero 1 de 1990 y el 31 de diciembre de 2004. Estas historias fueron suministradas por el departamento de estadística del Hospital Universitario San Vicente de Paúl, con sus respectivas biopsias, facilitadas por el Departamento de Patología de la y del Laboratorio de Inmunodetección y Bioanálisis de la Facultad de Odontología de la Universidad de Antioquia. Para la recolección de la información se diseño un instrumento que registraba los datos de interés en nuestro estudio. Las historias clínicas incompletas y sin biopsia fueron excluidas del estudio. Se obtuvo un total de 197 de historias de pacientes que cumplían con los criterios de inclusión.
En cuanto a los datos demográficos de las personas, se registraron la edad al momento del diagnóstico, el sexo, la procedencia (zona rural o urbana), la ocupación (en relación o no con exposición solar), el tiempo de evolución de la lesión, hábitos relacionados y antecedentes familiares de cáncer. En relación a las características clínicas de los tumores se tuvo en cuenta la localización, los signos y síntomas principales, la clasificación TNM y el estadio tumoral. Entre las características histológicas evaluadas en el estudio, se incluyeron, la diferenciación tumoral, el tipo histológico, la presencia o no de Candida albicans en las muestras debido a la presencia de polimorfonucleares, la displasia epitelial en los márgenes de resección, la presencia de coilocitos y las características de carcinoma multicéntrico.
ANÁLISIS DE LA INFORMACIÓN
Se utilizó el programa Epi-info 6.04 d para la tabulación de la información y para el análisis de la información. Para el análisis de las variables clínicas y demográficas se realizó un análisis univariado, por tablas de frecuencias para las variables cualitativas y estadísticas descriptivas para las variables cuantitativas. Con el fin de determinar la relación entre algunas de las variables demográficas, clínicas e histológicas, se utilizó la prueba Chi cuadrado de independencia. Se utilizó un nivel de significación estadística del 5 %. La información tanto de las historias clínicas como de las biopsias fueron tabuladas por los residentes a cargo de la investigación, y las biopsias fueron leídas por el patólogo oral, quien desconocía el diagnóstico previo.
RESULTADOS
De las 355 historias clínicas revisadas, 197 (55,5 %) cumplieron con los criterios de inclusión, de estas, 112 (56,9 %) correspondieron a personas de sexo masculino y 85 (43,1 %) al sexo femenino; en su mayoría fueron remitidos al HUSVP por médico general, 99 (50,3 %); 62 (31,5 %) fueron remitidos por el odontólogo; 30 (15,2 %) no fueron remitidos o no se reportó esta información. La mayoría de las personas del estudio, 122 (61,9 %) fueron mayores de 60 años. Sólo 3 (1,5 %) fueron menores de 30 años (tabla 1). La edad promedio fue de 62,7 años. Eran procedentes de Antioquia, 157 (79,7 %), de Chocó, 21 (10,7 %), de Córdoba, 10 (5,1 %) y de otros departamentos de Colombia, 9 (4,6 %). La mayoría, 151 (76,7 %) eran de zonas urbanas, y de zonas rurales, 46 (23,4 %).
Eran consumidores de tabaco, 155 (78,7 %) (tabla 1), de estos, 58 (37,4 %) lo combinaban con el alcohol. El hábito de fumar invertido estuvo presente en 23 (11,7 %) de la muestra, de estos, 2 lo combinaban con el alcohol simultáneamente. Se encontró una diferencia estadísticamente significativa en el hábito de tabaco, mayor en las mujeres, 57 (67,05 %) (p= 0,000013). El alcohol como hábito aislado fue poco frecuente en este estudio 2,5 %, mientras que la combinación de ambos hábitos, presentó un predominio mayor en los hombres, 53 (47,32 %), lo que fue estadísticamente significativo (p< 0,000001), (tablas 2 y 3).
El hábito de fumar de manera habitual predominó en 88 de los hombres (78,57 %) y en 44 de las mujeres (51,76 %) (p= 0,000074); sin embargo el hábito de fumar invertido se presentó en 23 (11,7 %), con una mayor incidencia en las mujeres, 18 (31 %) y en los hombres, 5 (4,41 %) con p= 0,000297 (tabla 2), en su mayoría provenientes de la región del Choco, seguido de Antioquia. En los hombres, 33 (16,8 %) y en las mujeres, 36 (18,4 %) se reportaron algún antecedente familiar de cáncer.
El tiempo de evolución de la lesión se encontró dentro de un rango desde 1 mes hasta 36 meses. Del total de los individuos, 64 (32,5 %), se reportó un periodo de evolución de la lesión de 1 a 3 meses; en 61 (31 %), se refirió un tiempo de 3 a 6 meses, en 47 (24,3 %) se reportó de 6 a 12 meses, y en 24 (12,2 %), de más de 12 meses.
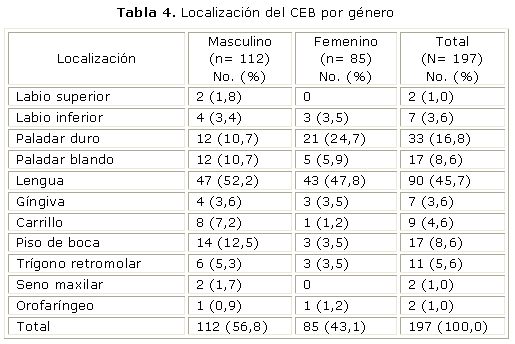
La localización primaria del CEB más reportada en el estudio, fue la lengua, 90 (45,7 %), seguido de paladar duro, 33 (16,8 %), paladar blando, 17 (8,6 %) y piso de boca, 17 (8,6 %). El carcinoma de lengua se presentó en 47 de los hombres (52,2 %) y en 43 de las mujeres (47,8 %), sin diferencias estadísticamente significativa (p= 0,6215), tabla 3. Para el piso de boca fueron más afectados los hombres, 14 (12,5 %) que las mujeres, 3 (3,5 %), con diferencia significativa de p= 0,026 (tabla 4).
El principal signo clínico fue la úlcera, presente en 91 de las personas (46,2 %), en 54 de los hombres (48,2 %) y en 37 de las mujeres (43,5 %). En segundo lugar la lesión blanca, 46 (23,4 %), presente en 24 de los hombres (21,42 %) y en 22 de las mujeres (25,9 %); en tercer lugar se encontró la lesión roja y la lesión mixta, 22 (11,2 %). El principal síntoma fue el dolor, 157 (79,7 %), 91 hombres (81,3 %) y 66 de las mujeres (77,6 %); además se encontró el ardor, 12 (6,1 %) y la presencia de masa en 11 (5,6 %).
Según la clasificación TNM, 119 fueron T4 (60,09 %); 36 fueron T3 (18,78 %); con respecto a la presencia de nódulos cervicales, 79 fueron N cero (40,6 %); 53 fueron N1 (26,9 %). En cuanto a la presencia de metástasis, 46 fueron Mx (23,85 %), mientras que 144 fueron M cero (73,6 %). La localización del tumor más asociada con la presencia de nódulos cervicales fue la lengua con 27 individuos N1, 24 fueron N2 y 4 fueron N3. En segundo lugar estuvo el paladar duro con 7 pacientes N1, otros 9 clasificados como N2 y ningún N3; y en el piso de boca con 4 pacientes N1, 5 N2 y otros 5 N3. La presencia de metástasis fue encontrada en 7 personas.
La localización más frecuente del tumor con relación al hábito de fumar únicamente fue la lengua, seguido de paladar duro, paladar blando, piso de boca. Con relación al hábito de fumar invertido, el sitio más frecuentemente afectado fue el paladar duro, seguido de la lengua y el piso de boca, como se observa en la tabla 4. En los pacientes con ambos hábitos (tabaco y alcohol) la distribución de la localización fue lengua 44,8 %, seguido de piso de boca y paladar blando (tabla 4).
El estadiamiento de los tumores indicó que la mayoría fueron diagnosticados en estadios tardíos. En el estadio IV se diagnosticaron 137 pacientes para el 69,5 %, y en el estadio III 36 individuos, en el 18,3 %. En cuanto a la distribución por sexos, se encontró que en las mujeres predominaron los estadios tempranos (I y II). Por el contrario, los hombres predominaron para los estadios tardíos (III y IV). En los pacientes con tumores en estadios avanzados (estadios III y IV) se encontró gran correlación con el hábito de fumar (tabla 5).
El grado de diferenciación encontrado fue como sigue: bien diferenciados el 45,2 % en 89 lesiones, fueron moderadamente diferenciados el 42,6 % mientras que el 12,2 % resultó mal diferenciados. En las mujeres predominó el carcinoma bien diferenciado en el 50,6 %, mientras que en los hombres predominó el moderadamente diferenciado 47,3 % (tabla 6).
Histológicamente el tipo el carcinoma escamoso no presentó diferencias significativas entre sexos. La presentación de escamocelular basaloide se encontró en el 3,6 % de las muestras, principalmente en personas mayores de 60 años, con una presentación ligeramente más alta en hombres, de estos se encontró que 4 (67,2 %) estaban asociados al tabaco; los otros 3 carcinomas basaloides (42,9 %), no estaban asociados a ningún hábito. Además se encontraron tres carcinomas linfoepiteliales, un acantolítico y un papilomatoso. Los carcinomas linfoepiteliales se observaron en dos biopsias proveniente de la lengua y uno de trígono retromolar, el carcinoma acantolítico se encontraba en paladar blando y el papilomatoso en lengua.
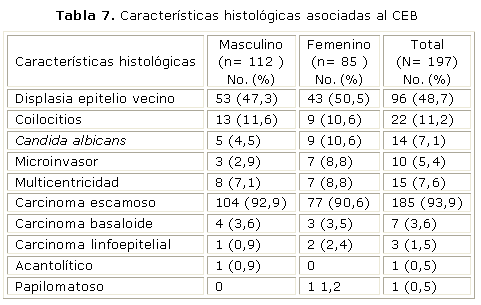
La presencia de coilocitos, sugerentes de la presencia del virus del papiloma humano (PVH) se observó en el 11,16 % de las biopsias, ligeramente mayor en los hombres, con una diferencia levemente significativa con p= 0,013. La displasia en el epitelio vecino al tumor o en los márgenes de resección, fue observada en el 51,9 % de las muestras, y el patrón de carcinoma multicéntrico fue observado en el 7,6 % de las muestras. Se encontró que el 5,5 % presentó características de microinvasor, ver tabla 7.
La histología demostró que el 43,3 % de los carcinomas de lengua fueron bien diferenciados, mientras que el 40 % fue moderadamente diferenciado y el 16,7 % resultó mal diferenciado; en su mayoría se diagnosticaron tardíamente, en estadio III el 21,1 % y en estadio IV el 62,2 %. De estos, el 94,4 % era del tipo escamocelular, el 2,2 % fue de tipo basaloide, el 2,2 % fue de tipo linfoepitelial y el 1,1 % de tipo papilomatoso. La displasia en el epitelio vecino se encontró en el 59,3 %. En 9 pacientes, el 10 % de los carcinomas de lengua se encontraron características de multicentricidad y el 3,5 % fue de tipo microinvasor. En el 13,3 % de las muestras se observó la presencia de coilocitos y en el 7,1 % la presencia de Candida Albicans en el epitelio, (tabla 7).
En cuanto al CEB de lengua, la relación hombre-mujer fue 1,09:1, principalmente en personas mayores de 60 años. Respecto al tiempo de evolución el 31,1 % tuvo un periodo de evolución menor de tres meses, el 27,8 % de 3 a 6 meses, el 30 % de 6 a 12 meses y en el 11,1 % fue mayor a 12 meses. Al analizar la manera de presentación, el 42,2 % se inició en forma de úlcera, el 24,4 % en forma de placa blanca (leucoplasia), el 13,3 % en forma de lesión mixta (lesión blanca y roja), mientras que el 10 % debutó como lesión eritroplásica y un el 3,3 % tuvo antecedente de liquen plano bucal, histológicamente verificado.
El principal síntoma o signo fue el dolor 75,6 %, seguido de sensación de ardor 7,8 %, la aparición de una masa tumoral como signo de alarma ocurrió en el 5,6 % y el 2,2 % presentó pérdida de la motilidad lingual. En 42 pacientes (47 %) se encontró relación con el tabaquismo y en 24 individuos (27,4 %) con la combinación alcoholismo-tabaquismo. El 83,3 % de los CEB de lengua, 75 pacientes, se diagnosticó en estadios avanzados (III y IV), y solo el 12,2 % se interceptó en estadio II y ninguno en estadio I.
DISCUSIÓN
El carcinoma escamocelular bucal, actualmente es considerado una enfermedad de alta incidencia y con una alta mortalidad a nivel mundial, 1,2 millones de casos al año.11 El CAB bucal y orofaríngeo es considerada la sexta causa de muerte12 y principalmente afecta a personas de edad avanzada, más del 50 % de los cánceres bucales en EE. UU., se presentan en personas de 65 años.13,14 Perussi y Col.15 encontraron en pacientes de avanzada edad, una incidencia de cáncer bucal entre el 38,2 % a 39,5 %, siendo mayor en hombres que en mujeres. El 96 % son de tipo escamocelular, el cual se desarrolla del epitelio estratificado de la cavidad bucal. En nuestro estudio la presencia de carcinoma de tipo escamocelular se encontró en el 98 % de las muestras.
En la década de 1950, la literatura reportaba una mayor incidencia en hombres, con una relación hombre-mujer de 6:1, recientes estudios reportan una mayor incidencia del CEB en las mujeres y un aumento de la incidencia en la población joven (menor de 40 años), debido a la exposición de estos, a factores de riesgo como el tabaco y el alcohol, en especial a edades tempranas,7,16 hoy en día dicha relación hombre-mujer, se acerca a 2:1.17 Lamaroon y Cols.9 en Tailandia, reportaron que el 12,8 % de los pacientes con CEB eran menores de 40 años. En nuestro estudio el 61,9 % fueron diagnosticados en personas mayores de 60 años; y la presencia de CEB en la población menor de 40 años se presentó en el 6,1 % de la muestra.
Quintero,18 en su estudio en la costa atlántica de Colombia, encontró una incidencia mayor en el sexo femenino (55 %), con una alta relación a dicho hábito. A diferencia encontramos una mayor incidencia en los hombres (56,9 %), con una relación hombre: mujer de 1,3:1. Correnti y Cols.,19 analizaron 18 casos de CAB, en Venezuela y encontraron que el CEB se presentó en personas entre 41-86 años, sin diferencia significativa entre sexos con una localización más frecuente en reborde alveolar y borde lateral de lengua. La relación del hábito de fumar, con el desarrollo del CEB, se reporta por numerosos autores20,21 al tabaco se le atribuye más del 90 % de los carcinomas de orofarínge.22 En un estudio de las universidades de California y San Francisco encontraron antecedentes de tabaquismo en el 72 % de los pacientes. En la India y en Tailandia, donde el hábito de fumar el opio y la nuez de Betel, es muy alta la incidencia de CEB, de 20 a 36,3 por cada 100 000 habitantes y afecta entre el 8 al 35 % de la población y ocupa el primer lugar de prevalencia en los hombres y el tercero en las mujeres.23,24 De Stefani y Cols.2 en 1998 encontraron que la localización más frecuente del CEB fue la orofaringe (26,1 %), seguido de hipofaringe (22,8 %), lengua (20,9 %), piso de boca y paladar, con gran correlación con el hábito de tabaco.
En Corea,25 evaluaron los factores sociodemográficos, clínicos e histológicos de 861 pacientes con CEB, donde el 74,9 % fueron pacientes de sexo masculino, el 29,7 % residían en zonas rurales y el 68,9 % en zonas urbanas. El sitio más frecuente fue la lengua 19,6 %, seguido de suelo de boca 12,7 % y paladar 11,7 %. El 41,6 % tenían antecedentes de tabaquismo y el 31,6 % habituaban consumir alcohol frecuentemente. En nuestra investigación encontramos que el 67 % de los pacientes eran consumidores de tabaco, de estos el 42,4 % lo combinaban con alcohol y el 57,6 % no lo combinaban. El 80 % de los tumores de la lengua tuvieron asociación con el tabaco, al igual que el 75,8 % de los tumores de paladar duro, el 94,1 % de paladar blando y el 76,5 % de suelo de boca.
El consumo del alcohol también se incluyó como un factor de riesgo para el desarrollo del CEB bucal,26 en especial en aquellos quienes combinan ambos hábitos27,28 los sitios anatómicos más comúnmente comprometidos son el piso de boca, el trígono retromolar, la lengua y la encía.29
Al igual que en algunos países de Asia, como Tailandia,30 India31 y del Caribe32,33 donde se continúa el hábito de fumar tabaco de manera invertida, por razones socioculturales; se ha encontrado un mayor riesgo de desarrollar el CEB, debido al contacto más directo de la mucosa oral, a estos agentes carcinógenos durante la combustión. Este estudio encontró una alta incidencia de la asociación del CEB al hábito de fumar invertido, principalmente en mujeres 31,03 % y 4,46 % en los hombres.
En general la localización más frecuente del CEB es la lengua, tanto en países desarrollados, como en vía de desarrollo, cerca del 30 % de los cánceres bucales diagnosticados en EE. UU. entre 1985 y 1966 se presentaron en lengua, seguido del labio y el piso de la boca. Gorzki y Cols.,34 reportó una incidencia en lengua entre el 25 y el 40 %. En la India, se presenta el mayor índice de CEB de lengua a nivel mundial, 9,4:100 000, comparado con el Reino Unido 1,1/100 000;35 desafortunadamente en las últimas tres décadas se observó un incremento de su incidencia en EE. UU. y en el Reino Unido.36,37 A su vez este sitio es también, el más frecuentemente asociado al hábito del tabaco, aumentando el riesgo hasta 10 veces.38 Perussi y Cols.,15 encontró mayor predomineo en la mucosa bucal, especialmente en el suelo de boca y lengua. Álvarez y Cols,39 encontraron una localización más frecuente en lengua, seguida de suelo de boca, paladar y reborde alveolar. Quintero18 encontró que la localización más frecuente fue el paladar 35,4 %, seguido de la lengua 16,2 %. En nuestros resultados, el 80 % de los CEB de lengua presentaron relación con el tabaco.
Sobre algunos estudios acerca del pronóstico y la sobrevida del CEB, los carcinomas en lengua, presentan altas tasas de mortalidad y de producir metástasis. Cerca de 20 a 30 % de los carcinomas de lengua y suelo de boca en estadios I y II, sin nódulos clínicamente palpables, desarrollan metástasis ocultas a nódulos linfáticos cervicales en un periodo de dos años.39,40 Otros autores sugieren que el grosor del tumor, es ayuda para establecer un pronóstico más acertado, los tumores con un grosor menor a 3 mm, tienen una sobrevida a 5 años de 85,7 %, mientras que en tumores con un grosor de 4 a 7 mm esta sobrevida es del 58,3 %.41 en 1999 reportó la presencia de metástasis regional cervical en el 40 % de las personas con diagnostico CEB y micrometástasis (nódulos no mayores de 3 mm) en el 8 %, principalmente en borde lateral de lengua, vientre y suelo de boca. En Brasil, encontraron que los CEB de lengua y suelo de boca, con infiltración muscular, tienen mayor riesgo de desarrollar metástasis regional y a distancia (28,4 % y 7,1 % respectivamente) con una sobrevida libre de enfermedad a 5 años del 68,5 % con mejor pronóstico para el sexo masculino.42 Franco y Cols.,43 reportó también mejor tasa de sobrevida en los pacientes femeninos con cáncer bucal (un 29 % menos riesgo de muerte y un 17 % menor riesgo de recidiva).
Lam Lisetta y Cols.,44 en Australia, analizaron 212 casos en lengua, encontraron una relación hombre-mujer fue 2,1:1. El 15 % se presentó en personas menores de 45 años, y un 60 % en personas de 45 a 69 años. La mayoría se encontró en estadios clínicos avanzados, III (15,5 %) y IV (31,4 %); e histológicamente moderadamente diferenciados 51,5 %. En nuestro estudio el CEB de lengua tuvo una presentación muy similar entre hombre y mujer, relación 1,09:1 con una presentación en mayores de 60 años 61,1 %; el 7,8 % se presentó en menores de 45 años.
Se encontró un patrón escamocelular basaloide, en el 3,6 % de las muestras; una variante poco común del carcinoma escamocelular, que afecta principalmente a adultos hombres mayores de 60 años y que presenta un comportamiento invasivo,45 metastatizante y de mal pronóstico,46 mortalidad por la enfermedad a los 18 meses aproximadamente. En cavidad bucal tiene alta predilección por la base de la lengua.47 En este estudio resultó principalmente afectados, la lengua, los paladares duro y blando; todos con antecedentes de tabaquismo.
La multicentricidad o cancerización se reportada por algunos autores48 como la presencia de múltiples focos tumorales primarios, que pueden estar presente en el 24 % de los CAB. En nuestro estudio la presencia de mulicentricidad se observó en el 7,6 % de las muestras principalmente en lengua.
CONCLUSIONES
La localización más frecuente del CEB, en nuestro estudio fue la lengua, y afectó principalmente la población adulta, con gran asociación con el tabaco y su combinación con el alcohol.
Al revisar la literatura mundial pudimos comprender que este tumor tiene la tendencia a invadir y ocasionar micrometástasis, no clínicamente palpables y en estadios tempranos principalmente en lengua y piso de boca, que podrían explicar, el por qué de la recidiva tumoral, aún en estadios tumorales tempranos, lo que nos alerta, para desarrollar programas preventivos y ayudar a la estructuración de estos programas, para educar a la población, con énfasis en los jóvenes, quienes se inician tempranamente en el consumo del tabaco y del alcohol, y posteriormente podrían desarrollar esta patología.
Se sugiere para futuros estudios realizar un seguimiento en la sobrevida de estos pacientes, y su relación con la localización, estadio tumoral, asociación con hábitos, tipo de tratamiento realizado y a los hallazgos histopatológicos, con el fin de establecer estadísticas y factores pronósticos en nuestra población.
Es necesario diseñar programas de detección temprana del CEB y educar a la población acerca del mayor riesgo de desarrollar CEB cuando existe tabaquismo y alcoholismo; asi como concientizar y capacitar a los profesionales de la salud, quienes tienen la posibilidad de detectar más tempranamente los cambios en la mucosa de la cavidad bucal, ya que se conoce que uno de los factores más importantes en relación al pobre pronóstico del CEB, es el diagnóstico tardío por las metástasis regionales y a distancia, características de ésta neoplasia.
AGRADECIMIENTOS
Al Departamento de Estadística del Hospital Universitario San Vicente de Paúl de Medellín. Al Instituto de Patología de la Universidad de Antioquia. Hospital Universitario San Vicente de Paúl de Medellín. Al Dr. David Suescún, MD. Patólogo. Laboratorio de Patología, Hospital Universitario de San Vicente de Paúl, Medellín, Colombia. A las doctoras Irma López y Arelis Preciado Uribe, de la Facultad de Odontología, Universidad de Antioquia, por su apoyo en la recolección de los datos.
REFERENCIAS BIBLIOGRÁFICAS
1. Cotran RS, Kumar V, Collins T. Neoplasia. En: Robbin's Pathologic basis of disease. 6th Ed. Pensilvania: Mosby; 1999:260-325.
2. De Stefani B P, Oreggia MM, Deneo-Pellegrini H. Smoking patterns and cancer of the oral cavity and pharinx: A case control study in Uruguay. Oral Oncol. 1998;34(5):340-6.
3. Silvermann S. Epidemiology. En Oral Cancer. Atlas of clinical oncology. American cancer society. Fifth Edition. London: BC Decker-Hamilton; 2003:1-6.
4. Onizawa K, Nishihara K, Yamagata K, Yusa H, Yanagawa T, Yoshida H. Factors associated with diagnostic delay of oral squamous cell carcinoma. Oral Oncol. 2003;39(8):781-8.
5. Ragezi JA. Factores etiológicos. En Patología bucal. México DF: Mc Graw Hill Interamericana; 2000:71-83.
6. Patton LL. The effectiveness of community based visual screening and utility of adjunctive diagnostic aids in the early detection of oral cancer. Oral Oncol. 2003;39(7):708-23.
7. Llewelyn CD, Linklater K, Bell J, Johnson NW, Warnakulasuriya S. An analysis of risk factors for oral cancer in young people: a case-control study. Oral Oncol. 2004;40:304-13.
8. Franceshi S, BidoliE, HerreroR, Muñoz N. Comparison of cancer of oral cavity and pharinx worldwide: Etiological clues. Oral Oncol. 2000;36(1):106-15.
9. Lamaroon A, Pattanaporn K, Pongsiriwet S, Wanachantararak S, Propayasatok S, Jittidecharacs I, et al. Analysis of 587 cases of oral squamous cell carcinoma in northern Thailand with focus on young people. Int J Oral Maxillofac Surg. 2004;33(1):84-8.
10. Colectivo de autores. III. Estudio Nacional de Salud Bucal-ENSAB III-II Estudio Nacional de Factores de Riesgo de Enfermedades Crónicas. ENFREC II Tomo II. Tabaquismo. Bogotá: Ed. Ministerio de Salud. República de Colombia. 1999.
11. Mahbouibi E. The epidemiology of oral cavity, pharyngeal and esophageal cancer outside of north America and western Europe. Cancer. 1977;40:1879-86.
12. Pisani P, Parkin DM, Bray F, Ferlay J. Estimates of the worldwide mortality from 25 cancers in 1990. Int J Cancer. 1999;83,18:870-3.
13. Edwards BK, Howe HL, Ries LA. Annual report to the nation on the status of cancer 1973-1999, featuring implications of age and aging on U.S. cancer burden. Cancer. 2002;94:2766-92.
14. Silverman SJ, Gorsky M. Epidemiologic and demographic update in oral cancer: California and National data. 1973-85. J Am Dent Assoc. 1990;120:495-9.
15. Perussi MR, Denardin OV, Fava AS, Rapoport A. Squamous cell carcinoma of the mouth in the elderly in Sao Paulo. Rev Assoc Med Bras. 2002;48,4:341-4.
16. Effiom OA, Adeyemo WL, Omitola OG, Ajayi OF, Emmanuel MM; Gbotolorum OM. Oral squamous cell carcinoma: a clinicopathologic review of 233 cases in Lagos, Nigeria. J Oral Maxillofac Surg. 2008;66(8):1595-9.
17. Macfarlane GJ, Evstifeeva TV, Robertson C, Boyle P, Scully C. Trends of oral cancer mortality among females worldwide. Cancer Causes Control. 1994;5:225-8.
18. Quintero J. Registro de carcinoma escamocelular en los departamentos de Córdoba y Sucre. Rev Odont Univ Cartagena. 1985;3:15-7.
19. Correnti M, Rivera H, Cavazza ME. Detection of human papillomavirus of high oncogenic potencial in oral squamous cell carcinoma in a Venezuelan population. Oral Dis. 2004;10(3):163-6.
20. Wynder EL, Mushinki MH, Spivak. JC. Tobacco and alcohol consumption in relation to the development of multiple primary cancers. Cancer. 1977;40:872-8.
21. Silverman SJ, Gorsky M, Greenspan D. Tobacco usage in patients with head and neck carcinomas: a follow-up study on habit changes and second primary oral/oropharyngeal cancers. J Am Dent Assoc. 1983;106:33-5.
22. Silverman SJ, Miller CS, Thompson JS. Etiology and predisposing factors. En: Silverman SJ. Oral Cancer. Atlas of clinical oncology. London: BC Decker-Hamilton. 2003:7-28.
23. Reichart PA. Oral cancer and precancer related to betel and miang chewing in Thailand. A review. J Oral Pathol Med. 1995;24:241-3.
24. Pandey M, Thomas G, Somanathan T, Sankaranarayanan R, Abraham EK, Jacob BJ. Evaluation of surgical excision of non-homogeneous oral leucoplakia in a screenning intervention trial, Kerala India. Oral Oncol. 2001;37:103-9.
25. Choi KK, Kim MJ, Lee JH, Moon HS, Lee TR, Mioung H. Independent prognostic factors of 861 cases of oral squamous cell carcinoma in Korean adults. Oral Oncol. 2006;42(2):208-17.
26. Mashberg A, Garfinke L, Harris S. Alcohol as a primary risk factor in oral squamous cell carcinoma. Cancer J Clin. 1981;31:146-55.
27. Muwonge R, Ramadas K, Sankila R, Thara S, Thomas G, Vinoda J. Role of tobacco smoking, chewing and alcohol drinking in the risk of oral cancer in Trivandrum India: a nested case-control design using incident cancer cases. Oral Oncol. 2008;44(5):446-54.
28. Zavras AI, Douglass CW, Joshipura K, Wu T, Laskaris G, Petridou E, et al. Smoking and alcohol in the etiology of oral cancer: gender-specific risk profiles in the south of Greece. Oral Oncol. 2001;37(1):28-35.
29. Blott WJ, McLaughlin JK, Winn DM, et al. smoking and alcohol drinking in relation to oral and pharyngeal cancer. Cancer Res. 1988;48:3282-7.
30. Ortiz GM, Pierce AM, Wilson DF. Palatal changes associated with reverse smoking in Philiphinian woman. Oral Dis. 1996;2(3):232-7.
31. Warnakulasuriya S, Sutherland G, Scully C. Tobacco, oral cancer, and treatment of dependence. Oral Oncol. 2005;41(3):244-60.
32. Quigley LF, Shklar G, Cobb CM. Reverse cigarette smoking in Caribbeans: Clinical, Histologic and cytologic observations. J American Dent Assoc. 1966;72:867-73.
33. Álvarez G, Álvarez E, Jímenez R, Gaviria A, Mosquera Y, Gaviria AM. Reverse smoker's and changes in oral mucosa. Department of Sucre, Colombia. Med Oral Patol Oral Cir Bucal. 2008;1(13):1-8.
34. Gorsky M, Epstein JB, Oakley C, Le ND, Hay J, Moore PS. Carcinoma of the tongue: A series analysis of clinical presentation, risk factor, staging and outcome. Oral Surg Oral Med Oral Pathol Oral Radiol and Endodont. 2003;98(5):546-52.
35. Muir C, Waterhouse J, Mack T. Cancer incidence in five continents. International agency for research on cancer. Lyon: IARC Scientific Publication; 1987.
36. Hindle I, Nally F. Oral Cancer: a comparative study between 1962-67 and 1980-84 in England and Wales. Br Dent J. 1991;170(1):15-20.
37. Chen J, Eisenberg E, Krutchkoff DJ, Kats RV. Changing trends in Oral cancer in the United States. J Oral Maxillofac Surg. 1991;49:1152-8.
38. Franceschi S, Barra S, La Vecchia C. Risk factor for cancer of the tongue and the mouth. Cancer. 1992;70:2227-32.
39. Pimienta TM, da Silva AR, Lopes A, Lopes CA y Kowalski LP. Predictive factors of occult metastasis and prognosis of clinical stages I and II squamous cell carcinoma of the tongue and floor of the mouth. Oral Oncol. 2004;40(8):780-6.
40. Gonzales MA, Esteban F, Archilla AR, Ávila IR, González MS. Importance of tumor thickness measurement in prognosis of tongue cancer. Oral Oncol. 2002;38(4):394-7.
41. Leite ICG, Koifman S. Survival analysis in a sample of oral cancer patients at a reference hospital in Rio de Janeiro, Brazil. Oral Oncol. 2003;39(4):386-90.
42. Franco EL, Dib LL, Pinto DS, Lombardo V, Constesini H. Race and gender influences on the survival of patients with mouth cancer. J Clin Epidemiol. 1993;28(1):37-46.
43. Lam L, Logan RM, Luke C, Rees GL. Retrospective study of survival and treatment pattern in a cohort of patients with oral and pharyngeal tongue cancers. Oral Oncol. 2007;43(2):150-68.
44. Aiko A. Okimura K, Ohuchi T, Konishi T, Kanazawa M. Basaloid squamous cell carcinoma of the Floor of the mounth: characterization of a cell line. J Oral Pathol Med. 1997;26(8):367-70.
45. Coletta R, Cotrim P, Vargas PA, Villalba H, Pires FR, de Moraes M. Basaloid squamous carcinoma of the oral cavity: Report of 2 cases and study of AgNOR, PCNA, P53, and MMP expression. Oral Surg Oral Med Oral Pathol Oral Radiol & Endod. 2001;91(5):563-9.
46. Wein SL, Kier R, Vollmer RT. Basaloid squamous carcinoma of the Tongue Hypopharynx and larynx a report of the cases. Hum Pathol. 1986;17:1158-66.
Recibido: 16 de octubre de 2009.
Aprobado: 13 de noviembre de 2009.
Dr. Efraín Álvarez Martínez. Facultad de Odontología, Universidad de Antioquia, Colombia. Email: efralmar@hotmail.com