Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Estomatología
versión On-line ISSN 1561-297X
Rev Cubana Estomatol v.47 n.2 Ciudad de La Habana abr.-jun. 2010
ARTÍCULOS ORIGINALES
Evaluación de la respuesta hística del beta fosfato tricálcico (Biograft-G) como implante óseo
Histological evaluation of tricalcium beta phosphate (Biograft-G) as bone implant
Rafael Delgado FernándezI; Joaquín Urbizo VélezII; Víctor Rodríguez SosaIII; Enrique Iglesias RodríguezIV
I Especialista de II Grado en Anatomía Patológica. Profesor Auxiliar. Facultad de Estomatología, Universidad de Ciencias Médicas de La Habana, Cuba.
II Especialista de II Grado en Anatomía Patológica. Profesor Titular. Facultad de Estomatología, Universidad de Ciencias Médicas de La Habana, Cuba.
III Médico Veterinario. Centro de Cirugía Experimental. Instituto de Ciencias Básicas y Preclínicas "Victoria de Girón". Universidad de Ciencias Médicas de La Habana, Cuba.
IV Técnico Auxiliar de la Docencia en Anatomía Patológica.
RESUMEN
Con el objetivo de determinar la histocompatibilidad y las propiedades de osteoconducción y biodegradación del Biograft-G (beta fosfato tricálcico sintético) obtenido por el Centro de Biomateriales de la Universidad de La Habana, se usaron para esta experiencia, 10 perros Beagle, a los cuales se les realizaron implantes de Biograft-G en fémur y mandíbula, con sus correspondientes controles. Estos animales fueron sacrificados en los siguientes periodos: a los tres y seis meses; y al año y dos años de implantados. Se obtuvo muestras de tejido en bloque del hueso implantado las cuales se fijaron en formol neutro y posteriormente procesadas, previa descalcificación, por el método de inclusión en parafina y coloreadas con Hematoxilina y Eosina. El estudio se realizó con microscopio óptico. Los resultados permitieron determinar que el Biograft-G resultó ser un material histocompatible, osteoconductor y biodegradable.
Palabras clave: beta fosfato tricálcico, implante.
ABSTRACT
With the aim to determine the histocompatibility, osteoconduction properties and biodegradation of synthetic tricalcium beta phosphate (Biograft-G) obtained in the Biomaterials Centre of Havana University we developed an experimental study using 10 Beagle dogs in which were placed Biograft-G implants in femur and jaw bones with their corresponding controls. The animals were sacrificed in three different periods: 3, 6 months, one and two years time of implantation. Block bone samples were obtained, fixed in 10 % neutral formalin, decalcified and processed with the paraffin inclusion method and stained with Haematoxylin and Eosin. The study was carried out with optical microscope. We conclude that, according to the results obtained, Biograft-G is a histocompatible, osteoconductor and biodegradable material.
Key words: Tricalcium beta phosphate, implant.
INTRODUCCIÓN
Las cerámicas de fosfato de calcio (FTC) han sido utilizadas como materiales de implantes en tejido óseo desde hace varias décadas. De estos materiales, además de la hidroxiapatita, uno de los más estudiados es el beta fosfato tricálcico (beta-FTC).1-4 Entre otras características, el beta-FTC tiene la propiedad de ser biodegradable,5,6 cualidad ésta que lo convierte en un material muy útil para los implantes temporales. El empleo del beta-FTC como material de relleno de defectos y cavidades óseas, se ha extendido en diferentes especialidades como: Estomatología, Cirugía Maxilofacial, Ortopedia y Oncología.7-10
El Centro de Biomateriales de la Universidad de la Habana acometió la tarea de desarrollar biomateriales cerámicos basados en beta-FTC, obtenidos por métodos de síntesis química por vía húmeda y ceramización. Uno de los materiales desarrollados en esta línea es el Biograft-G (granulado denso de beta-FTC), diseñado para el relleno de defectos óseos. Aunque estudios "in vitro" han demostrado que, el Biograft-G no provoca reacción tóxica en los niveles celular y sanguíneo, surge la interrogante de cuál sería la reacción del tejido óseo al ser implantado con Biograft-G y su interacción con el mismo.
El presente estudio tiene el propósito de determinar la respuesta hística del Biograft-G, respecto a la osteoconducción, biocompatibilidad, bioestabilidad, así como su toxicidad in vivo, en diferentes periodos de tiempo, mediante su implantación en hueso, en animales de experimentación.
MÉTODO
Se emplearon 10 perros Beagle machos sanos, con una masa corporal entre 10 y 12 kg. Todos los animales, fueron controlados por un médico veterinario. La cantidad total de animales implantados fue de 10, distribuidos por periodos de implantación de acuerdo con lo que se refleja en la tabla 1.
La colocación del material de prueba se realizó en tres sesiones quirúrgicas. Estas fueron las siguientes: para ser evaluados a las 104 semanas se intervinieron quirúrgicamente para implantar 4 animales; para las 52 y 26 semanas a 4 animales; y para ser evaluados a las 12 semanas a 2 animales. Cada animal se implantó en fémur y en mandíbula; un sitio por cada fémur y uno por cada hemimandíbula, para un total de dos sitios en fémur y dos en mandíbula por animal.
Mediante disección anatómica de la zona, se abordó el tercio medio del fémur, se crearon dos cavidades de 3 mm de diámetro en la corteza lateral, en dirección transversal al eje longitudinal del hueso hasta la zona medular, pero sin dañar ésta, lo que dejó una separación de 20 mm entre ellas. Para ello se empleó una fresa de 3 mm de diámetro, y se aplicó irrigación abundante con suero fisiológico. Se rellenó una de las cavidades con beta-FTC (Biograf-G). Para la segunda cavidad, tanto en el fémur como en la mandíbula, el proceder fue el mismo, con la única excepción de que, no se colocó ningún implante y se tomó ésta como referencia o sitio control, para determinar la capacidad de respuesta reparativa natural del tejido óseo del animal en los distintos periodos de implantación.
El procedimiento de implantación en la mandíbula fue similar al desarrollado en el fémur. Al finalizar cada periodo de portar el implante, los animales fueron anestesiados e intervenidos quirúrgicamente, para la extracción de los bloques de hueso implantados, los que se fijaron en formol neutro al 10 % y se identificaron respectivamente con las claves según el animal, el sitio y el periodo. Al concluir la última extracción, se sacrificó el animal con una sobredosis de anestesia. Los especímenes obtenidos se estudiaron macroscópicamente, y las piezas seleccionadas fueron sometidas a un proceso de descalcificación mediante una solución de ácido fórmico-citrato de sodio. Se aplicó el método de inclusión en parafina y, seguidamente, se hicieron cortes seriados en un micrótomo horizontal.
Se seleccionaron para el estudio, los cortes alternos 1, 3, 5, 7 y 9. Las láminas obtenidas fueron coloreadas con hematoxilina y eosina. Las observaciones histomorfológicas se realizaron por un solo especialista, con el uso de un microscopio binocular de luz. Para determinar la posible reacción tóxica local, se observó si hubo presencia de infiltrado inflamatorio en el tejido vecino al material implantado, y las características de la misma; además, la presencia o no de necrosis.
Para determinar la propiedad de osteoconducción y de histocompatibilidad, se observó si hubo crecimiento del hueso entre los gránulos del material en contacto directo con el mismo, y si cubrió el defecto. Además, se observó la presencia o ausencia de tejido fibroso entre el implante y el hueso vecino.
Para determinar la bioestabilidad, se observó si hubo o no biodegradación del material en las zonas de crecimiento óseo. En relación con los sitios control, se observaron las características de la reparación natural del defecto óseo en cada periodo.
Para precisar las observaciones microscópicas se estableció un sistema de puntuación de 0 a 3, el cual, se basó en el número de elementos observados al microscopio con mayor aumento (470 x), en un promedio de 5 campos examinados (Anexo).
Las observaciones microscópicas fueron registradas, procesadas y llevadas a cuadros para su representación. Por las características de los resultados no se hizo análisis estadístico por lo que éstos fueron representados en forma descriptiva.
RESULTADOS
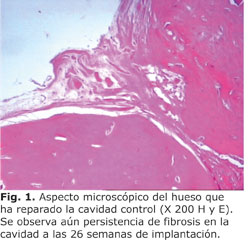
Dentro de los principales hallazgos microscópicos observados se apreció que en los sitios de control, a las 12 semanas, se observó formación de tejido óseo que cubrió parcialmente el defecto, con algunas áreas de tejido fibroso en la cavidad (Fig. 1). En el resto de los periodos, la reparación ósea de los defectos fue casi total, lo que evidenció la capacidad de respuesta reparativa de los animales. No obstante, la reparación en estos sitios fue más lenta que en los implantados. En ninguno de ellos, se observó respuesta inflamatoria, ni de otro tipo, que evidenciara anormalidad en la reparación (tabla 2).
Debido a que las características histopatológicas alrededor de los implantes a las 12 semanas fueron muy semejantes a las del periodo de 26 semanas, las describiremos en conjunto.
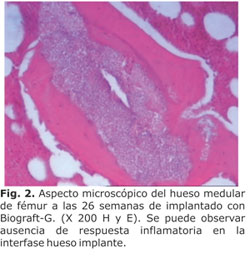
En los sitios donde se implantó el Biograft-G, tanto en la mandíbula como en el fémur, se observó reabsorción parcial del material implantado, y sustitución del mismo por una fina trama de tejido conectivo fibroso en la zona más profunda del defecto. Se pudo apreciar además la formación de tejido óseo joven alrededor de los espacios ocupados por los gránulos del implante, e íntimamente relacionado con el mismo; principalmente en la cortical del hueso donde se observó continuidad de la cortical a dicho nivel. No se identificaron elementos que indicaran reacción de rechazo, ni fibrosis entre el implante y el nuevo hueso formado (tabla 3 y Fig. 2).
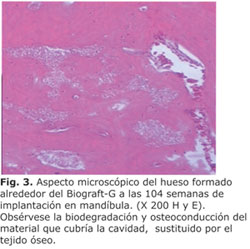
Los resultados a las 52 y 104 semanas de implantación, por presentar características similares entre sí, también serán descritos en conjunto. En los sitios donde se implantó el Biograft-G, se observó sustitución del material por tejido óseo, tanto en el fémur como en la mandíbula; este fue más marcado en las regiones corticales del hueso, donde la biodegradación del implante fue casi total (Fig. 3). En estos sitios, no se observaron reacciones del tejido que indicaran rechazo al material implantado (tabla 3).
DISCUSIÓN
En la literatura revisada, hemos podido apreciar estudios preclínicos y clínicos, sobre el uso del beta-FTC como material de implantación ósea, y los resultados de los mismos han sido por lo general satisfactorios.11-13 El Biograft-G (beta-FTC), se presentó como un material histocompatible en todos los implantes estudiados. Eggli y otros,14 observaron en su estudio, que los osteoclastos atacaban la superficie del implante, sin embargo, en nuestro trabajo no encontramos actividad osteoclástica en ninguno de los sitios de implantes estudiados. Se observó que el Biograft-G se degradó con cierta intensidad, esto coincide con los resultados de otros autores revisados en la literatura como Mayr15 y Klein.16
La biodegradación no es frecuente en otros materiales para implantes, puede mencionar el Apafill-G (hidroxiapatita), el cual se presentó no biodegradable en los resultados del estudio de Delgado y otros.17 Según la revisión hecha, el mecanismo de biodegradación no está claro, en sentido general, se plantea que el medio acídico disuelve el beta-FTC in situ.18 Como el beta-FTC es un material que tiene la propiedad de reabsorberse, el hueso nuevo que se forma ocupa el espacio donde estaba el implante;19 este fenómeno fue observado en nuestro trabajo a partir de los 12 semanas de implantación. Sin embargo, al igual que se plantea en la literatura,10 si bien el Biograft-G se reabsorbe a partir de etapas tempranas, pudimos observar que una parte del material, en algunos de los implantes, permaneció en su sitio por largos periodos, incluso, se pudo ver a las 104 semanas de implantación, principalmente en la región medular del hueso implantado.
Hirota y otros10 comprobaron que el hueso alogénico unido al beta-FTC reduce la reabsorción temprana de éste lo cual facilita la regeneración ósea. Otra propiedad observada por el Biograft-G, fue la de ser osteoconductor y representa un soporte para la regeneración ósea; esta característica ha sido observada con frecuencia en estudios anteriores.19 Sin embargo, se debe destacar que la actividad osteoconductora del Biograft-G, no es tan manifiesta como la de la hidroxiapatita, quizás debido a la gran bioestabilidad de la misma.17 Takeuchi y otros,19 demostraron que la osteoconducción es más efectiva cuando se implanta el beta-FTC con proteína morfogénica de hueso (PMH). En el sitio donde se implantó el Biograft-G, la osificación fue más rápida a nivel cortical que en la zona medular y persistió en este último sitio por más tiempo la fibrosis alrededor del implante.
Se pudo apreciar, en los sitios controles, donde las cavidades no tenían ningún material, que la osificación total del defecto se demoró más que en los sitios implantados.
Los resultados de este estudio, evidenciaron, que el Biograft-G, se presentó como un material histocompatible, osteoconductor y bioidegradable, lo que posibilitó la proliferación de tejido óseo en cavidades previamente hechas en el fémur y la mandíbula. Dichas propiedades, posibilitan que las grandes cavidades óseas, resultantes de extirpaciones quirúrgicas por tumores o quistes, se reparen con más rapidez si se rellenan. Además no se observó respuesta hística desfavorable que indicara rechazo a los implantes. Todos estos elementos, nos permiten inferir, que el Biograft-G se puede valorar como no tóxicos localmente, con ausencia de inflamación o respuesta a cuerpo extraño en el tejido.
CONCLUSIONES
En este estudio se comprobó que, el Biograft-G es un material histocompatible y osteoconductor cuando se utiliza en el relleno de defectos óseos. Es no tóxico localmente, al no causar respuesta hística desfavorable, después de ser implantado en el hueso mandibular y en el fémur. El Biograft-G se presentó como un material biodegradable.
Anexo. Sistema de puntuación de 0 a 3, el cual, se basa en el número de elementos observados al microscopio con mayor aumento (470 x), en un promedio de 5 campos examinados.
Para la inflamación, la puntuación se basó en el número de células inflamatorias observadas por campo como sigue:
0 - No se observaron células.
1,5 - de 1 a 5 células.
1 - de 6 a 15 células.
2 - de 16 a 25 células.
3 - de 26 o más células.
Para la necrosis y fibrosis, la puntuación de 0 a 3 fue:
0 - Ausente.
0,5 - Mínimo (presente en menos de un cuarto del área implantada).
1 - Ligero (presente en un cuarto del área implantada sin llegar a dos).
2 - Moderado (presente en dos cuartos del área implantada).
3 - Intenso (presente en más de dos cuartos del área implantada).
Para la toxicidad local, se empleó el siguiente intervalo de puntuación:
- No tóxico (ausencia de inflamación, de necrosis u otro tipo de alteración).
- Toxicidad muy ligera (escala 0,5 de la inflamación).
- Toxicidad ligera (escala 1 de la inflamación y hasta 1 de la fibrosis).
- Toxicidad moderada (escala 2 de la inflamación y hasta 2 de la fibrosis).
- Toxicidad intensa (escala 3 de la inflamación y desde 0,5 hasta 3 de la necrosis).
REFERENCIAS BIBLIOGRÁFICAS
1. Szabó G, Coulthard P, Maiorana C, Garagiola U, Barabás J, Németh Z, et al. A Prospective multicenter randomized clinical trial autogenous bone versus beta-tricalcium phosphate graft alone for bilateral sinus elevation: histologic and histomorphometric evaluation. Int J Oral Maxillofac Implants. 2005;20(3):371-81.
2. Matsushima A, Kotobuki N, Tadokoro M, Kawate K, Yajima H, Takakura Y, et al. In vivo osteogenic capability of human mesenchymal cells cultured on hydroxyapatite and on beta-tricalcium phosphate. Artif Organs. 2009;33(6):474-81.
3. Tazaki J, Murata M, Akazawa T, Yamamoto M, Ito K, Arisue M, et at. BMP-2 release and dose-response studies in hydroxyapatite and beta-tricalcium phosphate. Biomed Mater Eng. 2009;19(2-3):141-6.
4. Zhou AJ, Peel SA, Clokie CM. An evaluation of hydroxyapatite and biphasicalcium phosphate in combination with Pluronic F127 and BMP on bone repair. J Craniofac Surg. 2008;19(3):871-80.
5. Ogose A, Hotta T, Kamashima H, Kondo N, Gu W, Kamura T, Endo N. Comparison of hydroxiapatite and beta tricalcium phosphate as bone substitutes alter escisión of bono tumors. J Biomed Mater Res B Appl Biomater. 2005;72(1):94-101.
6. Okuda K, et al. Platelet-rich plasma combined with a porous hydroxiapatite graft for the treatment of intrabony periodontal defects in human: a comparative controlled clinical study. J Periodontol. 2005;76(6):890-8.
7. Zerbo IR et al. Histomorphometry of human sinus floor augmentation using a porous beta-tricalcium phosphate: a prospective study. Clin Oral Implants Res. 2004;15(6):724-32.
8. Demiralp B et al. Treatment of periapical inflammatory lesion with the combination of platelet-rich plasma and tricalcium phosphate: a case report. J Endod. 2004;30(11):796-800.
9. Zhao BH et al. Effects of TCP/HA-coating titanium on the adhesion behavior of human gingival fibroblasts. Zhonghua Kou Qiang Yi Xue Za Zhi. 2004;39(6):501-11.
10. Hirota M, et al. Combination with allogenic bone reduces early absorption of beta-tricalcium phosphate (beta-TCP) and enhances the role as a bone regeneration scaffold. Experimental animal study in rat mandibular bone defects. Dent Mater J. 2009;28(2):153-61.
11. Hesaraki S, Safari M, Shokrgozar MA. Development of beta-tricalcium phosphate/sol-gel derived bioactive glass composites: physical, mechanical, and in vitro biological evaluations. J Biomed Mater Res B Appl Biomater. 2009;91(1):459-69.
12. Oi Y, Ota M, Yamamoto S, Shibukawa Y, Yamada S. Beta-tricalcium phosphate and basic fibroblast growth factor combination enhances periodontal regeneration in intrabony defects in dogs. Dent Mater J. 2009;28(2):162-9.
13. Epstein NE. Beta tricalcium phosphate: observation of use in 100 posterolateral lumbar instrumented fusions. Spine J. 2009;9(8):630-8.
14. Eggli PS, Miller W, Schenk RK. Porous hydroxyapatite and tricalcium phosphate cylinders with two diferent pore size ranges implanted in the cancellous bone in rabbits. Clin Orthop. 1988;23(2):127-37.
15. Mayr HO, Dietrich M, Fraedrich F, Hube R, Nerlich A, von Eisenhart-Rothe R, et al. Microporous pure beta-tricalcium phosphate implants for press-fit fixation of anterior cruciate ligament grafts: strength and healing in a sheep model. Arthroscopy. 2009;25(9):996-1005.
16. Klein CPAT, Dreissen AA, de Groot K, van den Hooff. A biodegradation behavior of various calcium phosphate materials in bone tissue. J Biomed Mater Res. 1983;17:769-84.
17. Delgado FR, el al. Evaluación anatomopatológica experimental de la implantación en hueso de la Hidroxiapatita sintética (Apafill-G). Rev Habanera de Ciencias Med. 2006;5(4):RNPS 2034 ISSN 1729-519X.
18. Jarcho J. Calcium phosphate ceramics as hard tissue prosthetics. Clin Orthop. 1981;157:259-78.
19. Takeuchi H, Nagayama M, Imaizumi Y, Tsukahara T, Nakazawa J, Kusaka Y, et al. Immunohistochemical analysis of osteoconductivity of beta Tricalcium phosphate and carbonate apatite applied in femoral and parietal bone defects in rats. Dent Mater J. 2009;28(5):595-601.
Recibido: 13 de enero de 2010.
Aprobado: 20 de marzo de 2010.
Dr. Joaquín Urbizo Vélez. Facultad de Estomatología, Universidad de Ciencias Médicas de La Habana, Cuba. E-mail: joaquin.urbizo@infomed.sld.cu