Introducción
En el 2019 el Centro Nacional para la Prevención y Control de VIH/sida en México notificó que 89 910 casos de VIH se encontraban vivos según el estado de evolución.1 Sin tratamiento, la infección por VIH causa el síndrome de inmunodeficiencia adquirida (sida) y cánceres propios del sida como el linfoma no Hodgkin, sarcoma de Kaposi y cáncer de cuello uterino.2 En las últimas décadas el tratamiento del VIH ha mejorado dramáticamente disminuyendo el riesgo de sida, mejorando la función inmune y la supervivencia, y ha reducido los cánceres propios del sida en esta población. Sin embargo, a medida que las personas que viven con el VIH tienen vidas más largas y saludables, experimentan un mayor riesgo de presentar otros tipos de cáncer que no están relacionados con el sida como el linfoma de Hodgkin y los cánceres de boca, garganta, hígado, pulmón y ano.3
El sarcoma de Kaposi representa aproximadamente el 12 % de los cánceres diagnosticados en personas que viven con VIH.4 Es una neoplasia maligna multifocal de células endoteliales, descrita por primera vez en 1872 por Moritz Kaposi. Se presenta con máculas y pápulas características en la piel. El riesgo de presentarse en esta población es 500 veces mayor.5 El objetivo es, pues, describir un caso de sarcoma de Kaposi que, por sus características, entorpeció el diagnóstico de infección por VIH
Presentación del caso
Paciente masculino, de 30 años de edad, que al asistir a consulta refería que desde hacía dos años había comenzado con un aumento de volumen en la región derecha del cuello. El médico general le informó que se trataba de un ganglio inflamado y por lo que no recibió tratamiento. Seis meses después notó múltiples hematomas y edema en el miembro inferior derecho, por lo cual acudió a la consulta de angiología, en la que recibió tratamiento con escleroterapia y terapia medicamentosa durante seis meses. Al empeorar el cuadro clínico acudió al servicio de medicina interna, en el que se le indicó complementarios hematológicos y panel viral, este último fue positivo para VIH/sida y se transfirió al paciente a consulta de cirugía maxilofacial, con un diagnóstico presuntivo de tuberculosis o linfoma, para una biopsia excisional de la adenopatía cervical derecha, a fin de valorar si esta tenía relación con el cuadro clínico.
Al examen físico el paciente presentó claudicación intermitente dolorosa. Se observó edema generalizado en ambos miembros inferiores, con lesiones hiperpigmentadas de gran extensión, de aspecto macular y papular, que iban del color verde-amarillento al azul, con tonos violáceos, rojos y púrpuras hasta el color negro. Estas lesiones se extendían desde la región calcánea a la región plantar, dedos del pie y llegaba a la región anterior de las piernas. En la región anterior de la pierna derecha dichas lesiones convergían formando placas elevadas y papulares de gran tamaño, con bordes irregulares y límites poco definidos que cubrían casi en su totalidad la superficie de dicha región y una úlcera de 0,5 x 0,5 cm en el borde medial anterior de la pierna; mientras que en la región anterior de la pierna izquierda las lesiones eran pequeñas y multifocales. En el dorso de la mano izquierda se observó una lesión purpúrea y circunscrita de 1,0 x 1,0 cm. Dentro de la boca, en la mucosa del paladar duro, por detrás de las rugas palatinas, se observó una lesión pigmentada, no elevada, que abarcaba la línea media palatina y se extendía hacia la hemiarcada izquierda, de color violácea en su mayor superficie y con tonalidades azules y rojas hacia su periferia, de aproximadamente 3,0 x 2,0 cm, de bordes irregulares y poco definidos (Fig. 1).
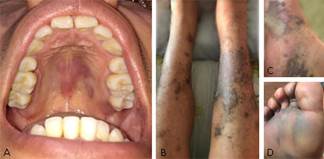
Fig. 1 A. Mancha en vino de Oporto en la mucosa del paladar, que abarca la línea media palatina y se extiende hacia la hemiarcada izquierda con una lesión satélite adyacente y otra en la tuberosidad del maxilar del mismo lado. | B. Lesiones hiperpigmentadas de aspecto macular y papular de ambos miembros inferiores. | C. y D. Lesiones de la región plantar de miembro inferior derecho.
En el cuello se observó una adenopatía en nivel III derecho de 4,0 x 2,0 cm y otra en el nivel V izquierdo de 1,0 x 0,5 cm. Ambas bien circunscritas, normocoloreadas, no fijas a piel o planos profundos, no dolorosas y normotérmicas. En los complementarios de tipo hematológicos presentó una cuenta de linfocitos CD4+ de 147 μL y una carga viral VIH de 92,705 mL. La tomografía axial computarizada (TAC) contrastada de tórax, abdomen y pelvis informó la presencia de adenopatías a nivel paraaórtico infrarrenal izquierdo, así como en mesocolon derecho, con una alta captación del contraste.
Se realizó una biopsia por aspiración con aguja fina (BAAF) de la adenopatía cervical derecha la cual no identificó la presencia de células epiteliales.
Se programó la exéresis de la adenopatía cervical derecha. Mediante una incisión arciforme en un pliegue cutáneo del cuello, aproximadamente 5 cm adyacente a la adenopatía. Se incidió sobre la piel, el tejido celular subcutáneo y el músculo platisma. Se elevó un colgajo subplastisma y mediante disección roma se expuso la adenopatía y se realizó su exéresis. La pieza quirúrgica fue enviada para su estudio anatomopatológico con una impresión diagnóstica de sarcoma de Kaposi vs. linfoma. El paciente evolucionó favorablemente a la adenectomía cervical (Fig. 2).
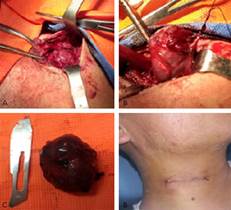
Fig. 2 A. y B. Exposición y exéresis de la adenopatía. | C. Espécimen quirúrgico. | D. Herida quirúrgica.
El resultado anatomopatológico confirmó sarcoma de Kaposi, ya que la lesión estaba compuesta por haces de células fusiformes, con escaso citoplasma, intensamente eosinófilo y núcleo alargado, con cromatina finamente granular. Estas células formaban hendiduras de aspecto vascular con presencia de eritrocitos en su interior. Se identificaron glóbulos malignos, eosinófilos, pequeños, aledaños. La inmunohistoquímica fue positiva para VHH-8 (Fig. 3).
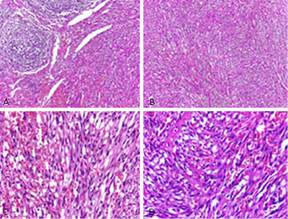
Fig. 3 A. y B. Lesión focal irregular, compuesta de haces de células fusiformes (10x). | C. y D. Hendiduras de aspecto vascular con presencia de eritrocitos en su interior, así como escasos globos hialinos (40x).
Una vez confirmado el diagnóstico, se declaró la enfermedad en estadio T1,I1,S0 remitiendo al paciente a su centro de salud correspondiente para terapia antirretroviral y oncológica apropiada.
Discusión
Actualmente en México 301 182 personas viven con VIH/sida,6 pero no se sabe con exactitud la tasa de incidencia de las neoplasias malignas asociadas a este síndrome. Sin embargo, el Instituto Nacional de Cancerología refiere una disminución de nuevos casos de sarcoma de Kaposi a partir del acceso en México al tratamiento antirretroviral.7 Se sabe también que existe un mayor riesgo de desarrollar cáncer en personas con VIH/sida, probablemente debido a la disregulación inmune subyacente y la coinfección con virus como el papiloma humano (VPH), herpes humano 8 (HHV-8), hepatitis B (VHB), hepatitis C (VHC) y Epstein-Barr (VEB).
Se han descrito cuatro tipos de sarcoma de Kaposi, pero cuando ocurre en contexto con el VIH, se considera una enfermedad asociada al sida y se conoce como sarcoma de Kaposi relacionado al SIDA.8 Ha estado universalmente asociado con la infección por HHV-8 desde 1994 cuando Chang y otros9 identificaron la presencia de ADN de este virus en muestras cutáneas. Según Florek y otros,10) el virus parece ser una condición necesaria pero no absoluta de esta enfermedad. Contrario de Antman y Chang11 argumentando que más del 95 % de las lesiones de sarcoma de Kaposi, independientemente de su subtipo clínico, están infectadas con HHV-8, por lo que consideran la presencia de este como factor primario y necesario en su desarrollo. En la actualidad se sabe que el HHV-8 juega un papel importante en el origen del sarcoma de Kaposi, como lo corroboró la inmunohistoquímica en el caso presentado, pero la inmunosupresión por el diagnóstico tardío del VIH/sida fue también un factor desencadenante.
Clínicamente el sarcoma de Kaposi se presenta con lesiones cutáneas maculares asintomáticas, violáceas, rosadas o rojas que pueden converger para formar placas y nódulos de color azul violáceo o negro; también puede haber edema. En ocasiones los nódulos pueden penetrar en el tejido blando e invadir hueso. En un 40 % de los casos pueden aparecer lesiones en las mucosas oral y en la conjuntiva ocular.12) Aunque estas lesiones son características del sarcoma de Kaposi, no son patognomónicas, por lo que es importante tener en cuenta que ciertas enfermedades infecciosas pueden provocar lesiones cutáneas similares en esta población.
Forrastel y otros13) reportaron 3 casos de angiomatosis basilar en pacientes infectados por VIH/sida que clínicamente e histológicamente fueron reportadas como sarcoma de Kaposi. De igual modo, Giudice y otros14 describieron el caso de un paciente con VIH/sida que padecía severa inmunodepresión, el cual manifestaba lesiones cutáneas similares al sarcoma de Kaposi; sin embargo, el estudio histopatológico reportó histoplasma capsulatum en todas las muestras enviadas, por lo que se le diagnosticó histoplasmosis diseminada.
Asimismo, debe hacerse diagnóstico diferencial con otras enfermedades dentro del espectro clínico de aquellas asociadas al HHV-8, como el linfoma de efusión primario y la enfermedad de Castleman multicéntrica, sobre todo si múltiples cadenas ganglionares, vísceras o estructuras óseas están involucradas.15Cacciari y otros16 reportaron dos casos clínicos con VIH/sida que presentaban adenomegalias generalizadas, síntomas B y lesiones cutáneas planas de color marrón, por lo que sospecharon sarcoma de Kaposi; la biopsia ganglionar informó enfermedad de Castleman multicéntrica relacionada al HHV-8. Rodriguez y otros17 publicaron un estudio de un caso clínico de una mujer inmunosuprimida con dermatosis de curso indolente en extremidades, múltiples adenomegalias, esplenomegalia y síntomas sistémicos. Mediante inmunohistoquímica se comprobó la coexistencia de sarcoma de Kaposi y enfermedad de Castleman multicéntrica relacionados al HHV-8. Tal vez la falta de familiaridad de las características clínicas del sarcoma de Kaposi por parte de los médicos que la trataron pudo deberse a la gran variedad de infecciones, coinfecciones y enfermedades que comparten características clínicas e imagenológicas en pacientes que viven con VIH/sida.
Con respecto al pronóstico, en 1997 Krown y otros18 describieron las recomendaciones y criterios para la clasificación del estadio del sarcoma de Kaposi relacionado al sida, para lo que utilizaron el sistema TNM que evalúa el tumor, el sistema inmune y la enfermedad sistémica con 0 para un buen pronóstico y 1 para un pronóstico desfavorable. Para Maya y otros19 la presencia de lesiones bucales y el linfoedema asociados al sarcoma de Kaposi son signos ominosos de fatalidad, por lo que enfatiza en su diagnóstico precoz. Volkow y otros20 consideran que una alta carga viral con extensivas lesiones en piel e involucramiento pulmonar por el sarcoma de Kaposi pueden llevar al paciente a un síndrome inflamatorio de reconstitución inmune (SIRI) al momento de iniciar la terapia antirretroviral, lo cual está asociado a un pronóstico desfavorable. Esto concuerda con el Italian Cooperative Group on AIDS and Tumors,21 que sugiere que las características de la T y S tienen mejor valor pronóstico que la etapa 1, como lo demostraron en su estudio, en el que evaluaron 211 pacientes con sarcoma de Kaposi relacionado al SIDA, de los cuales, los estadios T1S1 tuvieron una tasa de supervivencia a los tres años de 53 %; mientras que los estadios T0S0, T1S0 o T0S1 tuvieron una tasa se supervivencia de hasta 88 %. El caso presentado se clasificó como T1I1S0 con pronóstico desfavorable, debido a la carga viral y la clínica observada. Actualmente el paciente se encuentra con tratamiento antirretroviral y cumpliendo su segundo ciclo de quimioterapia con doxorrubicina liposomal.
Conclusiones
El sarcoma de Kaposi es el cáncer más común relacionado al sida. La falta de familiaridad con las características clínicas, así como la falta de una biopsia de las lesiones cutánea y un examen completo de la cavidad oral, ocasionaron que esta neoplasia pasara desapercibida en los exámenes médicos de rutina, lo cual condujo a un bajo índice de sospecha de la infección por VIH/sida y retrasó el tratamiento oportuno. Cuando la inmunosupresión está avanzada, el sarcoma de Kaposi relacionado al sida tiende a ser más agresivo.














