Introducción
La evidencia del potencial preventivo y terapéutico de los aceites esenciales en el tratamiento de enfermedades bucales es considerable. La hierbaluisa es una planta popular usada en la medicina ancestral por sus propiedades antibacterianas, antifúngicas, antioxidantes, antiproliferativas, antivirales y antiinflamatorias para diversas enfermedades humanas. Su extracto puede ser empleado en enjuagues o pastas dentales para el manejo de la halitosis, control del biofilm, manejo de la gingivitis, periodontitis, prevención de caries y actividad antifúngica.1,2 La hierbaluisa pertenece al género Cymbopogon Spreng y la familia Poaceae. Los principales componentes del aceite esencial son el geranial (citral α), neral (citral β), geraniol y mirceno. 3)
La Porphyromona gingivalis es una bacteria encontrada en el surco gingival y se asocia a la presencia de enfermedad periodontal.4 El extracto de hierbaluisa ha sido efectivo para controlar la P. gingivalis. 5) Por lo tanto, su aceite puede ser usado para controlar los periodontopatógenos como terapia adjunta a la higiene oral mecánica.
El Enterococcus faecalis es el principal patógeno que se detecta en infecciones endodónticas persistentes y asintomáticas. Su prevalencia varía del 13,83 % al 89,6 % en las infecciones.6 Estudios previos han demostrado que el aceite de hierbaluisa tiene efecto antibacteriano en el crecimiento del E. faecalis.7
El Staphylococcus aureus es un oportunista que causa infecciones sistémicas y dentales en el ser humano. Su prevalencia en la infecciones orales como abscesos dentales, abscesos periodontales, gingivitis, periodontitis, caries, pulpitis y aftas bucales es del 43,1 %.8 Existe evidencia sobre el efecto inhibitorio del aceite de hierbaluisa sobre esta bacteria.9
La Candida albicans es un hongo común de la microbiota humana, aunque generalmente es inofensivo, su crecimiento excesivo puede causar varias complicaciones en el hospedador, desde infecciones superficiales localizadas hasta candidiasis sistémicas.10 El aceite de hierbaluisa ha mostrado efectos antifúngicos y citotóxicos que pueden emplearse como terapia antifúngica.11
En la literatura se evidencia que la hierbaluisa tiene un efecto inhibitorio sobre algunos patógenos orales, sin embargo, los componentes químicos de la hierbaluisa pueden variar dependiendo del origen geográfico de la planta.3 Por ello, se planteó estudiar el aceite esencial obtenido de esta planta recolectada en dos regiones del Ecuador, con el propósito de desarrollar un producto natural efectivo y seguro para el control de varias infecciones. Por lo expuesto, este estudio tuvo como objetivo determinar in vitro el efecto inhibitorio del aceite esencial de hierbaluisa procedente del oriente (provincia de Pastaza) y la costa (provincia de Los Ríos) ecuatoriana al 25, 50, 75 y 100 % a las 24, 48 y 72 horas sobre la P. gingivalis, E. faecalis, S. aureus y C. albicans.
Métodos
Estudio experimental, in vitro.
Elaboración del aceite
Las hojas se recolectaron en las provincias de Pastaza (región oriente) y Los Ríos (región costa). Se trasladaron al laboratorio de Ciencias Químicas de la Universidad Central del Ecuador, en donde fueron lavadas, secadas y desinfectadas. Se usó la técnica de destilación por arrastre de vapor, utilizando un equipo de destilación certificado que se mantuvo en una temperatura de 25º C a 30º C, para evitar pérdidas de aceite esencial por volatilización. Se realizaron tres destilaciones cada una con una duración de 3 h. Se utilizaron 15 kg de hojas frescas de hierbaluisa cortadas en trozos pequeños de cada una de las provincias.
Análisis fitoquímico
Se pesaron 20 gramos aproximadamente de las hojas secas y molidas. Se agregaron 50 ml de etanol de 75° y se maceraron por un período de 72 horas. La muestra del aceite esencial se filtró al vacío y se concentró en un rotovapor hasta la mitad del volumen inicial. El extracto etanólico total obtenido fue sometido a las reacciones de identificación.
Análisis cromatográfico del aceite
El método cromatográfico se desarrolló en el equipo Agilent GCMS 7820A - 5977E, equipado con una columna HP-5ms Ultra Inert (-60 °C - 325 °C (325 °C): 30 m x 250 μm x 0.25 μm) de la Facultad de Ingeniería Química de la Universidad Central del Ecuador. Una alicuota de 500 μl de muestra pura fue diluida en 2 ml de cloroformo. El análisis se realizó con un volumen de inyección de 1 μl, con temperatura de inyección de 250°C, tasa de split de 2:1 y 1 ml/min de He como gas portador. El horno inició en una temperatura de 40°C durante 1 min, aumentó a 100°C a razón de 10°C/min y una espera de 10 min, para finalmente crecer hasta 200°C a razón de 3°C/min. La temperatura de la línea de transferencia fue de 280°C. El detector de MS de impacto de electrones mantuvo temperaturas de la fuente y del cuadrupolo de 230 y 150 °C, respectivamente. La detección se realizó con barrido desde 20 a 400 uma, utilizando 70 eV.
Activación de los microorganismos y medición de los halos de inhibición
Se observaron los halos de inhibición del aceite de hierbaluisa en una muestra de 10 cajas Petri para cada microorganismo. Con esa finalidad, se utilizaron las cepas de P. gingivalis ATCC 33277, E. faecalis ATCC 29212, S. aureus ATCC 25293 y C. albicans ATCC 10231. Se preparó una solución con cada microorganismo equivalente a 0,5 de la escala McFarland con la ayuda de un densitómetro. Se cultivó cada microorganismo con la ayuda de un hisopo estéril en las cajas Petri, empleando Agar Sangre para el cultivo de la P. gingivalis y S. aureus; Agar Sabouread para la C. albicans y Agar Mueller-Hinton para el E. faecalis. Se colocaron seis discos de papel filtro estériles en cada caja Petri, en el extremo se ubicaron cuatro discos cada uno impregnado en una concentración del aceite de hierbaluisa al 25 %, 50 %, 75 % y 100 % y cerca al centro un disco con suero fisiológico (control negativo) y el control positivo (clorhexidina 0,12 % para las bacterias y nistatina para la C. albicans). Las muestras se mantuvieron en condiciones de anaerobiosis a 37° durante 72 horas y se midieron los halos de inhibición a las 24, 48 y 72 horas, usando la regla Antibiotic Zone Scale (mm).
Se empleó la escala de Duraffourd12 para identificar la inhibición del microorganismo, siendo nula cuando el halo de inhibición era ≤ 8 mm, sensibilidad límite para los halos de 9-14 mm, sensibilidad media si el halo presenta de 15 a 19 mm y sumamente sensible cuando el halo era ≥ 20 mm.
Resultados
Composición química
El análisis por cromatografía del aceite de hierbaluisa del oriente mostró que el 57 % del aceite estuvo compuesto por geraniol (20,52) y el 15,52 % por citral (21,31) (figura 1 A). El aceite de la costa se compone el 46,04 % por geraniol (20,81) y 31,62 % por citral (19,79) (figura 1 B).
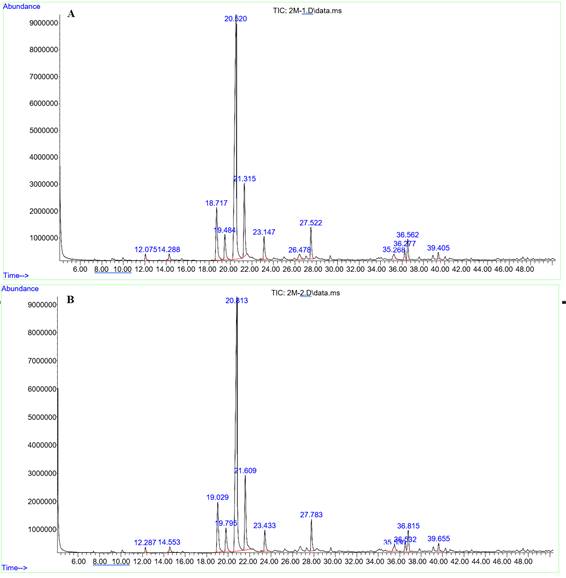
Fig.1 -Cromatografía de gases del aceite esencial, A. Aceite de hierbaluisa del oriente, B. Aceite de la costa.
El análisis fitoquímico de las hojas de hierbaluisa de la costa dio positivo para cumarinas y negativo para las hojas de oriente. El resto de los hallazgos fueron similares (tabla 1).
Tabla 1 . Tamizaje fitoquímico de la hierbaluisa procedente del oriente y de la costa ecuatoriana
| Alcaloides | Oriente | Mayer | Negativo |
| Costa | Negativo | ||
| Oriente | Draggendorff | Negativo | |
| Costa | Negativo | ||
| Oriente | Wagner | Negativo | |
| Costa | Negativo | ||
| Triterpenos/esteroles | Oriente | Lieberman/Buchard | Positivo (+ +) |
| Costa | Positivo (+ +) | ||
| Oriente | Zack | Positivo (+ +) | |
| Costa | Positivo (+ +) | ||
| Flavonoides | Oriente | Shinoda | Positivo (+ +) |
| Costa | Positivo (+ +) | ||
| Oriente | Cianidina | Positivo (+ +) | |
| Costa | Positivo (+ +) | ||
| Antraquinonas | Oriente | Bomtrager | Negativo |
| Costa | Negativo | ||
| Taninos | Oriente | Cloruro ferrico | Negativo |
| Costa | Negativo | ||
| Oriente | Gelatina | Negativo | |
| Costa | Negativo | ||
| Oriente | Zinc amoniacal | Negativo | |
| Costa | Negativo | ||
| Saponinas | Oriente | Agua | Positivo (+) |
| Costa | Positivo (+) | ||
| Oriente | Hemólisis | Positivo (+) | |
| Costa | Positivo (+) | ||
| Heterósidos cardiotónicos | Oriente | Biajet | Negativo |
| Costa | Negativo | ||
| Oriente | Kedde | Negativo | |
| Costa | Negativo | ||
| Cumarinas | Oriente | Hidróxido de potasio | Negativo |
| Costa | Positivo (+) |
Actividad antimicrobiana
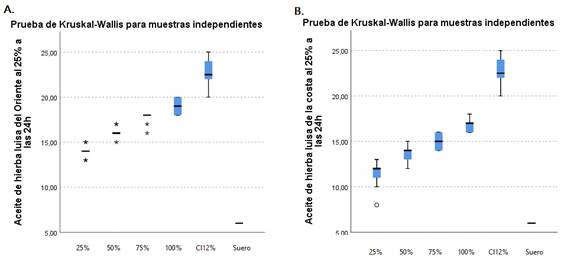
La actividad antimicrobiana del aceite esencial de hierbaluisa se probó para cada microorganismo, los resultados de las zonas de inhibición se muestran en la tabla 2. El aceite esencial demostró actividad antimicrobiana para el S. aureus y no fue efectivo para la C. albicans, E. faecalis y P. gingivalis, ya que la inhibición fue inferior a la del control positivo. Se encontró que hubo diferencias entre los aceites esenciales y los controles en todos los microorganismos (p < 0,00).
Tabla 2 - Diámetros de las zonas de inhibición en milímetros para la C. albicans, E. faecalis, S. aureus y P. gingivalis con los aceites esenciales de hierbaluisa
| Aceite esencial/Control | Zona inhibición 24 horas (mm) | Zona inhibición 48 horas (mm) | Zona inhibición 72 horas (mm) | ||||
|---|---|---|---|---|---|---|---|
|
Media (n = 10) |
DS |
Media (n = 10) |
DS |
Media (n = 10) |
DS | ||
| HO 25 % | 6,00 | 0,00 | 6,00 | 0,00 | 6,00 | 0,00 | 0,00 |
| HO 50 % | 6,80 | 0,78 | 6,30 | 0,48 | 6,30 | 0,48 | |
| HO 75 % | 7,60 | 0,96 | 6,90 | 0,56 | 6,90 | 0,56 | |
| HO 100 % | 8,90 | 1,19 | 7,90 | 0,73 | 7,90 | 0,73 | |
| HC 25 % | 6,00 | 0,00 | 6,00 | 0,00 | 6,00 | 0,00 | |
| HC 50 % | 6,00 | 0,00 | 6,00 | 0,00 | 6,00 | 0,00 | |
| HC 75 % | 6,00 | 0,00 | 6,00 | 0,00 | 6,00 | 0,00 | |
| HC 100 % | 6,10 | 0,31 | 6,10 | 0,31 | 6,10 | 0,31 | |
| Nistatina | 19,60 | 1,64 | 19,60 | 1,64 | 19,60 | 1,64 | |
| Suero fisiológico | 6,00 | 0,00 | 6,00 | 0,00 | 6,00 | 0,00 | |
| HO 25 % | 14,00 | 0,66 | 13,70 | 0,67 | 13,70 | 0,67 | 0,00 |
| HO 50 % | 16,10 | 0,56 | 16,00 | 0,66 | 16,00 | 0,66 | |
| HO 75 % | 17,70 | 0,67 | 17,70 | 0,67 | 17,70 | 0,67 | |
| HO 100 % | 19,10 | 0,87 | 19,00 | 0,81 | 19,00 | 0,81 | |
| HC 25 % | 11,30 | 1,41 | 11,30 | 1,41 | 11,30 | 1,41 | |
| HC 50 % | 13,50 | 0,97 | 13,50 | 0,97 | 13,50 | 0,97 | |
| HC 75 % | 15,00 | 0,81 | 14,70 | 0,82 | 14,70 | 0,82 | |
| HC 100 % | 16,80 | 0,78 | 16,70 | 0,94 | 16,70 | 0,94 | |
| Cl 0,12 % | 22,80 | 1,47 | 22,50 | 1,43 | 22,50 | 1,43 | |
| Suero fisiológico | 6,00 | 0,00 | 6,00 | 0,00 | 6,00 | 0,00 | |
| HO 25 % | 6,90 | 0,56 | 6,90 | 0,56 | 6,90 | 0,56 | 0,00 |
| HO 50 % | 11,60 | 2,41 | 11,60 | 2,41 | 11,60 | 2,41 | |
| HO 75 % | 10,90 | 1,91 | 10,90 | 1,91 | 10,90 | 1,91 | |
| HO 100 % | 11,90 | 1,37 | 11,80 | 1,47 | 11,90 | 1,44 | |
| HO 25 % | 8,90 | 1,19 | 8,50 | 1,17 | 8,70 | 1,56 | |
| HC 50 % | 6,90 | 0,73 | 6,90 | 0,73 | 6,90 | 0,73 | |
| HC 75 % | 7,30 | 0,48 | 7,30 | 0,48 | 7,30 | 0,48 | |
| HC 100 % | 7,20 | 0,42 | 7,20 | 0,42 | 7,20 | 0,42 | |
| Cl 0,12 % | 19,80 | 0,78 | 19,80 | 0,78 | 19,80 | 0,78 | |
| Suero fisiológico | 6,00 | 0,00 | 6,00 | 0,00 | 6,00 | 0,00 | |
| HO 25 % | 6,80 | 0,42 | 6,50 | 0,52 | 6,50 | 0,52 | 0,00 |
| HO 50 % | 7,40 | 0,69 | 7,40 | 0,69 | 7,40 | 0,69 | |
| HO 75 % | 7,70 | 0,48 | 7,60 | 0,51 | 7,60 | 0,51 | |
| HO 100 % | 8,00 | 0,47 | 7,90 | 0,56 | 7,90 | 0,56 | |
| HC 25 % | 6,80 | 0,91 | 6,30 | 0,48 | 6,30 | 0,48 | |
| HC 50 % | 6,90 | 0,87 | 6,70 | 0,67 | 6,70 | 0,67 | |
| HC 75 % | 7,00 | 0,66 | 6,80 | 0,63 | 6,80 | 0,63 | |
| HC 100 % | 7,10 | 0,73 | 6,80 | 0,78 | 6,80 | 0,78 | |
| Cl 0,12 % | 14,30 | 1,33 | 14,00 | 0,94 | 14,00 | 0,94 | |
| Suero fisiológico | 6,00 | 0,00 | 6,00 | 0,00 | 6,00 | 0,00 | |
HO: Hierbaluisa oriente
HC: Hierbaluisa costa
Cl 0,12 %: Clorhexidina al 0,12 %
Al ser efectivo el aceite para el S. aureus, se realizó una comparación entre los aceites y los controles positivos y negativos. No hubo diferencias entre las zonas de inhibición del aceite de hierbaluisa de la costa y el de oriente al 75 % y 100 % con la clorhexidina al 0,12 (p > 0,05) (figura 2).
Discusión
Los resultados de este estudio mostraron que el aceite de hierbaluisa del oriente y de la costa de Ecuador están constituidos principalmente por geraniol y citral, siendo mayor la proporción de geraniol. Esto difiere de un estudio previo que encontró la presencia de mirceno (38,3 %) en mayor proporción que el geraniol (2,3 %) y el citral (18,6 %).13Gao y otros14 encontraron en el aceite de hierbaluisa un 29,36 % de citral, 30,39 % de neral y 25,39 % de cariofilenos, mientras que Powers y otros11 hallaron un 49,9 % de citral, 7,6 % de geraniol y 23,4 % de neral. El citral tiene propiedades antibacterianas que destruyen la célula debido al aumento de la actividad de la permeabilidad celular, la alteración de la morfología y la disminución de la síntesis de ATP de la bacteria.15Chaves-Quirós y otros16 hallaron que el citral tiene efectos citotóxicos incluso a bajas concentraciones, lo que puede deberse a mecanismo prooxidantes a nivel celular. La composición de la hierbaluisa y el aceite esencial varía según el método de extracción, las diferencias genéticas, la parte de la planta utilizada, la edad / etapa de madurez, la estación de cosecha y el origen geográfico.3,17 Es probable que estos factores incidieron en los componentes obtenidos en nuestro aceite esencial y hayan influido en el efecto antimicrobiano.
En nuestro estudio, el aceite esencial de hierbaluisa inhibió el S. aureus. Christensen y otros18 y Alzamora y otros19 hallaron un halo de inhibición de 28,33 mm y de 20,0 mm, respectivamente. Con el aceite de hierbaluisa demostraron propiedades antibacterianas, atribuidas al citral quien interfiere con la viabilidad celular. Por otro lado, un estudio que empleó el aceite esencial de hierbaluisa al 100 %, proveniente de la provincia del Oro, Ecuador, obtuvo un halo de inhibición de 6-8 mm para el S. aureus.20
Nuestros hallazgos difieren de los reportados por Samadi y otros,21 cuyos resultados manifestaron que el aceite de hierbaluisa produjo una zona de inhibición de 19 mm para la C. albicans, demostrando su efecto inhibitorio. Otros estudios evaluaron la concentración inhibitoria mínima (CIM) del aceite de hierbaluisa sobre la C. albicans y hallaron una actividad antifúngica,11,13 que se atribuye a la disminución de la regulación de las adhesinas de las hifas y los factores de virulencia del hongo por parte del citral;14 y la inhibición de los factores de virulencia atribuidos a la transición de levadura a hifa, asociados al citronelol.22
El E. faecalis no fue inhibido por el aceite esencial de hierbaluisa en el presente estudio. Sin embargo, Lahagu y otros23 reportaron halos de inhibición de 17,78 mm y Subramaniam y otros24 encontraron un halo de inhibición superior a los 15 mm, demostrando la inhibición de este microorganismo con el aceite de hierbaluisa. Soraya y otros25 encontraron un halo de inhibición de 11,3 mm con el extracto del tallo de la hierbaluisa.
Respecto a la P. gingivalis, Park y otros26 y Morillo y otros27 hallaron que el aceite esencial de hierbaluisa dio unos halos de inhibición de 13,80 mm y 13,50 mm, respectivamente. La inhibición de la P. gingivalis por el aceite esencial de hierbaluisa puede deberse a que el citronelol y el geraniol forman puentes de hidrógeno con la peptidil arginina deiminasa de la bacteria.28
Las limitaciones del estudio fueron que el aceite de hierbaluisa obtenido no representa la diversidad de las plantas presentes en Ecuador. Se obtuvo de dos zonas geográficas particulares que son la provincia de Los Ríos y la provincia de Pastaza. La provincia de Los Ríos se encuentra en la región litoral o costa, sus suelos están ubicados desde los 280 a los 80 metros sobre el nivel del mar, cuentan con un clima tropical megatérmico húmedo o muy húmedo, con precipitaciones desde los 1000 hasta los 3000 mm al año.29 Por otro lado, la provincia de Pastaza se encuentra en la región oriente o amazónica. Se caracteriza por una clima tropical con una altitud entre los 823 y los 1,086 metros sobre el nivel del mar; y con precipitaciones anuales de 3,481 mm.30 Otra limitación es que el efecto antimicrobiano se basó en un modelo in vitro, el cual no representa las condiciones in vivo. Por lo tanto, para una comprensión del efecto antimicrobiano del aceite esencial de la hierbaluisa ecuatoriana se recomienda realizar otros estudios que obtengan el aceite esencial, cuyo análisis cromatográfico identifique el citral en una mayor concentración y analizar su efecto en los microorganismos patógenos de cavidad bucal.
El aceite de hierbaluisa procedente de la costa y el oriente ecuatoriano mostró en sus componentes principales el geraniol y el citral. Al parecer, el menor porcentaje de citral obtenido en nuestro estudio se relaciona con la escasa actividad antimicrobiana sobre la P. gingivalis, E. faecalis ni C. albicans. El aceite de hierbaluisa demostró que puede ser usado potencialmente en el desarrollo de un medicamento que controle las infecciones por S. aureus.