Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515versión On-line ISSN 1561-2988
Rev Cubana Farm v.31 n.2 Ciudad de la Habana ene.-ago. 1997
Productos Naturales
Centro de Investigación y Desarrollo de MedicamentosEstudio toxicológico de un producto derivado de la caña de azúcar
Carmen Luisa García Rivero,1 Viviana Bueno Pavón,2 Gastón García Simón 3 y Juana Tillán Capó42 Médico Veterinario. Especialista en Animales de Experimentación.
3 Licenciado en Ciencias Biológicas. Especialista en Control Biológico de la Calidad.
4 Doctora en Ciencias Veterinarias. Investigadora Auxiliar.
RESUMEN
Se presentan los resultados obtenidos en la evaluación toxicológica preclínica de un principio activo formulado en crema con propiedades cicatrizantes y antifúngicas a partir de un producto natural derivado de la caña de azúcar, al cual se le determinó su inocuidad en animales de experimentación mediante la estimación de la dosis letal media en conejos F1 y ratas albinas Wistar, utilizando niveles de dosis elevados. También se estudió el potencial irritante sobre la piel, mucosa ocular, vaginal y rectal, así como su potencial como agente sensibilizante. De forma general los síntomas tóxicos observados no fueron significativos y desaparecieron en un período corto, no se presentó mortalidad y se comprobó la ausencia de efectos irritantes sobre la piel y mucosas evaluadas. Se demostró que el producto no es un agente sensibilizante. Los resultados obtenidos en el estudio realizado permiten clasificar al producto de una baja toxicidad.Descriptores DeCS: CERAS/toxicidad; POMADAS/toxicidad; CONJUNTIVA/efectos de drogas; VAGINA/efectos de drogas; PIEL/efectos de drogas; RECTO/efectos de drogas; SELECCION DE MEDICAMENTOS; CONEJOS; RATAS; GRAMAS.
Aunque el avance de la medicina moderna con su diversidad de formas farmacéuticas ha revolucionado prácticamente la cura o prevención de las innumerables afecciones humanas, el uso de sustancias biológicas procedentes de fuentes naturales mantiene su vitalidad y cobra cada vez mayor importancia en la época actual. Por este motivo se están realizando numerosas investigaciones dirigidas a la búsqueda de nuevos compuestos en este campo.1
Los científicos cubanos y la Industria Farmacéutica trabajan arduamente por incrementar el número de productos para la terapéutica nacional, con una probada eficacia clínica que satisfaga la demanda actual de medicamentos.
Un ejemplo de esto es la cera de caña, la cual es obtenida como subproducto en el proceso de elaboración del azúcar. El extracto etanólico de esta cera (EEC), fracción de mayor actividad, posee propiedades cicatrizantes y antifúngicas, lo cual fue demostrado en estudios recientes (Tillán J. Efecto cicatrizante del aceite de cachaza y del EEC. Laboratorio Investigaciones Biológicas, La Habana, 1992).
La seguridad de estos principios activos novedosos es de vital importancia para su posterior uso en la clínica, por lo que en el presente trabajo nos proponemos realizar algunos de estos ensayos toxicológicos que avalen la inocuidad de este principio activo.
MÉTODOS
Material de ensayo
El extracto etanólico de la cera de caña es la fracción soluble de esta cera en etanol a su temperatura de ebullición. Los componentes que más predominan en ella son: hidrocarburos, ésteres, fitosteroles, ácidos, alcoholes y resinas. Se presenta como un sólido verde-amarilloso de aspecto céreo.Para la realización de los diferentes ensayos se utilizó materia prima del extracto etanólico de cera lote 1, elaborado por la Empresa Farmacéutica "Mario Muñoz" perteneciente a la Industria Médico Farmacéutica y una crema al 5 % elaborada por el Departamento de Formas Terminadas del Centro de Investigación y Desarrollo de Medicamentos (CIDEM).
Irritabilidad en piel y membranas mucosas
Para determinar el potencial irritante sobre la piel y membranas mucosas se siguieron los métodos descritos en la Norma Internacional ISO-10993.2Irritabilidad dérmica
Se utilizaron conejos F1 albinos machos con una masa corporal entre 2,5 y 3 kg, mantenidos en jaulas individuales con condiciones ambientales estándar de laboratorio. Estos fueron seleccionados sobre la base de una piel sana e intacta.
Para la evaluación del material se utilizaron 6 conejos los cuales fueron depilados aproximadamente 24 h antes del ensayo en la parte dorsal del tronco. Se aplicó 0,5 g del principio activo en cada sitio de ensayo, el cual es cubierto con un parche de gasa porosa de aproximadamente 25 x 25 mm y sostenido por una cinta adhesiva durante 4 h. Al finalizar este período, el parche fue retirado lavando cada zona con agua destilada, este sitio se marcó para las posteriores observaciones, las que se realizaron a las 4, 24 y 48 h posteriores al retiro del parche. El grado de irritación se determinó de acuerdo con el sistema de clasificación de la escala de Draize,3 basado en la aparición de edema y eritema observados en cada sitio de aplicación.
Irritabilidad oftálmica4
Se utilizaron conejos F1 albinos machos con una masa corporal comprendida entre 2,5 y 3 kg, mantenidos con las mismas condiciones de laboratorio que en el experimento anterior.
El material fue evaluado utilizando 6 conejos, los cuales fueron previamente seleccionados (24 h antes) mediante un examen ocular con lámpara de luz ultra-violeta.
El principio activo se aplicó en el saco conjuntival del ojo derecho de cada animal en una cantidad de 0,1 g; el ojo izquierdo se tomó como control. Ambos ojos de cada animal se observaron a las 1, 2, 4, 24, 48 y 72 h posteriores a la aplicación del medicamento.
Irritabilidad vaginal
Se utilizaron conejos albinos híbridos F1 hembras vírgenes con peso corporal entre 2 y 2,5 kg procedentes del CENPALAB. Se confeccionaron grupos de 6 animales cada uno estructurados de la forma siguiente:
Grupo 2: tratado con el vehículo (excipiente utilizado en la preparación de la crema).
Grupo 3: control sin tratamiento.
La muestra se preparó al 50 % a partir de la sustancia sólida formando una pasta después de la maceración con el vehículo. Una jeringuilla con un catéter previamente lubricado con jalea hidrosoluble se introdujo en la vulva vaginal con 2 mL de la muestra de ensayo a una profundidad de 90-120 mm y luego se retiró lentamente. Este tratamiento se repitió durante 5 d consecutivos. Al día siguiente del último tratamiento los animales fueron sacrificados mediante inyección letal en la vena marginal de la oreja. La vagina de cada animal se extrajo realizándole un corte longitudinal. Seguidamente se fijó en formalina al 10 % durante una semana. Al concluir este período, 3 secciones de cada vagina fueron embebidas en parafina y teñidas con hematoxilina eosina para el examen histopatológico.
El grado de irritación se determinó de acuerdo con los indicadores siguientes: exfoliación epitelial, infiltración de leucocitos, congestión vascular y edema.5,6
Irritabilidad rectal
Se utilizaron conejos albinos híbridos F1 machos con masa corporal entre 2 y 2,5 kg procedentes del CENPALAB. Se confeccionaron grupos con 6 animales cada uno distribuidos de la forma siguiente:
Grupo 2: tratado con el vehículo.
Grupo 3: control sin tratamiento.
Toxicidad aguda dérmica
Especie roedora.7,8 Se utilizaron ratas albinas de uno y otro sexos procedentes de la colonia del Laboratorio de Investigaciones Biológicas con una masa corporal comprendida entre 200 y 300 g, los cuales fueron mantenidos en condiciones estándar de laboratorio.Para cada grupo se seleccionaron 5 animales de cada sexo mantenidos individualmente en jaulas de makrolón identificados individualmente mediante un sistema de marcaje con ácido pícrico.
Veinticuatro horas antes del experimento cada animal fue rasurado en el área dorsal del tronco, aproximadamente el 10 % de la superficie corporal total (4 x 5 cm), y posteriormente afeitado con una máquina convencional. La sustancia sólida fue pesada y macerada con el vehículo en la proporción 1:1.
El producto se administró en dosis única, se aplicó uniformemente en el área depilada a la dosis de 2 000 y 5 000 mg/kg de peso corporal, y se mantuvo en contacto con la piel utilizando un parche de gasa porosa y cubriéndolo posteriormente con una cinta adhesiva hipoalergizante durante 24 h. Al final del período de exposición los residuos se eliminaron utilizando agua destilada como solvente. La observación se realizó de forma minuciosa durante las primeras 24 h, y se continuó con una observación diaria hasta concluir un período de 14 d. Se registraron los signos clínicos como aparición del pelo, daño en la piel, ojos, mucosas, sistema circulatorio, respiratorio y nervioso central, así como actividades somatomotoras y de comportamiento. El peso corporal se registró al inicio, a los 7 d y al final del experimento, donde los animales fueron sacrificados mediante tracción de la nuca para la realización de la autopsia, realizando un examen macroscópico minucioso de todos los órganos y tejidos.
Especie no roedora.7,8 Se realizó en conejos albinos híbridos F1 de uno y otro sexos procedentes del CENPALAB, con una masa corporal comprendida entre 2 y 2,5 kg, los cuales fueron mantenidos en condiciones estándar de laboratorio y aclimatados a las condiciones de éste durante una semana.
La preparación de la muestra, los animales para el ensayo, así como el método y procedimiento experimental se realizaron de igual forma que en el experimento anterior. En este caso sólo se empleó un nivel de dosis (5 000 mg/kg).
Sensibilización2,9,10
Para conocer si el principio activo era un agente sensibilizante se empleó el método descrito en la Norma Internacional ISO 10993.6 Se utilizaron curieles de peso corporal entre 300 y 400 g mantenidos en condiciones estándar de laboratorio con libre acceso al alimento y al agua.Antes de iniciar el ensayo se realizó un examen físico de manera tal que cualquier animal que mostrara alguna reacción se excluyera de éste. Se utilizaron 10 animales de cada sexo para la aplicación de la muestra y 5 hembras y 5 machos para el grupo control.
Veinticuatro horas antes de iniciar el experimento los animales fueron depilados en un área dorsal de 4 x 6 cm2. El ensayo consistió en la aplicación de 0,5 g de la muestra (crema de extracto etanólico al 5 %) en el dorso izquierdo cubierto con una gasa estéril y una cinta adhesiva durante un período de 48 h (etapa de inducción). En los animales del grupo control se aplicó el vehículo de esta crema de igual forma. En la zona dorsal derecha se inyectó por vía intradérmica 0,1 mL de adyuvante completo de Freund, diluido al 50 % en cloruro de sodio al 0,9 %.
Cada 48 h se retira el parche, se observa la zona y se vuelve a aplicar la muestra y el vehículo hasta completar un total de 7 aplicaciones, durante esta etapa los animales deben ser depilados semanalmente. A partir de la retirada del último parche se le permite al animal descansar por un período de 12 d. Al decimotercer día comienza la etapa de desafío donde los animales son nuevamente depilados para su aplicación después de 24 horas. La muestra es aplicada cubriéndose con un parche oclusivo en una zona diferente a la utilizada en el período de inducción (parte inferior del dorso izquierdo), pasado 48 h se retira el parche y se procede a lavar la zona con cloruro de sodio al 0,9 % o agua estéril, evaluando la formación de edema y eritema a las 1, 6, 24 y 48 h.
El criterio mínimo de una reacción alérgica es el enrojecimiento. Las reacciones pueden ser clasificadas de acuerdo con la escala siguiente:
- No reacción 0
- Enrojecimiento ligero-difuso 1
- Enrojecimiento moderado 2
- Enrojecimiento e inflamación 3
Potencial de sensibilización
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
ANÁLISIS DE LOS RESULTADOS
Irritabilidad dérmicaNo se observaron signos de irritación; se obtuvo un índice de irritación primaria de 0,0.
Irritabilidad oftálmica
En las primeras lecturas realizadas se observaron ligeras alteraciones en las estructuras evaluadas, las cuales disminuyeron en el transcurso del ensayo. El grado de respuesta obtenido según el sistema de clasificación utilizado fue de 3,0, el cual enmarca al producto como no irritante y de acuerdo con la clasificación es aceptado para su utilización clínica (E<20).
Irritabilidad vaginal
El grado de respuesta obtenido para cada grupo de ensayo se presenta en la tabla 1. Nótese que los valores promedio para todos los grupos experimentales fueron bajos.
| Tratamiento | | |
| Grupo control | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| Valor promedio | | |
| Tratado con el vehículo | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| Valor promedio tratado con EEC | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| Valor promedio | |
El índice de irritación obtenido para el grupo tratado con el vehículo fue de 0,83 y para el grupo tratado con el EEC fue de 0,33, lo cual enmarca al producto evaluado en el primer estadio de clasificación (no irritante), según la tabla que norma este tipo de ensayo.
Irritabilidad rectal
Según el resultado histológico del recto de conejos para cada grupo de ensayo, el EEC administrado a la mucosa rectal no produjo efectos irritantes, al obtener un valor promedio bajo (0,16) en la evaluación microscópica (tabla 2).
| Tratamiento | | |
| Grupo control | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| Valor promedio | | |
| Tratado con el | | |
| vehículo | | |
| | | |
| | | |
| | | |
| | | |
| Valor promedio | | |
| Tratado con EEC | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| Valor promedio | |
El índice de irritación rectal alcanzado fue de cero para el vehículo y 0,16 para el grupo tratado con el EEC, lo cual clasifica al producto como no irritante.
Toxicidad aguda dérmica
Especie roedora. No se produjo mortalidad en las ratas tratadas por vía dérmica en ninguna de las dosis evaluadas al transcurrir 15 d de observación. Los signos clínicos manifestados consistieron en ligera sedación e inmovilidad a la dosis de 2 000 mg/kg y sedación e inmovilidad, respiración acelerada y ojos semicerrados a la dosis de 5 000 mg/kg. Estos síntomas desaparecieron rápidamente durante las primeras 24 h.
En la figura 1 se presentan los valores medios de peso corporal (g) obtenidos en uno y otro sexos; en ésta se observa que no hubo decremento de peso corporal en ninguno de los grupos experimentales.
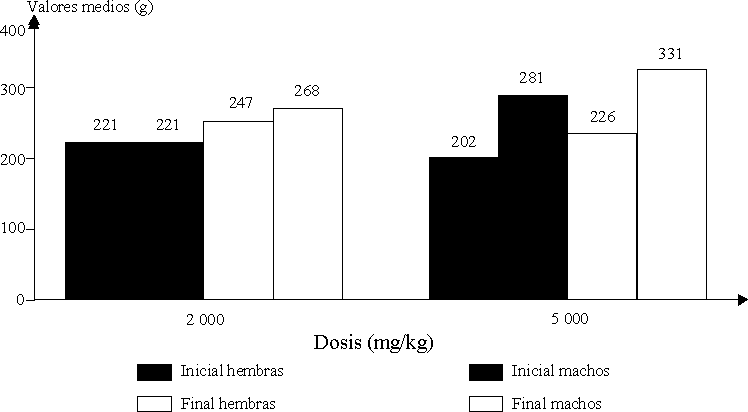
El sitio de aplicación no manifestó ningún síntoma tóxico de irritación. El examen macroscópico realizado a los diferentes órganos y tejidos de todos los animales tratados no presentaron alteraciones.
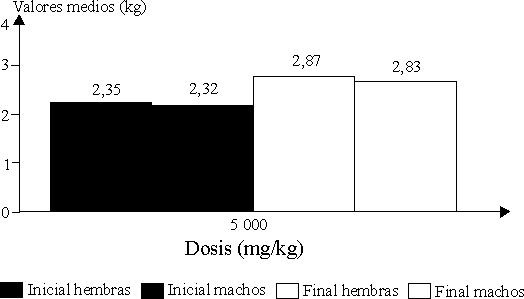
Especie no roedora. No se encontró mortalidad a la dosis evaluada durante el período de ensayo; los signos clínicos tóxicos observados fueron leves (sedación, ojos semicerrados) y desaparecieron en un corto período (4 d).
En esta especie tampoco se afectó el peso corporal como indicativo de la toxicidad; los valores medios (g) para cada grupo de ensayo en uno y otro sexos se indican en la figura 2. Ningún animal de los grupos de ensayo presentó alteraciones macroscópicas en los distintos órganos y tejidos al realizarle la autopsia.
Sensibilización
Ningún animal mostró a la observación macroscópica reacción de sensibilización, por lo que se obtuvo una evaluación de 0.
De forma general, los diferentes ensayos realizados para evaluar los efectos tóxicos locales y sistémicos del extracto etanólico de cera demostraron la inocuidad de este principio activo.
El ensayo de irritabilidad conducido para examinar el efecto sobre las diferentes mucosas demostraron la ausencia de efectos irritantes que sobre estas membranas provoca el EEC.
Pudo comprobarse que la toxicidad aguda del EEC utilizando la vía dérmica de administración es baja al no presentarse letalidad a dosis elevadas, lo que imposibilita estimar la dosis letal media. Tampoco se observaron síntomas clínicos de intoxicación significativos en las especies evaluadas. Las afectaciones del sistema nervioso central, como sedación e inmovilidad, pueden deberse al alcohol presente en la formulación, el cual se conoce que provoca estos efectos.11 El estudio anatomopatológico tampoco evidenció alteraciones en los tejidos y órganos examinados. La ausencia de reacciones de sensibilización demostraron que el producto no es un agente sensibilizante.
Basándonos en las investigaciones realizadas podemos inferir que el EEC es un producto inocuo desde el punto de vista agudo, lo cual se ha podido evaluar en 2 especies. Los datos de la literatura apuntan hacia estos resultados ya que estudios similares realizados con el extracto etanólico de la cera de turba, compuesto que posee composición y propiedades químicas muy parecidas al nuestro, avalan la inocuidad de este preparado en el organismo humano y en animales de experimentación (Belkevich P T. Conclusiones sobre la inocuidad del preparado. Instituto de la Turba, 1987).
SUMMARY
This paper reports on the results obtained from the preclinical toxicity assessment of an active ingredient formulated as a cream having healing and antifungal properties which was obtained from a natural product derived from sugar cane. The drug testing included the determination of its safety in experimental animals by the estimation of the mean lethal dose in rabbits F1 and albino Wistar rats using high dose levels. The potential irritancy on the skin, ophthalmic, vaginal and rectal mucosa was also studied, as well as the potential as a sensibilizing agent. Overall, the toxic symptoms observed were found to be no significant and they dissapeared within a short period of time. There was no mortality and the absence of irritant effects on the skin and mucosa was evidenced in the evaluation. It was proved that this product is not a sensibilizing agent. Results obtained from the study carried out allow to classify this product as having low toxicity levels.Subject headings: WAXES/toxicity; OINTMENTS/toxicity; CONCJUNCTIVA/drug effects; VAGINA/drug effects; SKIN/drug effects; RECTUM/drug effects; DRUG SCREENING; RABBITS; RATS, GRASSES.
REFERENCIAS BIBLIOGRÁFICAS
- Lishtvan I, Belkevich P, Dolidovich E, Sherenment L. Medical Properties of Peat. Int Peat J 1989,2:163-78.
- International Organization for Standardization. Draft International Standard, ISO/Dic. 10993-10. Biological Evaluation of Medical Devices. 5,44,47. 1992.
- Draize J, Geoffrey W, Herbert C. Methods for the study of irritation and toxicity of substances applied topically to the skin and mucous membranes. J Pharm Expt Ther 1994;82:377.
- García G. Elaboración de una metodología para la evaluación de la irritabilidad oftálmica. Rev Cubana Farm 1988;22:5-24.
- Eckstein P. Comparison of the vaginal tolerance tests of spermicidal preparations in rabbits and monkeys. J Reprod Fert 1969;20:85-93.
- Kaminsky M. Ph and the potencial irritancy of douche formulations to the vaginal mucouse of the albino rabbit and rat. Food Chem Toxic 1981;20:193-6.
- Speid H, Lumber C, Walker R. Harmonization of guidelines for toxicity testing of pharmaceuticals by 1992. Toxicol Pharmacol 1990;12(2):181-2.
- República de Cuba. Ministerio de Salud Pública. Buenas Prácticas de Laboratorio y Garantía de la Calidad en ensayos toxicológicos. Ciudad de La Habana: Editorial Ciencias Médicas, 1993,3-5.
- Magnusson B, Kligman AM. In contact and Photocontact Allergens. Maurer, E Marcel Dekker Inc. New York and Basel, T. New York, 1983: 92.
- Draize JH. Dermal Toxicity. In Appraisal of the safety of chemicals and foods. Drugs and cosmetic. Association of Food and Drugs Officials of the United States, Austin Texas. 1959:49-53.
- Goodman S, Gilman A. Las bases farmacológicas de la terapéutica. 7 ed. Edición Médica Panamericana. Herschel 153/México 5 D.F. 1989: 364-65.
Lic. Carmen Luisa García Rivero. Calle 3ra No. 15135 entre 10 y Río, Reparto Mañana, municipio Guanabacoa, La Habana, Cuba.














