Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.31 n.2 Ciudad de la Habana ene.-ago. 1997
Artículo de Revisión
Centro de química farmacéutica tiazolidinadionas: una nueva familia de hipoglicemiantes orales
Zalua Rodríguez Riera,1 Lisbet Xuárez Marill2 y Carlota A. Fernández Falcón32 Máster en Química. Aspirante a Investigadora.
3 Licenciada en Información Científica y Bibliotecología.
RESUMEN
A partir de un estudio de la literatura más actualizada se presenta una revisión bibliográfica de una nueva serie de compuestos conocidos como tiazolidinadionas. Se consultaron las bases de datos Medline (1989-8/96), Excerpta Medica (1990-7/96), Predicast (1992-6/96), Medical Research Division (1991) y Life Science (1993-95). Se resumen los resultados obtenidos en los estudios preclínicos y clínicos de los derivados de esta familia conocidos hasta el momento.Descriptores DeCS: TIAZOLES/farmacología; INSULINA/fisiología; HIPERGLICEMIA/fisiopatología; HIPERINSULINISMO/fisiopatología; HIPERTRIGLICERIDEMIA/fisiopatología; DIABETES MELLITUS NO INSULINO DEPENDIENTE; TEST DE TOLERANCIA A LA GLUCOSA; MODELOS ANIMALES DE ENFERMEDAD.
La diabetes mellitus no insulino-dependiente o tipo II se caracteriza por la secreción irregular de insulina desde el páncreas y por la insulino-resistencia que se manifiesta cuando los tejidos se hacen resistentes a la acción de la insulina, lo que provoca un incremento de glucosa en sangre. El control de la enfermedad se logra mediante ejercicios físicos, dietas alimenticias y el uso de los hipoglicemiantes orales.1
Los hipoglicemiantes orales son medicamentos que disminuyen la cantidad de glucosa en sangre. No son iguales a la insulina, ni la pueden sustituir, tampoco curan la diabetes pero tienen la ventaja que se pueden ingerir, porque a diferencia de la insulina no se destruyen en el tracto gastrointestinal.1
En la actualidad se estudian muchas moléculas por su acción hipoglicemiante diferente a las sulfonilureas y biguanidas, éstas son heterogéneas tanto en su estructura química como en su mecanismo de acción y pueden clasificarse, según Presti,2 en 3 grandes grupos:
- Las que interfieren en la digestión y absorción de los carbohidratos.
- Las que son activas sobre el páncreas endocrino tanto en las células b como en otros tipos de células.
- Las que actúan a nivel extrapancreático porque incrementan la acción de la insulina sin estimular su secreción en el páncreas.
El objetivo de este trabajo es presentar una revisión bibliográfica sobre los derivados de las tiazolidinadionas, conocidos hasta el momento. Se resumen los resultados obtenidos en los estudios preclínicos y clínicos de estos compuestos. Para ello se consultaron las bases de datos Medline (1989-8/96), Excerpta Medica (1990-7/96), Predicast (1992-6/96), Medical Research Division (1991) y Life Science (1993-95).
DERIVADOS DE LAS TIAZOLIDINADIONAS
En 1982, Shoda4 y otros, reportaron una serie de derivados de las tiazolidinadionas como nuevos agentes antidiabéticos que fueron efectivos en la reducción de la insulino-resistencia e incrementaron la acción de la insulina en animales diabéticos. El prototipo de esta familia es la ciglitazona (inicialmente conocida por ADD-3878 ó U-63,287), que en modelos de animales no insulino-resistentes normalizó la hiperglicemia, la hiperinsulinemia y la hipertrigliceridemia.5A partir de este momento se comenzó a trabajar en la síntesis y el estudio biológico de una serie de análogos estructurales de la ciglitazona, tales como: la pioglitazona (AD-4833 ó U-72,107), troglitazona (CS-045) y la englitazona (CP-68722).
Algunas de las características y propiedades farmacológicas de estos compuestos son:
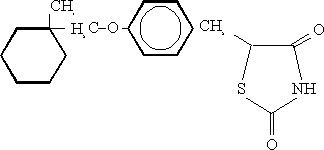
CIGLITAZONA
(+/-)5-[4-(1-metilciclohexilmetoxi) bencil]2,4 tiazo-lidinadiona
Los estudios preclínicos de la ciglitazona (figura 1) en animales diabéticos tipo II comprobaron que mejoraba la tolerancia a la glucosa y disminuía la secreción de insulina.6,7 Su mecanismo de acción no se ha definido. Los estudios en el tejido adiposo y en el músculo esqueletal demostraron que mejoraba la sensibilidad o respuesta de los tejidos a la acción de la insulina.8-10 Este mismo efecto se comprobó en modelos de animales insulino-resistentes.11 Cuando se realizaron los estudios clínicos con dosis de 125 mg en pacientes con diabetes mellitus no insulino-dependiente se logró una rápida disminución de los niveles de glucosa y triglicéridos.12,13 Por esos resultados se expandió en Japón hasta la fase II aplicando dosis entre 30 y 500 mg, pero no se obtuvo una buena respuesta en la disminución de triglicéridos por lo que su desarrollo fue descontinuado.14
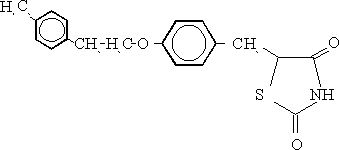
PIOGLITAZONA
(+/-)-5-{4-[2-(5-etil-2-piridinil)etoxi]bencil}2,4 tia-zolidinadiona
En 1990, Shoda15 realizó un estudio de relación estructura-actividad biológica de una serie de compuestos donde el fragmento de 1-metilciclohexilmetoxi de la ciglitazona fue sustituido por uno de 2-piridiniletoxi, que con respecto a la actividad hipoglicémica e hipolipidémica fue aproximadamente de 5 a 10 veces más potente que la ciglitazona. De todos los compuestos estudiados se seleccionó la pioglitazona (figura 2) por ofrecer también una buena respuesta en animales insulino-resistentes.
A partir del estudio de relación estructura-actividad biológica de la pioglitazona y sus derivados se pudo concluir que la presencia del anillo piridinil, enlazado a la cadena alcoxi que está unida al anillo bencénico en su estructura, potencia la actividad biológica. Particularmente la presencia de un átomo de nitrógeno en posición alfa con respecto a la cadena oxietil juega un papel importante en esta actividad.15
En 1991, Momose16 publicó su síntesis química y el estudio de la actividad biológica en modelos de animales diabéticos tipo II. La patente pertenece a la compañía Takeda-Upjon de Japón.17 La acción de este compuesto disminuye la concentración de glucosa, triglicéridos e insulina circulante y mejora la tolerancia a la glucosa en modelos de animales con insulino-resistencia por un incremento de la sensibilidad de los tejidos a la insulina.18-20 Esto se origina por el aumento de la actividad de la tirosinkinasa, que actúa como mediador de la unión de la insulina al receptor.21,22
Actualmente los estudios biológicos están dirigidos a demostrar el efecto regulador de este compuesto sobre los transportadores de glucosa, que constituye un indicador de su eficacia para el tratamiento de la diabetes mellitus no insulino-dependiente.23,24
Además, se estudia su efecto hipotensor porque se conoce que diferentes entidades químicas que actúan como sensibilizadores de insulina disminuyen la hipertensión, que está frecuentemente asociada con la insulino-resistencia.25-27
Shoda28 logró sintetizar en 1995 el metabolito de la pioglitazona, lo que permitió comprobar su estructura y estudiar sus propiedades farmacológicas.
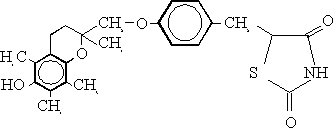
TROGLITAZONA
(+/-)-5-[4-(6-hidroxi-2,5,7,8-tetrametilcroman-2-ilme-toxi)bencil]2,4 tiazolidinadiona
La troglitazona (figura 3) fue desarrollada por Yoshioka29 y patentada por la compañía Sankyo de Japón en 1991.30 Este compuesto disminuye la concentración de glucosa, insulina y el nivel de triglicéridos en sangre en modelos de animales diabéticos insulino-resistentes.31,32 Además provoca una disminución de la peroxidación lipídica que es una de las causas del surgimiento de la macro y microangiopatía diabética.29
El estudio clínico fase I en Japón se realizó en 204 pacientes con diabetes mellitus no insulino-dependiente. De ellos, 73 recibieron una dosis diaria de 200 mg y 131 de 400 mg. Como resultado se comprobó que este compuesto ejerce un efecto hipoglicémico-dosis dependiente, siendo la dosis de 400 mg la más efectiva. Además se demostró que es más efectivo en los pacientes diabéticos con una alta insulino-resistencia (obesos).33 Posteriormente la fase III de estudios clínicos demostró que en los pacientes con diabetes tipo II se mejora la tolerancia a la glucosa sin estimular la secreción de insulina desde el páncreas, es decir, mediante efectos extrapancreáticos.34
Los resultados obtenidos en el estudio clínico confirmaron que la troglitazona provoca un aumento de la sensibilidad de los tejidos a la insulina. Esta hipótesis fue confirmada con el resultado de su efecto sobre la insulino-resistencia y las anormalidades metabólicas, surgidas en pacientes diabéticos no insulino-dependientes.35
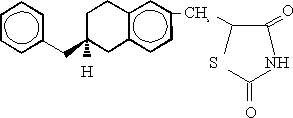
ENGLITAZONA
(+/-)-5-[3,4 dihidro-2-fenilmetil-2H-1-benzopiran-6-il)metil 2,4 tiazolidinadiona
Este compuesto (figura 4) fue sintetizado por Clark en 1990 (Clark DA, Goldstein SW, Hulin B, Volkman RA, Eggler JF, Holland GF, et al. Synthesis and SAR of substituted dihydrobenzopyran and dihydrobenzofuran thiazolidine-2,4-diones for hypoglycemic activity. 199th American Chemical Society Meeting, Boston, MA, April 1990).36 El estudio de su actividad biológica en animales diabéticos tipo II demostró que tienen un efecto hipoglicemiante superior a la ciglitazona, y que al igual que las anteriores aumenta la acción de la insulina y mejora la insulino-resistencia.37 Además tiene una actividad insulinomimética in vitro con respecto a la estimulación de los transportadores de glucosa.38
Otros nuevos derivados de esta familia se han sintetizado recientemente y se encuentran en la etapa de estudios preclínicos, tales como: (+/-)-5-{[4-[2-(metil-2-piridilamino) etoxi] fenil] metil} 2,4 tiazolidinadiona (BRL 49653),39,40 (+/-)-5-{4-[2-(5-metil-2-fenil-4-oxazolil) etoxi]bencil} 2,4 tiazolidinadiona (BM 13.1246) y (+/-)-5-{4-[2-(5-metil-2-fenil-4-oxazolil) etoxi] naftalil}metil 2,4 tiazolidinadiona (BM 50.1050).41
CONSIDERACIONES FINALES
Las tiazolidinadionas es una nueva familia de hipoglicemiantes orales, conocida como sensibilizadores de insulina, ya que su acción farmacológica está dirigida a mejorar la acción de la insulina mediante mecanismos extrapancreáticos. Con estos compuestos se logra disminuir la hiperglicemia y la insulino-resistencia en los pacientes diabéticos no insulino-dependientes. Por ello la investigación y desarrollo en este campo con vistas a lograr nuevos derivados con una mayor efectividad y un menor número de efectos colaterales, constituye actualmente uno de los objetivos principales de varias compañías farmacéuticas. Consideramos que este trabajo pueda motivar a diferentes especialistas de la salud, vinculados con esta temática, a profundizar en el estudio y aplicación de dichos compuestos.SUMMARY
A bibliographic review of a new series of compunds known as thiazolidinediones is made from a study of the most current and up-dated literature. Databases such as MEDLINE (1989-8/96), Excerpta Medica (1990-7/96), Predicast (1992-6/96), Medical Research Division (1991) and Life Science (1993-95) were consulted. Results obtained from preclinical and clinical trials of the derivates of this family known up to the present, are reported.Subject headings: THIAZOLES/pharmacology; INSULIN/physiology; HY-PERGLYCEMIA/physiopathology; HYPERINSULINISM/physiopathology; HYPERTRIGLICERIDEMIA/physiopathology; DIABETES MELLITUS; NON-INSULIN-DEPENDENT; GLUCOSE TOLERANCE TEST; DISEASE MODELS, ANIMALS.
REFERENCIAS BIBLIOGRÁFICAS
- Gerich JE. Oral hypoglycemic agents. New Engl J Med 1989;321(18):1231-45.
- Lo Presti R, D'Asaro S, Caimi G. Nuovi ipoglicemizzanti orali. Diabetol 1989;9:363-74.
- Lefebvre PJ, Scheen AJ. Improving the action of insulin. Clin Inv Med 1995;18(4):340-7.
- Sohda T, Mizuno K, Tawada H, Sugiyama Y, Fujita T, Kawamatsu Y. Studies on antidiabetic agents I. Synthesis fo 5-[4-(2-methyl-2-phenylpropoxy)-benzyl] thiazolidine-2,4-dione (AL-321) and related compounds. Chem Pharm Bull 1982;30:3563-73.
- Sohda T, Mizuno K, Tawada H, Sugiyama Y, Fujita T, Kawamatsu Y. Studies on antidiabetic agents II. Synthesis of 5-4-1 (methylcylohexylmethoxy) benzyl thiazolidinne-2,4-dione ADD-3878 and its derivatives. Chem Pharm Bull 1982;30:3580-600.
- Fujita T, Suguyama S, Shoda T. Reduction of insulin resistance in obese and-or diabetic animals by (ADD-3878, ciglitazone). A new antidiabetic agent. Diabetes 1983;32:804-10.
- Colca JR, Morton DR. Antihyperglicaemic thiazolidinediones: Ciglitazone and its analogues. En: Bailet CJ, Flatt PR, eds. New antidiabetic drugs. Smith-Gordon, 1990;255-61.
- Chang AY, Wyse BM, Gilchrist BJ. Ciglitazone, a new hypoglycemic agent II. Effect on glucose and lipid metabolisms and insulin binding in the adipose tissues C57BL/6J ob/ob and /+? mice. Diabetes 1983;32:839.
- Mercer SW, Trayhurn P. Effects of ciglitazone on insulin resistance and termogenic responsiveness to acute cold in brown adipose tissue of genetically obese (ob/ob)mice.FEBS Lett 1986;195:12.
- Shargill NS, Tatoyan A, Fukushima M, Antui D, Bray GA, Chan TM. Effects of ciglitazone on glucose uptake and insulin sensitivity in skeletal muscle of the obese mouse: Distinct insulin and glucoconicoid effects. Metabolism 1986;35:64.
- Kraegen EW, James DE, Lenkins AB, Chisholm DJ, Storlien LH. A potent in vivo effect of ciglitazone on muscle insulin resistance induced by high fat feeding in rats. Metabolism 1989;38:1089.
- Doi K. Application of AD-3878 to treatment of diabetes. Tohnyobo 1982;25:397.
- Baba S, Doi K, Matsuura M, Kawara A, Tanaka T, Ooe M. New antidiabetic agent AD 3878. Diabetes 1982;31 (Suppl 2):77A.
- Doi K. New orally active hypoglicemic agent. Nippon Rinshio 1986;44(Summer Extra Suppl):47.
- Sohda T, Momose Y, Meguro K, Kawamatsu Y, Sugiyama Y, Ikeda H. A new antidiabetic agent, AD 4833, and structure-activity relation-ship of 5-[4-pyridyalkoxy) benzyl]-2,4-thiazolidinedione. Arzneim- -Forsch/drug Res 1990;40:37-43.
- Momose Y, Meguro K, Ikeda H, Hatanaka C, Oi S, Shoda T. Studies on antidiabetic agents. X. Synthesis and biological activities of plioglitazone and related compounds. Chem Pharm Bull 1991;39(6):1440-5.
- Meguro K, Fujita T. Takeda Chemical Industires LTD, Thiazolidinedione derivatives, useful as antidiabetic agents. US patent 4687777 August 18.
- Sugiyama Y, Taketomi S, Shimura Y, Ikeda H, Fujita T. Effects of pioglitazote on glucose and lipid metabolism in Wistar fatty rats. Arzneim-Forsch 1990;40:263-7.
- Sugiyama Y, Shimura Y, Ikeda H. Effects of pioglitazone on hepatic and peripheral insulin resistance in Wistar fatty rats. Arzneim-Forsch 1990;40:436-40.
- Hofmann C, Lorentz K, Williams D, Palazuk BJ, Colca JR. Insulin sensitization in diabetic rat liver by an antihyperglycemic agent. Metabolism 1995;44(3):384-9.
- Kobayashi M,Iwanishi M, Egawa K. Pioglitazone increases insulin sensitivity by activating kinase of insulin receptors. Diabetes 1992;41:476-83.
- Iwanishi M, Kobayashi M. Effect of pioglitazone on insulin receptors of skeletal muscles from high-fat-fed rats. Metabolism 1993;42(8):1017-21.
- El-Kebi IM, Roser S, Pollet RJ. Regulation of glucose transport by pioglitazone in cultured muscle cells. Metabolism 1994;43(8):953-8.
- Hirshaman MF, Fagnat PM, Horton ED, King PA, Horton ES. Pioglitazone treatment for 7 days failed to correct the defect in glucose transport and glucose transporter translocation in obese Zucker rat 9(fa/fa)skeletal muscle plasma membranes. Biochem Biophys Rescom 1995;208(2):835-45.
- Zhan HY, Reddy SR, Kotchen TA. Antihypertensive effect of piopglitazone is not invariably associated with increased insulin sensitivy. Hypertension 1994;24(1):106-10.
- Kaufman LN, Peterson MN, De Grange LM. Pioglitazone attenuates diet-induced hypertension in rats. Metabolism 1995;44(9):1105-9.
- Buchanan TA, Meehan WP, Jeng YY, Yang D, Chan TM, Nadler JL. Blood pressure lowering by pioglitazone. Evidence for a direct vascular effect. J Clin Invest 1995;96(1):354-60.
- Shoda T, Ikeda H, Meguro K. Studies on antidiabetic agents. XII. Synthesis and activity of the metabolites of (+/-)-5-(p-[2-(ethyl-2-piyridyl)ethoxy]bencyl)-2,4-thiazolidinedione (pioglitazone). Chem Pharm bull 1995;43(12):2168-72.
- Yoshiola T,Fujita T, Kanai T, Aizawa Y, Kurumunda T, Hasegawa K. Studies on hindered phenols and analogues. 1. Hypolipidemic and hypoglycemic agent with ability to inhibit lipid peroxidation. J Med Chem 1989;32(2):421-8.
- Yoshioka T, Fujita T, Kanai T, Nakamura K, Kinushita T, Sankyo Co LTD. Thiazolidine derivatives with anti-diabetic activity their preparation and their use. EP patent 0441605 1992 January 22.
- Horikosch H, Pharmacological profile of CS-045, a new orally effective antidiabetic agent in insulin resistant animal models. Diabetes 1988;37:27A.
- Fujiwara T, Yoshioka S, Yoshioka T, Ushiyama I, Horikoshi H. Characterization of new oral antidiabetic agent CS-045. Studies in KK and ob/ob mice and Zucker fatty rats. Diabetes 1988;37:1549.
- Kuzuya T, Iwamoto Y, Kosaka K, Takebe K, Yamanouchi T, Kasuga M. A pilot clinical trial a new oral hypoglycemic agent, CS-045, in patients with non-insulin dependent diabetes mellitus. Diabetes Res Clin Pract 1991;11:147-54.
- Iwamoto Y, Kuzuya T, Matsuda A, Awata T, Kumakura S, Inooka G. Effect of new oral antidiabetic agent CS-045, on glucose tolerance and insulin secretion in patients with NIDDM. Diabetes Care 1991;14(11): 1083-6.
- Mimura K, Umeda F, Hiramatsu S, Taniguchi S, Ono Y, Nakashima N. Effects of a new oral hypoglycaemic agent (CS-045) on metabolic abnormalities and insulin-resistance in type 2 diabetes. Diabet-Med. 1994;11(7):685-91.
- Clark DA, Goldstein SW, Hulin B, Volkman RA, Eggler JF, Holland GF. Substituted dihydrobenzpyran and dihydrobenzofuran thiazolidine-2,4-diones as hypoglycemic agents. J Med Chem 1991;34:319.
- Stevenson RW, Hutson NJ, Krupp MN, Volkmann RA, Holland GF, Johnson MR. Actions of the novel antidiabetic agent, CP-68722, in the hyperglycemic, hyperinsulinemic ob/ob mouse. Diabetes 1990;39: 1218-27.
- Kreutter DK, Andrews KM, Gibbs EM, Stevenson RW, Hutson NJ. Insulin-like activity of a new antihyperglicaemic agent, CP-68722 in 3T3-L1 adipocytes. Diabetología 1989;32:506A.
- Young PW, Cawthorne MA, Coyle PJ, Holder JC, Holman GD, Kozka IJ. Repeat treatment of obese mice with BRL 49653, a new potent insulin sensitizer enhaces insulin action with adipocytes. Association with increased insulin binding and cell-surface GLUT-4 as measured by photoaffinity labeling. Diabetes 1995;44(9):1087-92.
- Eldershaw TP, Rattingan S, Cawthorne MA, Buckingham RE, Colquhoun EQ, Clark MG. Treatment with the thiazolidinedione (BRL 49653)decreases insulin resistance in obese Zucker hindlimb. Horm- Met-Res 1995;27(4):169-72.
- Heitzmann T, Neidlein R, Freund P, Reiff K, Strein K. Dose proportionality studies of novel thiazolidinedione derivatives as potent antidiabetic agents in mice. Arzneim-Forsch/Drug Res 1995;45(12):1284-8.
Lic. Zalua Rodríguez Riera. Centro de Química Farmacéutica. Ave 200 y 21, Atabey, municipio Playa, La Habana, apartado 16042, Cuba.














