Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.32 n.2 Ciudad de la Habana Mayo-ago. 1998
Centro de Desarrollo e Investigación de Medicamentos
Método analítico para la determinación de protirelina por cromatografía líquida de alta resolución
Alejandro S. Padrón Yaquis,1 Marjorie Fernández Nieves,2 Lisette Martínez Miranda3 y Julio C. Izquierdo Lozano4RESUMEN
Se desarrolló un método analítico para el control de la calidad y estudio de estabilidad de protirelina inyectable. Se realizó el análisis por cromatografía líquida de alta resolución, con la utilización de un sistema isocrático de buffer fosfato-metanol (85:15) como fase móvil y una columna Lichrosorb RP-18 de 250 x 4 mm de 5 mm y detección ultravioleta, a una longitud de onda de 210 nm. El método analítico resultó ser lineal, preciso, exacto y específico en el rango de concentraciones estudiadas.Descriptores DeCS: PROTIRELINA/análisis; CROMATOGRAFIA LIQUIDA DE ALTA PRESION/métodos; CALIDAD DE LOS MEDICAMENTOS; ESTABILIDAD DE MEDICAMENTOS.
La protirelina es un tripéptido sintético estructuralmente idéntico a la hormona liberadora de tirotropina producida por el hipotálamo. Este medicamento se indica como un auxiliar en el examen diagnóstico de la función tiroidea, por lo que resulta muy útil para el estudio de casos en que se presenta un deterioro de la función hipofisaria o hipotalámica.1,2 Es empleada para evaluar la actividad de la hipófisis cuando se sospecha la existencia de una lesión del hipotálamo o de la propia glándula; ayuda a ajustar la dosis de hormona tiroidea para lograr una adecuada efectividad en pacientes que padecen de hipotiroidismo primario o de bocio nodular o difuso. Se utiliza también para detectar la inhibición de la secreción de la hormona tirotropina que tiene lugar en el hipertiroidismo.3-5
Los medicamentos requieren una exigente política de calidad, que tenga por objetivo garantizar los intereses del paciente, la sociedad y el estado. En este sentido se establecen regulaciones nacionales para el aseguramiento de la calidad.6 Las normas cubanas sobre dirección y aseguramiento de la calidad surgen como resultado de la adopción de las normas de la serie ISO 9000, las cuales comprenden una adecuada racionalización de los numerosos y variados enfoques existentes actualmente en el mundo sobre la actividad.7
Los métodos analíticos por cromatografía líquida de alta resolución (HPLC) reportados recientemente para el análisis de protirelina son escasos y no contamos con información suficiente; por lo que en este trabajo los objetivos estuvieron encaminados a proponer un método analítico para el control de la calidad y estudio de estabilidad de protirelina inyectable.8-10 El análisis se realizó por HPLC mediante un sistema isocrático en fase reversa y con detección ultravioleta. Se comprobó la exactitud, precisión, linealidad y especificidad del método.11
MÉTODOS
Se utilizó un cromatógrafo líquido de alta resolución KNAUER, constituido por desgasificador, bomba de doble pistón reciprocante, inyector automático KONTRON, detector UV visible de longitud de onda variable KNAUER, integrador acoplado a IBM con software EUROCHROM para el procesamiento de datos.La separación se efectuó en una columna de acero inoxidable Lichrosorb RP-18 de 250 x 4 mm de diámetro interno con tamaño de partículas de 5 mm, empacada en el Centro de Investigación y Desarrollo de Medicamentos (CIDEM).
Las fases móviles se prepararon con agua bidestilada, metanol grado HPLC (Merck), fósfato de potasio monobásico (Merck) y ácido fosfórico al 85 % (Merck). Para la implementación del método se empleó estándar y materia prima de protirelina (AKZO). Las muestras analizadas para el desarrollo de este trabajo fueron identificadas según los lotes 036, 056 y 057 y fabricadas en el Departamento de Formas Terminadas de los laboratorios del CIDEM.
Para desarrollar el método cromatográfico fue necesario seguir diferentes etapas que permitieron establecer las condiciones óptimas, se hizo una selección adecuada de la fase estacionaria, la fase móvil, el tipo de detección y demás condiciones cromatográficas.
En la selección de la longitud de onda adecuada se realizó el espectro de absorción de la protirelina.12
Se registraron cromatogramas de sustancia de referencia en la que se utilizó como fase móvil agua, metanol y una mezcla agua-metanol para conocer la composición óptima de la fase móvil. Se optimizó el volumen de inyección y el flujo de la fase móvil. Se realizó un estudio previo de influencia del pH de la fase móvil sobre la elución de la protirelina.
En la validación del método analítico, la linealidad y el rango se estudiaron de forma simultánea, para lo cual se prepararon muestras con diferentes niveles de protirelina que representan el 25, 50, 75, 100, 125, 150 y 175 % de la concentración teórica del principio activo en el inyectable.
Para el estudio de la exactitud se empleó el método de recuperación, mediante la preparación de muestras con diferentes niveles de protirelina que representan el 50, 75, 90, 100, 110, 125 y 150 % de la concentración teórica del principio activo en el inyectable, según la formulación propuesta.
El cálculo de la precisión del método se realizó expresado en sus 2 formas: repetibilidad y reproducibilidad. La repetibilidad se hizo sobre la base de 10 determinaciones, y se estudió la reproducibilidad haciendo las valoraciones por 2 analistas.
Con el objetivo de evaluar la especificidad del método cromatográfico se sometió la muestra a condiciones de hidrólisis ácida y básica, y a una temperatura de 100 oC.
RESULTADOS
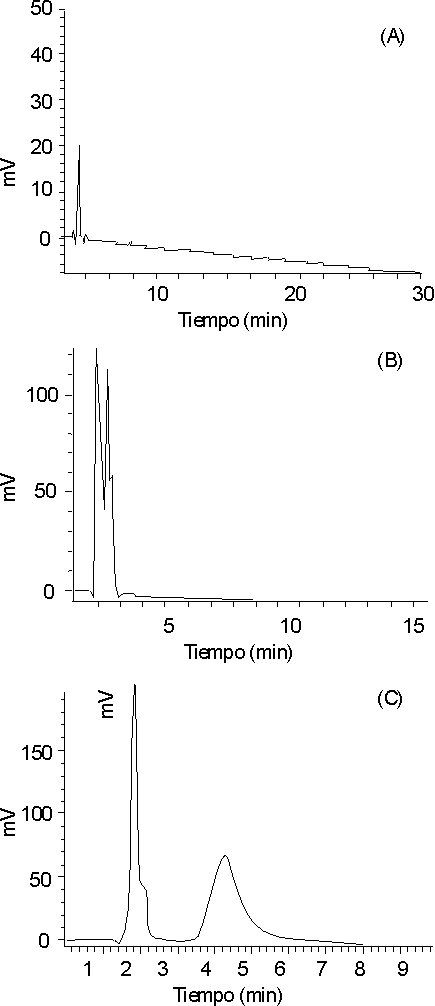
Al analizar el espectro de absorción ultravioleta de la protirelina, se observó que tiene su máximo muy cercano a 200 nm; esto impidió el empleo de un método espectrofotométrico para realizar el control de la calidad de este medicamento.En la figura 1 se muestran los cromatogramas de la solución de referencia, en la que se usa como fase móvil agua, metanol y una mezcla agua-metanol (70 : 30).
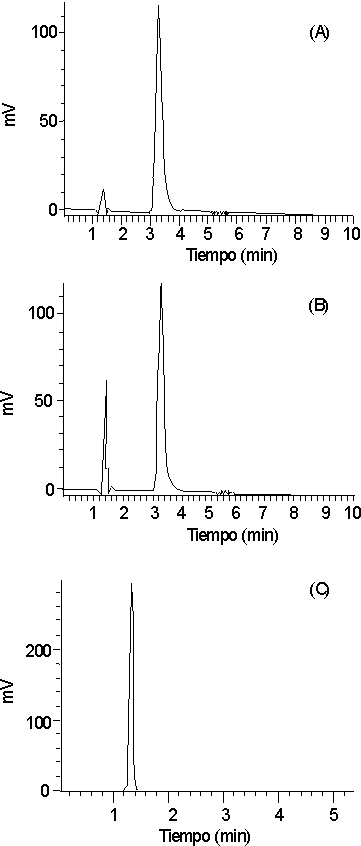
La composición óptima de la fase móvil resultó ser buffer fosfato 0,05 M pH = 3-metanol (85:15). En la figura 2 se muestran los cromatogramas correspondientes a la solución de referencia, producto terminado (ensayo 036) y placebo.
La ecuación de la recta para la curva de calibración se expresa según y = 0,4424 x -0,3212, con un coeficiente de correlación lineal de 0,9999. Al aplicar el test de significación del intercepto, éste resultó ser no significativo al ser la t (cal)< t(tab) (1,6 < 2,45).
Los resultados del estudio de la precisión aparecen en la tabla 1.
| | |||||
| | | ||||
| | | ||||
| | | ||||
| | | ||||
| | | ||||
| | | ||||
| | | ||||
| | | ||||
| | | ||||
| | | ||||
| | | ||||
| | | | |||
| | |||||
| | |||||
| Analista I | Analista II | ||||
| 97,86 | 96,75 | ||||
| 98,45 | 97,35 | ||||
| 97,28 | 97,78 | ||||
| 97,03 | 97,53 | ||||
| 97,03 | 97,22 | ||||
| Media: 97,53 S =0,6159 | Media: 97,52 S =0,5429 | ||||
| Fcalc = 1,287 F5% = 6,39 gl = 4/4 | tcalc =0,039 t5 %= 2,31 gl=8 | ||||
| Intervalo de confianza: 97,52 = 0,039 | |||||
En la tabla 2 se muestran los resultados obtenidos en el estudio de la exactitud del método. La curva de recuperación resultó ser lineal, con un coeficiente de correlación de 0,9999 y una pendiente igual a 0,9955.
Al aplicar el test de significación de la pendiente y del intercepto, resultaron ser no significatgivos ya que en ambos se comportó la t(cal) < t(tab) (pendiente 0,005< 2,57, intercepto 0,09 <2,57).
| | | | |
| | | | |
| | | | |
| | | | |
| | | | |
| | | | |
| | | | |
| | | | |
| | | | |
Ecuación de a curva de recuperación y=0,9955x + 0,0641 r = 0,9999.
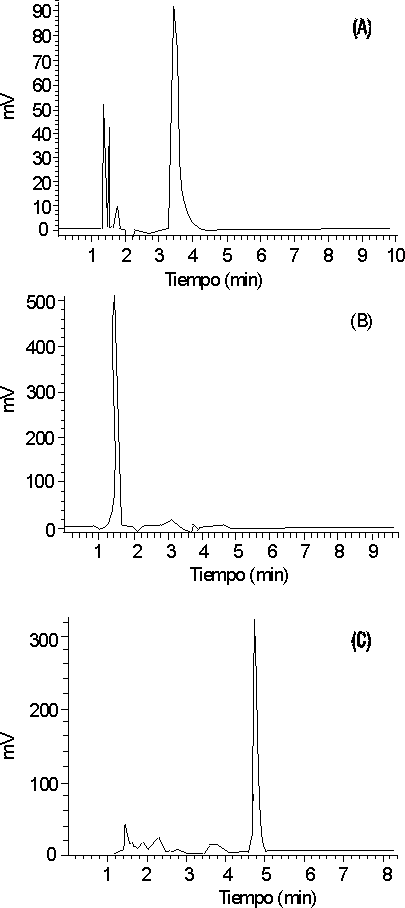
En la figura 3 se muestran los cromatogramas correspondientes a las soluciones de protirelina sometidas a condiciones drásticas para degradarla y verificar así la especificidad del método. El principio activo sufre degradación en medio básico, ácido y se produce una disminución del pico bajo temperaturas elevadas.
DISCUSIÓN
Se empleó un método analítico por HPLC mediante el cual es posible valorar el fármaco con la detección ultravioleta. Para realizar las lecturas se seleccionó una longitud de onda, en la cual no interfieren los excipientes (210 nm).De acuerdo con la polaridad de la sustancia de referencia es posible separar dicha sustancia en un sistema de fase reversa mediante la utilización de dichos solventes como fase móvil. Se comprobó también que ambos componentes no enmascaran la absorción del compuesto.
En los cromatogramas obtenidos (figura 1) no es posible utilizar como fase móvil ninguno de los 2 solventes por separado, por lo que se decidió utilizar la mezcla de ambos.
Al registrar el cromatograma que utilizó una concentración isocrática agua-metanol (70:30) y bajo estas condiciones se obtuvo un pico ensanchado (figura 1), se sustituyó el agua presente en la fase móvil por un buffer fosfato de concentración 0,05 M y se fijó el pH a un valor de 3, donde se obtienen los mejores resultados en cuanto a simetría del pico.
El coeficiente de correlación lineal obtenido en la curva de calibración demuestra linealidad en la respuesta del detecor en el rango de concentraciones entre 50,0 y 350,0 mg/mL.
Los resultados de precisión que aparecen en la tabla 1, para el caso de la repetibilidad, el coeficiente de variación alcanzado demuestra una buena precisión, ya que para métodos cromatográficos se permite como límite máximo el 2 %.
Los resultados de la reproducibilidad indican que no existe diferencia significativa entre la precisión lograda por los 2 analistas para el 95 % de probabilidad, pues el valor calculado en la prueba de Fisher resultó ser menor que el tabulado. No se observó diferencia significativa entre las medias de ambos analistas porque al aplicar la prueba de la t de Student el valor de la t calculada resultó ser menor que el tabulado, con 8 grados de libertad para el 95 % de probabilidad.
Los valores de coeficiente de variación obtenidos en cada uno de los niveles de concentración analizados en el estudio de exactitud, muestran una adecuada exactitud en el rango seleccionado.
Los valores de la pendiente, el intercepto y el coeficiente de correlación alcanzados demuestran la exactitud y la linealidad del método.
Al evaluar la especificidad del método analítico, no se observó interferencia de los productos de degradación, ya que no existen picos en la zona de elución perteneciente a la protirelina, lo cual permitió concluir que el método es específico para la sustancia activa.
El método analítico desarrollado por HPLC para el control de la calidad y el estudio de estabilidad de protirelina inyectable resultó ser lineal, preciso, exacto y específico en el rango de concentraciones de 50 a 350 mg/mL.
SUMMARY
An analytical for the quality control and stability study of injectable protirelin was developed. The analysis was made by high pressure liquid chromatography with the utilization of an isocratic system of phosphate-methanol buffer (85:15) as a mobile phase and a Lichrosorb RP-18 column of 250 x 4 mm of 5 mm and ultraviolet detection at a wave length of 210 nm. The analytical method proved to be lineal, precise, accurate and specific in the range of studied concentrations.Subject headings: PROTIRELIN/analysis; CROMATOGRAPHY, HIGH PRESSURE LIQUID/methods; DRUG QUALITY; DRUG STABILITY.
Referencias bibliográficas
- Vitamins and hormones. New York: Academic Press; 1971; vol 29:34-5.
- The Index Merck. 11 ed. Rahway: Merck; 1989:1509-10.
- Martindale W. The extra pharmacopoeia. 29 ed. London: Pharmaceutical Press; 1989:1152-3.
- Goodman L, Goodman Gilman A, Gilman A. Las bases farmacológicas de la terapéutica. 7 ed. La Habana; 1985:1313-28. (Edición Revolucionaria).
- Csaky TZ, Barnes BA. Cutting´s handbook of pharmacology. 7 ed. New York: Meredith Corporation; 1984:395-6.
- NC 26-211. Buenas prácticas de producción. 1992:1-7.
- Serie NC-ISO 9000. Sobre dirección y aseguramiento de la calidad. 1991:3-7.
- United States Pharmacopoeia DI. 14 ed. United States Pharmacopoeial Convention. Inc Washington: 1994;vol 3:394.
- United States Pharmacopoeia DI. 14 ed. United States Pharmacopoeial Convention, Inc. Washington: 1994;vol 1:2352-3,3098.
- United States Pharmacopoeia DI. 14 ed. United States Pharmacopoeial Convention, Inc Washington: 1994; vol 2:1173-4.
- Procedimiento estándar para validación de métodos analíticos. Colegio Nacional de Químicos Farma céuticos y Biólogos. Métodos analíticos. Validación. Mejico AC: 1992:22,23.
- Jaffé HH, Orchin M. Theory and application of ultraviolet spectroscopy. La Habana: 1962:556-7. (Edición Revolucionaria).
Ing. Alejandro S. Padrón Yaquis. Centro de Investigación y Desarrollo de Medicamentos. Ave. 26 No. 1605 entre Rancho Boyeros y Calzada del Cerro, municipio Plaza de la Revolución, Ciudad de La Habana, Cuba.
1 Ingeniero en Química de las Radiaciones.
2 Licenciada en Ciencias Farmacéuticas.
3 Licenciada en Bioquímica.
4 Técnico Medio en Química.














