Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.38 n.1 Ciudad de la Habana ene.-abr. 2004
Centro de Investigación y Desarrollo de Medicamentos
Estabilidad de una formulación de jarabe de dextrometorfano
Alfredo Fernández Serret,1 Yeni Aguilera Cabrera,2 Iván Morales Lacarrere3 y Esther Alonso Jiménez4
Resumen
Se desarrolló el estudio de estabilidad de una formulación de jarabe de dextrometorfano y se determinó su fecha de vencimiento. Este estudio se realizó por los métodos de vida de estante y de estabilidad acelerada, mediante cromatografía líquida de alta eficiencia reportada en la USP 23. La formulación de producción nacional cumplió con las especificaciones de calidad descritas en la farmacopea. Los resultados del estudio de estabilidad por vida de estante después de transcurridos los 24 meses indican que el producto mantiene los parámetros que determinan su calidad. Se establece 2 años como fecha de vencimiento en las condiciones de almacenamiento señaladas.
Palabras clave: dextrometorfano, estabilidad acelerada, vida de estante, cromatografía líquida de alta eficiencia.
El dextrometorfano es un fármaco que tiene propiedades calmantes de la tos, ya que posee acción inhibitoria pronunciada y específica del centro antitusígeno. Su prestigio como medicamento se apoya en que combate eficazmente los accesos de tos, sin efectos narcóticos ni analgésicos. No afecta la tos voluntaria ni interfiere con la expectoración necesaria para mantener limpias las vías respiratorias; su propiedad antitusiva es superior en relación con la codeína. Por todas estas razones es que alcanza gran aceptación en el mercado.1
En el mercado internacional se le conoce con diferentes nombres: pectobron, cosylan, romilar, robidex, sedatuss, dexphan, entre otros. También es frecuente encontrarlo en forma de tableta, cápsula o jarabe, combinado a otros principios activos de acción analgésica, expectorante y descongestionante.2,3
Su fórmula global es C18H25NO con una masa molecular de 271,41 g/mol que contiene 79,66 % de carbono; 9,28 % de hidrógeno; 5,16 % de nitrógeno y 5,9 % de oxígeno (fig. 1). Es un polvo cristalino blanco e inodoro, prácticamente insoluble en agua y soluble libremente en cloroformo.4
FIG. 1. Fórmula estructural del dextrometorfano.
El presente trabajo tuvo como objetivo realizar el estudio de estabilidad de una formulación de jarabe de dextrometorfano y determinar su fecha de vencimiento.
Métodos
Para el desarrollo de este estudio se empleó como materia prima el bromhidrato de dextrometorfano (C18H25NO·HBr·H2O), perteneciente al lote 910156 del fabricante La Roche, la cual fue analizada siguiendo las especificaciones de calidad descritas en la monografía de la USP XXII.5
Se utilizó el método analítico previamente validado descrito en la Farmacopea para el estudio de estabilidad.6 Este estudio se realizó por los métodos de vida de estante y estabilidad acelerada. Se emplearon muestras de los lotes 31, 32 y 33 procedentes del Laboratorio de Formas Terminadas del Centro de Investigación y Desarrollo de Medicamentos (CIDEM), se almacenaron a temperatura ambiente (30 ºC) y se protegieron de la luz, las que fueron valoradas al inicio y transcurridos 3, 6, 9, 12, 18 y 24 meses de fabricados.7 Los resultados se evaluaron con el empleo del programa ORIGIN versión 5.0 para Windows. Simultáneamente se les determinó el pH y se analizaron las características organolépticas.
Para realizar la valoración periódica de las muestras sometidas al estudio de estabilidad acelerada, el lote 33 se distribuyó y se almacenó en hornos a 40, 50, 60 y 70 ºC.
Se realizó además, un estudio del efecto de la luz sobre la estabilidad del producto, colocándose el lote 33 a la luz natural, en frascos ámbar e incoloro por 3 meses.
Resultados
En la tabla 1 se presentan los resultados obtenidos del estudio de estabilidad al evaluar los lotes correspondientes.
TABLA 1. Resultados analíticos del estudio de estabilidad por vida de estante
| Ensayos | Tiempo | Lote 31 | Lote 32 | Lote 33 | Especificaciones de calidad |
| Características | Inicial 3 meses 6 meses 9 meses 12 meses 18 meses 24 meses | R E S P O N D E | R E S P O N D E | R E S P O N D E | Líquido ligeramente siruposo, incoloro, olor característico y sabor dulce amargo |
| pH | Inicial | 3,88 | 3,88 | 3,90 | 3,0-4,20 |
| Valoración | Inicial | 102,3 % | 103,1 % | 103,4 % | 95,0-105,0 % |
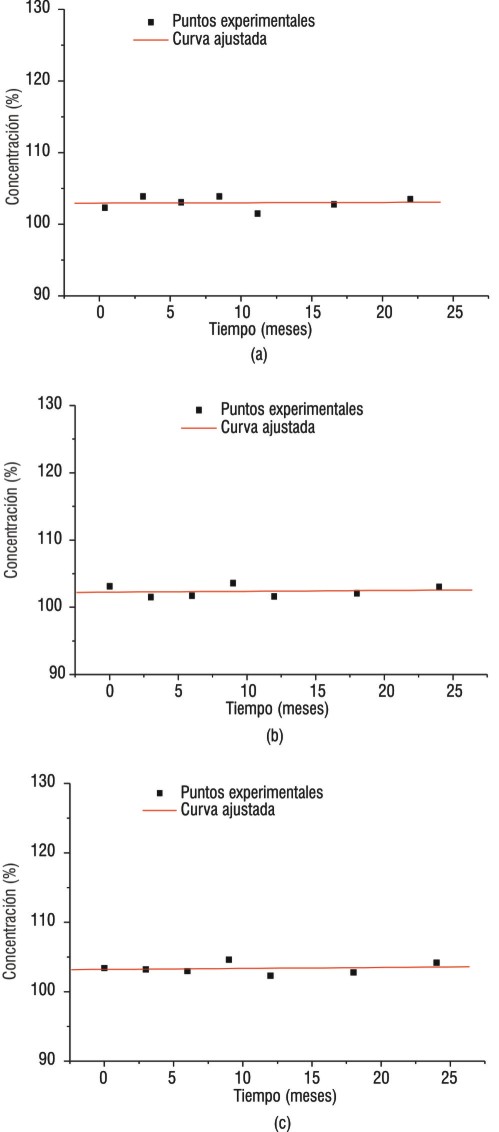
Los resultados de las valoraciones en el tiempo fueron analizados estadísticamente. En la figura 2 se observan los gráficos correspondientes. Al realizar el análisis de regresión lineal con los resultados obtenidos, se encontraron valores de coeficientes de determinación (r2) y de pendiente (b) muy cercanos a cero. Los valores de las pendientes no fueron diferentes de cero ya que al aplicar la prueba de la t de Student, las t experimentales fueron menores que la t tabulada.
FIG. 2. Estabilidad por vida de estante: a) lote 31, b) lote 32 y c) lote 33.
Los resultados de las valoraciones periódicas de las muestras sometidas al estudio de estabilidad acelerada se muestran en la tabla 2. En la tabla 3 aparece la evaluación del lote 33 expuesto a la luz natural.
TABLA 2. Resultados analíticos del estudio de estabilidad acelerada. Ensayo 33
| Tiempo (días) | Conc %/T ºC 40 | Conc %/T ºC 50 | Conc %/T ºC 60 | Conc %/T ºC 70 |
| 0 | 103,4 | 103,4 | 103,4 | 103,4 |
| 7 | - | - | 102,3 | 100,9 |
| 19 | 102,9 | 102,6 | 101,9 | 101,6 |
| 26 | 102,8 | 101,9 | 101,5 | 101,3 |
| 38 | 102,4 | 101,9 | 101,5 | 101,3 |
| 63 | 103,6 | 102,5 | 104,0 | 103,6 |
| 75 | 103,0 | 102,9 | 102,7 | 102,8 |
| 112 | 101,8 | 101,4 | 101,5 | 101,6 |
TABLA 3. Estudio del efecto de la luz sobre la estabilidad del producto
3 meses (frasco incoloro)
Discusión
La evaluación estadística permitió comprobar que no existió correlación lineal entre los niveles de concentración en el tiempo evaluado, con la muestra de rectas paralelas al eje x, lo cual da el criterio para afirmar que existe una estabilidad adecuada.
Los resultados presentados en la tabla 2 confirman que el producto presentó una gran estabilidad térmica, ya que después de transcurridos 112 días se mantuvo la concentración conforme a los límites establecidos.
Por otra parte, los resultados obtenidos de la valoración de las muestras sometidas al efecto de la luz probaron que el tratamiento alteró el contenido de principio activo en el jarabe a los 3 meses de realizado el estudio, ya que como se observa en la tabla 3, hubo una disminución considerable del contenido del principio activo en el frasco incoloro, no así en el frasco ámbar, por lo que el medicamento deber ser protegido de la luz. Además se observaron cambios en las características organolépticas.
En conclusión, se comprobó la estabilidad química de la formulación por un período de 24 meses en las condiciones de almacenamiento señaladas. Dada la estabilidad térmica del producto, se propone 2 años como fecha de vencimiento almacenado en frasco ámbar a temperatura ambiente y protegido de la luz.
Summary
The stability study of a formulation of dextrometorphan syrup was conducted and its expiration date was determined. This study was carried out by the shelf life and accelerated stability methods through high efficiency liquid chromatography reported in the USP 23. The formulation of national production fulfilled the quality specifications described in the pharmacopoeia. The results of the stability study by shelf life after 24 months show that the product keeps the parameters determining its quality. A period of 2 years was established for its expiration under the above-mentioned storage conditions.
Key words: dextrometorphan, accelerated stability, shelf life, high efficiency liquid chromatography.
Referencias Bibliográficas
- Goodman A, Gilman A. Las bases farmacológicas de la terapéutica. V. 1. La Habana: Editorial Científico-Técnica; 1982. p.527-8. (Edición Revolucionaria).
- Martindale W. The extra farmacopoeia. 30 ed. London: The Pharmaceutical Press; 1993. p.746.
- Physicians Desk Reference. New Jersey. Medical Economics Company; 1990. p.725-6.
- The Merck Index. An Encyclopedia of Chemicals, Drugs and Biologicals. 11 ed. New York: Merck; 1989. p.1289.
- United States Pharmacopoeial Convection. USP XXII. Dextrometorphan Hydrobromide. 22 ed. Rockville: Mack Printing; 1990:482-3.
- United States Pharmacopoeial Convention. USP 23. Dextrometorphan Hydrobromide Syrup. 23 ed. Rockville: Mack Printing; 1995. p.482-3.
- Food and Drug Administration Center of drugs and biologics. Guideline for submitting documentation for the stability of human drugs an biologics. Feb, 1987.
Recibido: 3 de noviembre de 2003. Aprobado: 28 de noviembre de 2003.
MSc. Alfredo Fernández Serret. Centro de Investigación y Desarrollo de Medicamentos. Ave. 26 No. 1605, entre Boyeros y Puentes Grandes, municipio Plaza de la Revolución, CP 10 600, Ciudad de La Habana, Cuba.
1 Master en Ciencias. Investigador Auxiliar. Centro de Investigación y Desarrollo de Medicamentos (CIDEM).
2 Licenciada en Ciencias Farmacéuticas. Hospital Clinicoquirúrgico "Enrique Cabrera".
3 Licenciado en Ciencias Farmacéuticas. Investigador Agregado. CIDEM.
4 Técnica en Tecnología Farmacéutica. CIDEM