Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.38 n.3 Ciudad de la Habana sep.-dic. 2004
Centro de Toxicología y Biomedicina
Instituto Superior de Ciencias Médicas, Santiago de Cuba
Incorporación de dos ensayos alternativos para evaluar irritación ocular en un laboratorio de toxicología
Gisela Murillo Jorge,1 Luis Ulpiano Pérez Marqués1 y Enieyis Tur Naranjo2
Resumen
Se evaluaron 2 ensayos alternativos al uso de animales de laboratorio que han sido propuestos para determinar el potencial de irritación ocular de sustancias químicas y formulaciones; uno que utiliza eritrocitos bovinos y, otro, la membrana corioalantoidea del embrión de pollo de 10 días de incubación. Se halló el potencial de irritación de algunas de las sustancias de referencia que están incluidas en los respectivos protocolos y se encontró correspondencia con los datos reportados en ellos, ya que la clasificación para cada una de las sustancias fue igual a la referida. Fueron irritantes el cloruro de benzalconio, el lauril sulfato de sodio y el hidróxido de sodio; no resultó irritante el poli-etilen-glicol. Este comportamiento es el mismo que se ha obtenido en estudios in vivo. Además de ofrecer resultados confiables, estas técnicas son económicas, rápidas y de fácil realización, en comparación con el procedimiento tradicional que se realiza en conejos.
Palabras clave: Toxicología in vitro, irritación ocular, métodos alternativos.
Como consecuencia de consideraciones éticas, científicas y económicas,1 la necesidad de reducir o sustituir el uso de los animales de experimentación cuenta hoy con un creciente respaldo de la comunidad científica a escala mundial, y muchas son las propuestas para realizar las evaluaciones toxicológicas aplicando métodos alternativos.2 Para ello se requiere de un laborioso proceso previo de validación de las técnicas a emplear. El Laboratorio de Toxicología in vitro del Centro de Toxicología y Biomedicina de Santiago de Cuba acometió esta tarea en relación con las pruebas de hemólisis y desnaturalización de la hemoglobina y de la membrana corioalantoidea del huevo de gallina, conocidas como RBC y HET-CAM, respectivamente, de acuerdo con sus siglas en inglés. Las técnicas de estos ensayos están descritas en los protocolos números 37, para la primera,3 y 47 para la segunda,4 ambos de la base de datos INVITTOX. Estos son bioensayos que se proponen como sustitutos a la prueba de Draize,5 que utiliza conejos para evaluar el potencial de irritación ocular de ingredientes o formulaciones para cosméticos, medicamentos y otros productos.
El RBC es un procedimiento basado en el uso de eritrocitos bovinos para cuantificar los efectos adversos de surfactantes y productos detergentes sobre la membrana citoplasmática (hemólisis) en combinación con el daño a las proteínas celulares liberadas (desnaturalización), lo cual puede ser detectado sensiblemente por los cambios en la absorbancia espectrofotométrica de la hemoglobina, como indicador de ambos procesos. El HET-CAM consiste básicamente en poner en contacto la sustancia en estudio con la membrana corioalantoidea (MCA) de embriones de pollo de 10 días de incubación, midiéndose el tiempo de aparición de los efectos observables sobre dicha membrana (hemorragia, lisis vascular y coagulación) durante 5 min. La rapidez en la aparición y la intensidad de los daños son expresión del potencial irritante de la sustancia evaluada.
El objetivo de esta investigación fue conocer si en nuestras condiciones era factible el montaje y desarrollo de estas técnicas, para su aplicación en las baterías de ensayos que permiten evaluar el potencial de irritación ocular de sustancias químicas y formulaciones para diferentes usos.
Métodos
Sustancias evaluadas
Se evaluaron 4 sustancias de referencia de las cuales se ofrecen datos en dichos protocolos: un tensioactivo catiónico, el cloruro de benzalconio, y otro no iónico, el poli-etilen-glicol (PEG), entre las sustancias referidas en el protocolo 37 para la prueba RBC; el hidróxido de sodio (NaOH) para el HET CAM y para ambas pruebas un tensioactivo aniónico, el lauril sulfato de sodio (LSS). En todos los casos dichas sustancias se utilizaron a las concentraciones señaladas en los correspondientes protocolos, comparando los efectos obtenidos con los referidos en estos. Al evaluar el RBC esas concentraciones fueron 0 a 60 mg/L para el LSS, 0 a 50 mg/L para el cloruro de benzalconio y 0 a 10 g/L para el PEG. Cuando se estudió el HET-CAM las concentraciones fueron 10 g/L para el LSS y 0,1 N para el NaOH.
Prueba RBC
Obtención de la sangre y preparación de la suspensión de eritrocitos. La sangre fue obtenida por punción venosa de bovinos jóvenes controlados desde el punto de vista epizootiológico y se depositó en tubos de ensayo que contenían una cantidad de anticoagulante en proporción 1:10 (buffer citrato:sangre). Se procedió a la separación del plasma mediante centrifugación, eliminándose el sobrenadante. Los eritrocitos fueron lavados 4 veces en solución tamponada de fosfato (PBS) y se resuspendieron en ella a razón de 8 x 109 glóbulos/mL.
Hemólisis. Las muestras de sustancias a evaluar fueron diluidas en PBS para obtener un rango de 7 concentraciones que garantizara una relación de dosis-respuestas, desde falta de efecto hasta 100 % de hemólisis. La suspensión de glóbulos previamente preparada se agregó a estas en proporción 1:40 (V/V) y se incubaron durante 10 min con agitación constante a temperatura ambiente. Finalizada la incubación, los tubos fueron centrifugados con el fin de separar las células intactas y los detritus. Se midió la absorbancia del sobrenadante obtenido a 530 nm contra una solución blanco (la cual contenía solamente la muestra diluida en PBS) a cada una de las diluciones correspondientes. Se determinó la media de los 3 valores registrados para cada concentración.
La hemólisis espontánea se determinó al añadir la suspensión de glóbulos a PBS, mientras que se añadió a agua destilada para producir la hemólisis osmótica de todos los glóbulos, en ambos casos también en proporción 1:40. Después de centrifugar, se midió la absorbancia del sobrenadante a 530 nm contra soluciones blanco (las cuales contenían PBS y agua destilada respectivamente). Así se obtuvieron los valores de cero y 100 % de hemólisis.
La liberación fraccionaria de hemoglobina causada por cada muestra tensioactiva se expresó como un porcentaje relativo, calculado a partir del valor de densidad óptica obtenido de la lisis del 100 % de los eritrocitos. La concentración hemolítica media (H50) de cada sustancia de prueba fue obtenida a partir de la curva de dosis-respuesta. La H50 es la concentración que provoca lisis en el 50 % de los eritrocitos.
Desnaturalización de la hemoglobina. Se añadió la suspensión de glóbulos en igual proporción que en el ensayo de hemólisis (1:40) a una concentración de tensioactivo en las muestras a ensayar de 1 g/L. Se incubó durante 10 min con agitación constante a temperatura ambiente. Después de la incubación, los tubos fueron centrifugados y se midió la absorbancia del sobrenadante obtenido a 540 y a 575 nm contra una solución blanco, la cual contenía solamente la muestra diluida en PBS, a una concentración de tensioactivo de 1 g/L. Se dividió la extinción medida a 575 nm por la extinción medida a 540 nm para obtener el llamado índice o razón a / b(Ri). Esta razón se utilizó subsiguientemente para calcular el índice de desnaturalización de la hemoglobina (ID).
Para la hemoglobina, la razón R1 es 1,05 ± 0,001 (según referencia del protocolo original), en tanto que el estándar interno de LSS (a 3,47 mmol/L como concentración de trabajo final), da la razón R2. La potencia individual de desnaturalización de las muestras se calculó mediante la fórmula ID (%) = 100 (R1 - Ri) / (R1-R2). Además, la relación entre la H50 y el ID, definida como el cociente lisis/desnaturalización (o razón L/D) se calculó para cada agente evaluado, y se utilizó para establecer la clasificación de este, de acuerdo con los criterios previstos en el protocolo. (tabla 1).
TABLA 1. Clasificación de las sustancias que son evaluadas por la prueba RBC
| Cociente L/D in vitro | Estimación de la irritación ocular in vivo |
| > 100 | No irritante |
| > 10 | Ligeramente irritante |
| > 1 | Moderadamente irritante |
| > 0,1 | Irritante |
| < 0,1 | Muy irritante |
Prueba HET CAM
Obtención y preparación de los embriones a utilizar en los ensayos. Se utilizaron huevos de gallinas fértiles de la raza White Leghorn con un peso de 50-60 g y 10 días de incubación, los que fueron mantenidos a una temperatura de 37,5 ± 0,5 °C y una humedad relativa de 62,5 ± 7,5 %, los cuales se revisaron en un ovoscopio previamente al ensayo, descartándose los no viables. Se procedió a abrir el cascarón por la zona de la cámara de aire para exponer la membrana blanca, la cual fue humedecida con una solución de NaCl al 0,9 %. Se retiró dicha membrana cuidadosamente con instrumental quirúrgico oftálmico evitando dañar la MCA que queda expuesta.
Procedimiento del HET-CAM. Se añadieron 0,3 mL de las sustancias en estudio sobre la MCA de 3 huevos y se observaron las reacciones de hemorragia, lisis (desintegración de los vasos) y coagulación (desnaturalización de las proteínas intravasculares y extravasculares) por un periodo de 5 min. Se registró en segundos el tiempo en que apareció cada una para hallar el índice de irritación (II), aplicando la fórmula:
![]()
donde:
II:índice de irritación
H: hemorragia
L: lisis vascular
C: coagulación
s: tiempo en segundos en que aparece el efecto.
Análisis estadístico
Para cada una de las sustancias de referencia evaluadas se determinó la media aritmética y la desviación estándar de los valores obtenidos y se construyeron los intervalos de confianza para una p<0,05. Así mismo, se calculó el coeficiente de variación (CV) interensayo de los valores de la H50. Los datos se almacenaron en hojas del programa Microsoft Excel 2000. Los cálculos se efectuaron con el auxilio del programa STATISTICA para Windows, versión 4.2 (1993).
Resultados
Prueba RBC
En la tabla 2 se muestran los valores obtenidos de H50, ID, L/D y la clasificación de las sustancias, los que fueron similares (p<0,05) a los referidos en el protocolo original. El PEG no ocasionó hemólisis a una concentración máxima ensayada de 10 g/L. Los coeficientes de variación de H50 fueron de 7,49 para el lauril sulfato sódico y de 2,23 para el cloruro de benzalconio.
TABLA 2. Evaluación de las sustancias de referencia por la prueba RBC
| Sustancia | Concentración hemolítica media (mg/L) | Índice de desnaturalización (%) | Cociente lisis/desnaturalización | Clasificación |
| CB | 32* | > 100* | ND* | Muy Irritante* |
| CB | 32,26 ± 0,72 | 70 | 0,46 | Irritante |
| LSS | 29,4 ± 3,7* | 100* | 0,29* | Irritante* |
| LSS | 26,16 ± 1,96 | 100 | 0,26 | Irritante |
| PEG | No lisis* | 1* | ND* | No Irritante* |
| PEG | No lisis | 0 | ND | No Irritante |
CB (Cloruro de benzalconio); LSS (Lauril sulfato sódico); PEG (Polietilenglicol); ND (No determinada); * (Datos de referencia del protocolo)
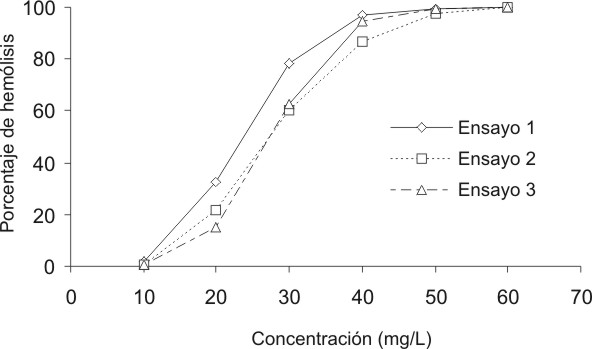
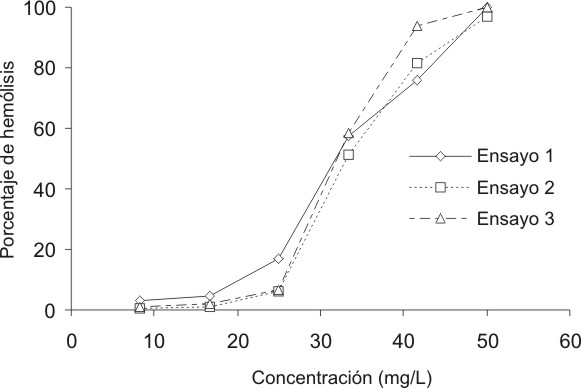
Las figuras 1 y 2 presentan la hemólisis producida a distintas concentraciones por el lauril sulfato sódico y el cloruro de benzalconio, respectivamente. Se muestran los resultados de 3 ensayos independientes, donde se observa una gran reproducibilidad de estos al existir, incluso, superposición de las curvas en algunos segmentos de ellas.
FIG. 1. Curvas de hemólisis a distintas concentraciones del lauril sulfato sódico.
FIG. 2. Curvas de hemólisis a distintas concentraciones del cloruro de benzalconio.
Prueba HET CAM
La tabla 3 muestra el índice de irritación II del LSS y del NaOH a las concentraciones evaluadas. Como se puede observar, los valores del II obtenidos en el laboratorio fueron similares a los reportados por los autores del protocolo, ya que quedan incluidos en los intervalos de confianza señalados por ellos.
TABLA 3. Índices de irritación del LSS y del NaOH hallados por el HET-CAM
| Sustancias | Datos de referencia del protocolo | Datos obtenidos en el laboratorio |
| LSS (10 g/L) | 10 ± 2 | 11,58 |
| NaOH (0,1 N) | 15 ± 3 | 17,94 |
Discusión
Cuando enfrentamos el LSS en las concentraciones definidas con la suspensión de eritrocitos se obtuvieron curvas típicas de dosis-respuesta para los 3 ensayos (fig. 1). Los valores del II obtenidos fueron similares a los reportados por los autores del protocolo, ya que quedan incluidos en los intervalos de confianza señalados por aquellos. Puede apreciarse, además, la baja dispersión de los datos alrededor del valor central de los resultados, así como el bajo coeficiente de variación, todo lo cual es expresión del grado de repetibilidad alcanzado.
Algo similar ocurrió al trabajar con el cloruro de benzalconio. En la figura 2 puede verse que casi llega a producirse la superposición de las curvas de dosis-respuesta. Es apreciable cómo aquí son mucho menores la dispersión de los datos alrededor del promedio y el valor del coeficiente de variación.
Como era de esperarse, no hubo hemólisis ni desnaturalización frente al PEG, al tratarse de una sustancia no irritante in vivo, lo cual coincide con lo hallado previamente por los autores del protocolo.
Cualquier sustancia química que provoque lisis y desnaturalización de proteínas es una sustancia con capacidad para desencadenar una respuesta inflamatoria, de ahí la utilidad que se atribuye a la prueba RBC. Esta prueba puede ser usada de rutina para medir la irritación en evaluaciones de la seguridad de productos de consumo que contienen tensioactivos. El sistema de ensayo es simple y se caracteriza por indicadores definidos y objetivos, mediante el uso de un indicador natural (la hemoglobina), no requiere equipamiento especial y pueden evaluarse varias sustancias en una jornada de trabajo.6
Por otra parte, con la técnica descrita en el protocolo del HET-CAM se obtiene una adecuada clasificación de las sustancias y una adecuada correlación in vivo/in vitro, es un ensayo sencillo que se realiza en pocos minutos, por lo que es factible de realizar en cualquier laboratorio. Esta prueba puede usarse como un rápido tamizado en una batería de ensayos de primer orden para la medición del potencial de irritación ocular agudo.7
El resultado favorable de esta investigación ha permitido utilizar ya estas técnicas en la evaluación del potencial de irritación de 20 productos de la industria cosmética cubana por la prueba RBC,8 así como otras 10 formulaciones por la técnica HET-CAM.9 las que incluyen cosméticos y limpiadores de esas empresas, así como colirios de producción nacional y sustancias químicas puras. En esos estudios, los resultados fueron comparados con los obtenidos por la pruba de Draize, encontrando coincidencia entre ellos.
El Grupo de Estudios Toxicológicos Alternativos en Cuba (ETAC), perteneciente a la red nacional de toxicología, tiene entre sus objetivos incorporar técnicas que contribuyan a reducir o sustituir el uso de animales de experimentación, especialmente aquellas que sustituyen a la ya mencionada prueba de Draize, no solo por las implicaciones éticas y científicas10 sino también económicas, si se tiene en cuenta el desarrollo alcanzado por las industrias farmacéutica y de cosméticos, las que necesitan efectuar el registro de sus nuevos productos. Por esta razón varios laboratorios del país se encuentran trabajando en la introducción de dichas técnicas.
La prueba de Draize es, tal vez, el ensayo in vivo para la que más intensamente se han buscado alternativas internacionalmente,11-13 porque varias entidades reguladoras a escala mundial han propuesto su supresión para la evaluación de cosméticos en los próximos años.14 Para ese momento la ciencia y la industria cubanas deben estar preparadas; al logro de tal objetivo estratégico corresponde el esfuerzo que hoy se realiza.
El Centro Estatal para el Control de la Calidad de los Medicamentos (CECMED), estableció en 1996 su posición con respecto a los métodos alternativos en la toxicología y planteó que se aceptarán los estudios in vitro diseñados con el objetivo de evaluar el mecanismo de acción tóxica, así como tamizar los efectos tóxicos agudos; además, expresó su disposición de analizar cualquier método alternativo propuesto cuyo objetivo sea la sustitución de ensayos in vivo.
Summary
Two alternative assays to the use of laboratory animals that have been proposed to determine the potential of ocular irritation of chemical substances and formulations, were evaluated. One of them uses bovine erythrocytes and the other the chorio-allantoic membrane of the chicken embrio of 10 days of incubation. The irritation potential of some of the reference substances that are included in the respective protocols was calculated and it was found correspondence with the data reported in them, since the classification for each of the substance was identical to the referred one. Benzalkonium chloride, lauryl sodium sulphate and sodium hydroxide proved to be irritant. Poly-ethylen-glycol was not irritant. This behavior is the same that has been obtained in vivo. Besides providing reliable results, these techniques are economic, fast and easy to be applied compared with the traditional procedure carried out in rabbits.
Key words: In vitro toxicology; ocular irritation; alternative methods.
Referencias bibliográficas
1. Giráldez A. Algunas dificultades en la transposición a los humanos de los resultados obtenidos en animales. Animales de Laboratorio 1999;4:6-9.
2. Worth AP, Balls M, eds. Alternative (non-animal) methods for chemicals testing: current status and future prospects. A report prepared by ECVAM and the ECVAM Working Group on Chemicals. ATLA 2002;30(Supl. 1):1-125.
3. Pape W. Red blood cell test system. The ERGATT/FRAME databank of in vitro techniques (INVITTOX) 1992;IP-37:1-14.
4. Spielmann H. HET-CAM Test. The ERGATT/FRAME Databank of in vitro techniques (INVITTOX) 1992;I P-47;1-9.
5. Balls M, Berg N, Bruner LH, Curren RD, de Silva O, Earl LK, et al. Eye irritation testing: the way forward. The report and recommendations of ECVAM workshop 34. ATLA 1999;27:53-77.
6. Okamoto Y. Interlaboratory validation of the in vitro eye irritation tests for cosmetic ingredients. (3) Evaluation of the haemolysis test. Toxicology in vitro 1999;13:115-24.
7. Lordo RA, Feder PI, Gettings SD. Comparing and evaluating alternative (in vitro) tests on their ability to predict the Draize maximum average score. Toxicology in Vitro 1999;13:45-72.
8. Pérez U, Murillo G, Tur E, Vinardell MP, García G, Pascual JR. Evaluación de la irritación ocular mediante un ensayo de hemólisis y desnaturalización de la hemoglobina in vitro. Rev Toxicol 2003;20:193-8.
9. Murillo G, Pérez U, Tur E, Vinardell MP, García G, Pascual JR. Estudio comparativo de tres variantes del ensayo de la membrana corioalantoidea del huevo de la gallina para la evaluación de la irritación ocular. Rev Toxicol 2003;20:187-92.
10. York M, Steiling W. A critical review of the assessment of eye irritation potential using the Draize Rabbit eye test. J Appl Toxicol 1998;18:233-240.
11. Esdaile DJ. The current status and perspectives on alternatives for regulation eye irritancy testing. En: Progress in the reduction, refinement and replacement of animal experimentation. New York: Elsevier Sciences; 2000. p.567-9.
12. Jones PA, Budynsky E, Cooper KJ, Decker D, Griffiths HA, Fentem JH. Comparative evaluation of five in vitro tests for assessing the eye irritation potential of hair-care products. ATLA 2001;29:669-92.
13. Knight DJ, Breheny D. Alternatives to animal testing in the safety evaluation of products. ATLA 2002;30:7-22.
14. FRAME. European news. EU finally bans cosmetics testing in animals. FRAME News 2003;56:4.
Recibido: 14 de mayo de 2004. Aprobado: 14 de junio de 2004.
M. Gisela Murillo Jorge. Centro de Toxicología y Biomedicina. Autopista Nacional km 1½, Apartado Postal 4033, Santiago de Cuba, CP 90 400, Cuba.
1 Master en Toxicología Experimental. Investigadora Agregada. Profesora Auxiliar.
2 Técnico Medio en Procesos Biológicos