Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.39 n.3 Ciudad de la Habana sep.-dic. 2005
Artículos de revisión
Instituto de Farmacia y Alimentos.
Universidad de La Habana
Especies reactivas del oxígeno y balance redox, parte I: aspectos básicos y principales especies reactivas del oxígeno
Gregorio Martínez Sánchez1Resumen
El balance redox ha sido reconocido, de forma cada vez más creciente, como un componente crítico del proceso de envejecimiento; la iniciación y desarrollo de enfermedades de notable morbilidad y mortalidad (aterosclerosis, cáncer, enfermedades del sistema nervioso central, enfermedades autoinmunes, daño por isquemia-reperfusión, entre otras) y respuestas celulares, inducidas por el estrés oxidativo. Estrechamente vinculado con el estrés oxidativo está la generación de especies reactivas de oxígeno las cuales provocan daño celular directo, además de actuar como segundos mensajeros intracelulares al modular las vías de transducción de señales. En el presente trabajo se recogen los principales antecedentes de las investigaciones relacionadas con este tema y se describen las más importantes características de las especies reactivas del oxígeno.
Palabras clave: Estrés oxidativo, radicales libres, especies reactivas del oxígeno.
El interés de la comunidad científica por las alteraciones provocadas por el estrés oxidativo ha aumentado de forma considerable durante los últimos años.1 El estudio de las especies reactivas del oxígeno (ERO) ha sido de gran significación para la práctica médica, fundamentalmente por el aporte de nuevos conocimientos acerca de la causa de diversas enfermedades, en la medida que: 1) Se descubre cómo sustancias antioxidantes son efectivas en el tratamiento de estos desórdenes 2) Cómo fármacos, de eficacia comprobada en diferentes enfermedades, poseen propiedades antioxidantes.
El desbalance entre la generación de ERO y los sistemas de defensas antioxidantes conlleva a modificaciones químicas de macromoléculas de relevancia biológica (ADN, proteínas, lípidos y carbohidratos).2-4 Este desbalance se asocia con mecanismos fisiopatológicos para la iniciación y desarrollo de enfermedades de notable morbilidad y mortalidad (aterosclerosis, cáncer, enfermedades del sistema nervioso central, enfermedades autoinmunes, daño por isquemia-reperfusión, entre otras).5
La generalidad de estos estados fisiopatológicos se han asociado con ciertos hábitos de vida que incluyen aquellos relacionados con la dieta. La comprensión del complejo fenómeno del balance redox transita por el entendimiento de las investigaciones que antecedieron el estado del conocimiento actual sobre el tema y las principales características de las ERO, este es el objetivo del presente trabajo.
Recuento histórico
La vida en la Tierra surgió primeramente en una atmósfera reductora. No fue hasta la aparición de las algas con capacidad fotosintética que el oxígeno comenzó a aparecer en la atmósfera en cantidades cada vez mayores. Esto representó una presión evolutiva muy seria al crearse una atmósfera oxidante con concentraciones de O2 muy elevadas. Sin embargo, la aparición del O2 en la atmósfera de nuestro planeta permitió el desarrollo de organismos más complejos que utilizaban esta molécula para la producción de energía de una forma mucho más eficiente.6
Si bien más del 95 % del O2 consumido por los organismos aerobios es reducido completamente a H2O durante la respiración mitocondrial, un pequeño porcentajes (< 5 %) es convertido a especies semirreducidas conocidas como ERO.7 Las ERO pueden ser altamente tóxicas e iniciar reacciones en cadena que pueden comprometer la vida de la célula. En la actualidad es difícil no encontrar en una revista biomédica algún artículo donde se discuta el papel de las ERO en disímiles estados fisiopatológicos.
Se denomina estrés oxidativo a aquella situación en la que las células están expuestas a un ambiente prooxidante y los mecanismos defensivos antioxidantes son sobrepasados de forma que se llega a afectar el estado redox celular. En los sistemas biológicos los elementos prooxidantes provienen en su mayoría del O2, por lo que son denominados genéricamente ERO.
El reconocimiento de los efectos tóxicos del O2 sobre los seres vivos se remonta al último tercio del siglo XVIII, en 1777 Carl Wilhem Sheel los describe por primera vez. Mientras que los primeros experimentos controlados que demostraron el efecto tóxico del O2 sobre los animales fueron realizados por Paul Bert a finales del siglo XIX.8 Esto ocurría solo dos años después de que Sheele y Joseph Priestle9 descubrieran a la vez e independientemente esta molécula. Desde el siglo XIX y durante los primeros seis decenios del siglo XX se han ido acumulando datos sobre la letalidad y las consecuencias patológicas de la exposición animal a altas concentraciones del O2. Así se ha descrito que la toxicidad del O2 es mayor cuanto más alta sea la tasa metabólica de la especie animal considerada. Esto tiene que ver probablemente con la alta letalidad de este gas en los homeotermos (como los mamíferos) y con el aumento de la sensibilidad al oxígeno de los poiquilotermos conforme se eleva la temperatura.
En la mayoría de mamíferos el tratamiento con O2 puro a tensiones normobáricas produce la muerte en períodos tan cortos como 72 h por daño al tejido pulmonar, uno de los expuestos a tensiones más altas de O2 en el organismo, acompañado en las etapas finales de edema y hemorragia (efecto Lorraine-Smit). La utilización de concentraciones menores de O2 (incluso inferiores al 50 %) a presión normal, puede causar ceguera irreversible en niños prematuros por daños a la retina (fibroplasia retrolateral). Si se suministra O2 puro, pero a presiones hiperbáricas (a más de 2-3 atmósferas) además de una toxicidad aguda sobre el sistema nervioso (efecto Paul Bert) que se manifiesta con estados convulsivos que recuerdan a la epilepsia del «gran mal» y que pueden dar lugar a la muerte en horas o minutos según la dosis de exposición empleada. Hoy sabemos que el tejido nervioso es altamente sensible al O2y su mayor resistencia in vivo en relación al pulmón se debe a su menor grado de hiperoxia hística resultante de la saturación de la hemoglobina a presiones parciales del orden de solo 100 mmHg.
A pesar de la gran acumulación de descripciones sobre los efectos nocivos del O2 a muchos niveles de observación, durante mucho tiempo se careció de teorías que pudieran explicar su toxicidad. El primer mecanismo general propuesto consistió en suponer que el O2 inactivaba enzimas que presentaban grupos tiólicos esenciales en su forma reducida, -SH.10 Aunque este mecanismo se ha demostrado experimentalmente para algunas enzimas como la nitrogenasa bacteriana, la glutamato descarboxilasa de cerebro de pollo, o la enzima glucolítica gliceraldehído-3-fosfato-deshidrogenasa,11 está claro hoy en día que no puede explicar más que una pequeña parte de los procesos celulares alterados por el O2.
Posteriormente, y hasta bien avanzado el siglo XX, una gran cantidad de estudios incrementaron el conocimiento de los efectos dañinos de las altas concentraciones de O2 y de otros tóxicos oxidantes sobre los procesos biológicos que constituyen la vida. Sin embargo, no fue hasta 1969 cuando se comprobó implícitamente la generación de estos elementos como subproductos de las reacciones biológicas en las células (anexo). En ese año, McCord y Fridovich descubren la existencia en humanos de la superóxido dismutasa (SOD), enzima que cataliza la reacción de anión superóxido (O2·-) a peróxido de hidrógeno. La existencia de la enzima implicaba la presencia del O2·- como elemento formado durante el metabolismo oxidativo celular. Desde entonces se ha verificado la formación de diversos elementos reactivos derivados del O2 durante el metabolismo oxidativo y su participación en procesos fisiológicos y fisiopatológicos.6
Dentro del concepto de ERO se incluyen a los radicales libres (RL) de O2 y a otros compuestos de O2 que, si bien no pueden clasificarse químicamente como RL, sí son altamente prooxidantes y capaces de generar RL durante su metabolismo. Un RL se puede definir como aquella especie química que posee un electrón (e-) desapareado. Esta situación le confiere una alta capacidad de reacción, prácticamente con cualquier molécula, lo que también condiciona su corta existencia. Los RL se pueden formar a partir de átomos o moléculas por 3 vías: 1) por la ruptura homolítica del enlace covalente de una molécula, con la retención de un e-del par de e-compartidos por cada fragmento; 2) por la pérdida de un e- ; y 3) por la adición de un e-.
Con excepción de circunstancias inusuales como altas temperaturas, radiaciones ionizantes y luz ultravioleta, los RL se generan en las células fundamentalmente por reacciones con transferencia de e-. Estas pueden ser mediadas por la acción enzimática o producirse sin la intervención de enzimas, a menudo con la colaboración de iones metálicos de transición como hierro y cobre reducidos (reacciones de Fenton y Haber Weiss).7
A finales de los años 80 del siglo XX Robert Furchgott, Lou Ignarro y Ferid Murad describieron la naturaleza química y la vía biosintética de un mediador difusible de corto tiempo de vida media responsable de la relajación del músculo liso vascular, identificado como óxido nítrico (·NO). Este hallazgo representó el descubrimiento de un nuevo RL reconocido como un mediador central del flujo sanguíneo y la entrega de O2 a los tejidos y demostró que las ERO desempeñan una función crítica no solo en la respuesta inflamatoria y en el daño hístico sino que también regulan la transducción de señales intracelulares
Después del descubrimiento del ·NO y de la formación de otras especies derivadas del nitrógeno con capacidad reactiva, ha surgido la denominación de "especies reactivas de nitrógeno" (ERN), un término que muchos investigadores consideran inapropiado debido a que en todas las especies reactivas está presente el átomo de O2 y a que el e- no pareado se deslocaliza entre los átomos de nitrógeno y oxígeno; y por lo tanto, no es necesario aplicar esta denominación de ERN. En el presente artículo se referira con el término de ERO a todas las especies reactivas oxigenadas (radicales y no radicales) de interés biológico ya sean derivadas del oxígeno, el nitrógeno, el azufre o el carbono.
Principio de exclusión de pauli
El O2 molecular es un biradical, al tener 2e- sin parear. Sin embargo, los 2e- sin parear tienen el mismo spin, lo que impide que el O2 reaccione directamente con otros compuestos. La reducción directa por otros 2e- (a la vez) del O2 molecular está impedida por el hecho de que 2e- no pueden ocupar un mismo orbital con el mismo spin7 (fig.).
Fig. Reducción del oxígeno molecular mediante la adición sucesiva de electrones.
El principio de exclusión de Pauli (1925) establece que un orbital atómico no puede ser ocupado por más de 2e- y para que estos 2e- lo ocupen deben tener spines contrarios (+½ y -½). La restricción de spin puede evadirse de tres formas (lo que permite que el O2 pueda ser utilizado para la generación de energía):
- Al excitarse el O2, uno de los e- sin parear puede pasar a otro orbital de más energía y así invertir su spin. De esta forma se genera el oxígeno singlete (altamente reactivo) representado como 1O2.
- La unión del O2 a un metal de transición que contiene e- sin parear forma complejos que pueden aceptar un par de e- de otros substratos sin violar el principio de exclusión de Pauli.
- La restricción de spin puede violarse mediante la adición de e- al O2 paso a paso. La reducción univalente del O2involucra la producción de especies parcialmente reducidas de O2.
Especies reactivas del oxígeno de interés biológico
Especies radicalarias
Dentro de las especies radicalarias de mayor interés desde el punto de vista biológico están el anión radical superóxido (O2· -), radical hidroxilo (·OH), óxido nítrico (·NO), radical dióxido de nitrógeno (·NO2), radical hidroperoxilo (HO2·), radical peroxilo (RO2· ) y radical alcoxilo (RO·).
Radical anión superóxido (O2·-). Se forma a partir de una molécula de oxígeno en presencia de una cantidad de energía suficiente que le permita adquirir un electrón suplementario. Esta especie es producida por un gran número de enzimas, por reacciones de autooxidación y por transferencia no enzimática de e - provenientes de la reducción molecular univalente del oxígeno. El O2·- formado in vivo, con un t½ del orden de los milisegundos, se dismuta por la SOD con una rápida constante de reacción, o por vía no enzimática, en H2O2. La reactividad del O2·- es débil, pero puede penetrar las membranas biológicas y causar daños a blancos específicos (Fridovich, 1989). Además de los procesos de dismutación anteriormente mencionados, el O2·- es capaz de reaccionar con el ácido ascórbico con una constante de velocidad de 2,7 × 105 M -1 × s-1 a pH=7,00.6
Aunque es 4 órdenes inferior a la velocidad de reacción de la SOD , la concentración de ascorbato in vivo es generalmente 4 órdenes superior a la de SOD, todo ello hace factible la transformación de este radical al radical semidehidroascorbato, el cual es muy poco reactivo e incapaz de causar daños biológicos significativos.12 También el O2·- puede reaccionar con grupos sulfihidrilos (-SH), aunque la velocidad de esta reacción (<103 M-1×s-1) es usualmente muy baja.13 Adicionalmente, la reacción del O2·- con el glutatión produce radicales sulfurados más lesivos a la célula que el propio O2·-.14
Bajo condiciones de sobreproducción y agotamiento de sus secuestradores, el O2·- puede interactuar con los -SH de las proteínas y enzimas de su vecindad e inactivarlas, agotar el glutatión15 e iniciar una cascada de eventos oxidativos que tienen como componente crítico la reacción de Haber-Weiss.16 Puede además movilizar el hierro de las reservas intracelulares de ferritina y reaccionar con el hierro férrico para formar el radical perferrilo.15
Radical hidroxilo (·OH). Es el radical más reactivo encontrado en los sistemas biológicos.17 Tiene la capacidad de reaccionar con casi todas las moléculas biológicas con constantes de velocidad del orden de 109 -1010 M-1 × s-1. Se forma esencialmente a partir de O2·- y H2O2, a través de las reacciones de Haber-Weiss y Fenton,18 las que requieren trazas de metales de transición como catalizadores. En este caso el hierro juega el papel protagónico in vivo. No existen secuestradores específicos in vivo para esta especie radicálica. La metalotioneína plasmática tiene una constante de reacción con ·OH mayor que 1010 M-1 × s-1 . Sin embargo, sus concentraciones séricas son muy bajas comparadas con la albúmina cuya constante de reacción es de similar magnitud y por tanto más efectiva. También la glucosa, con una constante de reacción de 109 M-1 × s-1 puede ser más efectiva como secuestradora que la metalotioneína por estar presente en concentraciones de 4,5 mM . Por otra parte, la hipótesis de que los fármacos antinflamatorios secuestran ·OH en el sitio de inflamación es poco probable, porque estos medicamentos no alcanzan la concentración requerida para tal efecto,17 a excepción de los salicilatos.19
La interacción de ·OH con los ácidos grasos poliinsaturados (AGP), que componen los fosfolípidos de las membranas, son esenciales en el origen del daño oxidativo celular.20 El ·OH puede atacar un átomo de hidrógeno metilénico de un ácido graso y formar un radical lipídico (L·), como resultado queda un e - sin parear en el átomo del carbono metilénico. Este radical sufre un reordenamiento molecular que produce un dieno conjugado que reacciona con el oxígeno molecular para dar lugar a un radical hidroperoxil lipídico (LOO·). Dicho radical extrae un átomo de hidrógeno del carbono del grupo metilénico del AGP adyacente, y forma otro L· y el hidroperóxido lipídico (LOOH). El L· se combina con otra molécula de oxígeno (reacción en cadena), proceso conocido como peroxidación lipídica (POL) o, por otra parte, se une con otro L· para formar un complejo no reactivo, a expensas de la unión cruzada de los ácidos grasos de membrana, lo cual conduce a una disminución de la fluidez de la membrana.4,21
Radicales peroxilo y alcoxilo (RO2·, RO.). Se forman típicamente como intermediarios, durante la ruptura de lípidos peroxidados en las reacciones radicalarias de la POL.17 La formación de RO2· es el paso más importante de las reacciones de propagación en cadena durante la POL.7 La peroxidación de la membrana produce pérdida de la fluidez, alteraciones en las funciones secretoras y de los gradientes iónicos.22 Numerosos residuos químicos de estas reacciones, incluido el malonialdehído (MDA) pueden difundir del sitio donde se producen y provocar edema, alterar la permeabilidad vascular, desencadenar la reacción inflamatoria y la quimiotaxis, estimular la fosfolipasa A2 (FLA2 ) e inducir la liberación del ácido araquidónico (AA), con la subsiguiente formación de eicosanoides.22,23 Por otra parte, se ha encontrado una estrecha relación entre la elevación de las concentraciones de algunos productos terminales de la POL, la activación de proto-oncogenes y la promoción de tumores.24 Entre los secuestradores más importantes de los radicales RO2· y RO· se encuentran el glutatión y la vitamina C (de fase acuosa) y la vitamina E y los b-carotenos (de fase lipídica). Este último solo actúa como antioxidante a bajas concentraciones de oxígeno.25
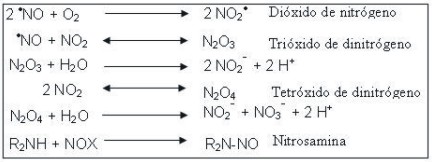
Óxido nítrico (·NO). Es un gas incoloro que posee un electrón no pareado deslocalizado entre el átomo de nitrógeno y el de O2 . El ·NO es relativamente poco estable en presencia de O2 molecular con un t½ de aproximadamente 3-5 s.
El NO2·, el N2 O3 y el N2 O4 son agentes nitrantes poderosos con capacidad de formar nitrosaminas potencialmente carcinogénicas.
El descubrimiento en 1987 de que el ·NO es una molécula que participa en la señalización y modula el tono vascular ha despertado un enorme interés en los efectos biológicos de esta molécula, la cual es reconocida actualmente como un mensajero químico nuevo para algunos tipos celulares, incluidas las neuronas. El ·NO se forma in vivo a partir del aminoácido L-arginina por acción de la enzima óxido nítrico sintetasa (NOS). Este proceso tiene lugar en las células del endotelio vascular, las neuronas y en los fagocitos activados.26 EL ·NO también conocido como factor relajante derivado del endotelio, es un importante mediador de las respuestas vasculares inducidas por diferentes agentes farmacológicos como la bradicinina y la acetilcolina.27 Una vez generado, el · NO puede difundir localmente e interactuar con las moléculas blanco como la guanilato ciclasa, la enzima que cataliza la formación de GMPc. El ·NO y el GMPc en conjunto comprenden un sistema de transducción de señales de espectro especialmente amplio. Las células del endotelio vascular pueden formar pequeñas cantidades de O2·- que pueden reaccionar con el ·NO, en la actualidad; las consecuencias para las células de esta interacción.28
El ·NO puede interactuar con el O2·- en una reacción radical-radical para generar el anión peroxinitrito (ONOO-), en una reacción que transcurre con una velocidad de 6,7 × 109 M-1 × s1. El ONOO - puede ejercer su toxicidad directamente sobre las células o descomponerse en otros productos tóxicos, que incluyen el ·OH.27,28
Especies no radicalarias
Las especies no radicalarias de mayor interés biológico son: ácido hipocloroso (HOCl), anión peroxinitrito ONOO- , peróxido de hidrógeno H2O2 y oxígeno singlete (1O2).
Peróxido de hidrógeno (H2O2): Se forma in vivo por dismutación del O2·- espontánea o enzimática (SOD y varias oxidasas en reacciones de oxidación-reducción durante el metabolismo celular).17,29 A bajas concentraciones el H2O2 es poco reactivo, sin embargo, altas concentraciones pueden interactuar con los sistemas de generación de energía de las células e inactivarlas; por ejemplo la gliceraldehído-3-fosfato deshidrogenasa.17
Además el H2O2 es capaz de oxidar grupos -SH de proteínas 20,29 y causar ruptura de las hebras del ADN. Su efecto más nocivo es la formación de ·OH catalizado por metales de transición. Fisiológicamente el H2O2 se remueve por la acción de las enzimas glutatión peroxidasa (GPx) y catalasa (CAT). Algunos ceto-ácidos como el piruvato, aunque reaccionan lentamente, alcanzan concentraciones fisiológicas capaces de ofrecer protección in vivo.25
Ácido hipocloroso (HOCl): Es un potente agente oxidante formado por los neutrófilos activados en los sitios de inflamación, por la acción de la enzima mieloperoxidasa (MPO).17 Este agente reacciona con los grupos -SH y aminos proteicos, y puede clorinar las bases purínicas del ADN. Uno de los blancos más importantes del HOCl in vivo es la a1 -antiproteinasa, proteína circulante inhibidora de proteasas de mayor relevancia, que protege a los tejidos de la acción de proteasas como la elastasa.30
El ácido ascórbico y la albúmina, a concentraciones fisiológicas, son poderosos inactivadores del HOCl. Se conoce que muchos fármacos antinflamatorios inactivan el HOCl in vitro, pero solo algunos logran las concentraciones fisiológicas para ejercer sus acciones in vivo.25
Durante la reacción inflamatoria los fagocitos activados utilizan diferentes ERO (·OH, H2O2 , HClO, 1O2, cloraminas) para la destrucción del contenido del fagosoma. El O2·- se genera por activación de una NADPH oxidasa, a través de una proteína quinasa C y el AA liberado por la FLA 2; 31 el H2O2 por la dismutación espontánea o enzimática del O2·-
Para la formación del ·OH se requieren trazas de metales de transición (Fe2+ , Cu+ ), por lo que su formación tiene lugar tras la penetración del H2O2 al interior de la bacteria, el cual libera el Fe2+ intrabacteriano. Una vía alternativa tiene lugar cuando el ataque del HOCl libera Fe2+ de la bacteria a la vacuola fagocítica. Los neutrófílos y otras células fagocíticas no contienen Fe catalítico capaz de formar ·OH y, de hecho, secretan al medio la proteína de unión a Fe2+, lactoferrina, para minimizar las reacciones radicalarias dependientes de Fe en su entorno.25,31
Por otra parte, la enzima MPO cataliza, en presencia de H2O2 y Cl-, la formación de derivados halogenados tóxicos como el HClO. El HClO reacciona con aminas o el ion amonio para formar cloraminas. Además, en presencia de H2O2 y Cl- tiene lugar la formación de 1O2. También, a partir del HClO se puede generar el ·OH a través de reacciones con el O2·- o el Fe2+.
HClO + O2 - ® OH + Cl - + O2
HClO + Fe2+ ® OH + Cl - + Fe3+
El O2 es una de la moléculas más necesarias para los seres vivos, pero también muestra toxicidad porque su metabolismo en la células origina la formación de ERO. Las ERO tienen una función fisiológica al participar en los mecanismos de señalización celular, la eliminación de gérmenes, entre otras funciones. Por otra parte, la ruptura del balance entre la generación de ERO y los mecanismos de defensa antioxidantes llevan al estrés oxidativo. Durante el estrés oxidativo los efectos pro-oxidantes de las ERO originan daños a las principales biomoléculas, estos daños se han confirmado en más de una centena de enfermedades humanas como la diabetes,32,33 el cáncer,34 dengue,35 VIH,36 y otras de elevada morbilidad y mortalidad. La comprensión de los mecanismos que forman parte del sistema redox y el desarrollo de métodos de diagnóstico clínicos permitirán dar seguimiento en la clínica a intervenciones nutricionales o medicamentosas dirigidas a contrarrestar el efecto de las ERO.
Anexo. Cronología de los descubrimientos más impo rtantes que han tenido lugar en la investigación sobre ERO
| 1775 | J oseph Pristley , el descubridor del oxígeno, sugirió por primera vez que este gas podría ser tóxico a las células. |
| 1900 | M oses Gomberg demostró la existencia del radical trifenilmetilo (Ph3 C·). |
| 1952 | Conger & Fairchild en un artículo publicado en la Proceedings of the National Academy of Sciences ( EE.UU.) demostraron por primera vez que el daño oxidativo mediado por las ERO ocurría en los organismos vivos, pues al aumentar la presión parcial de O2 aumentaba la frecuencia de aberraciones cromosómicas en granos de polen. |
| 1954 | Rebecca Gerschman y otros. propusieron que la toxicidad del oxígeno y el daño inducido por la radiación UV tenían al menos un mecanismo común, posiblemente relacionado con la formación de RL. Este artículo apareció en la prestigiosa revista Science . |
| 1954-1969 | Aparecieron publicadas numerosas críticas al trabajo de Gerscham y otros. , debido al hecho de que los RL son extremadamente reactivos y poseen tiempos de vida media (t½) muy cortos como para poder tener algún impacto biológico. |
| 1969 | McCord y Fridovich demostraron que la eritrocupreína (una proteína que se encuentra en altas concentraciones en los eritrocitos) cataliza la descomposición O2O2·- en H2O2 y O2. Esta enzima se llamó más tarde superóxido dismutasa. Este descubrimiento constituyó uno de los avances más importantes en la biología debido a que sugirió por vez primera que los RL de O2 se producen in vivo en cantidades significativas. El hallazgo de McCord y Fridovich demostró que todos los organismos aerobios pueden sobrevivir gracias a que tienen mecanismos antioxidantes de defensa frente a las ERO. Además, r epresentó un descubrimiento de gran importancia que revolucionó el pensamiento científico y contribuyó a comprender muchos fenómenos y procesos biológicos. Sobre la base de este descubrimiento se comenzaron a encontrar evidencias que demostraban la generación in vivo de ERO y la participación de estas en numerosas enfermedades humanas. |
| 1973 | Babior y colaboradores en un artículo publicado en Journal of Clinical Investigation reportaron que una de las principales acciones bactericidas de los leucocitos era la generación enzimática de O2·-, H2O2 y otros productos oxidantes como el ácido hipocloroso (HOCL). De esta forma se demostró que las células inflamatorias pueden mediar tanto respuestas del hospedero al ataque de microorganismos (beneficiosas) como reacciones inflamatorias adversas. |
| 1978 | El grupo de McCord y Fridovich demuestra que la toxicidad biológica del O2·- se debe fundamentalmente a la formación del radical hidroxilo (·OH). |
Summary
Oxygen reactive species and redox balance, part I: basic aspects and main oxygen reactive species
The redox balance has been increasingly recognized as a critical component of the aging process; the onset and development of diseases causing dramatic morbidity and mortality (atherosclerosis, cancer, central nervous system diseases, autoinmune diseases, ischemia-reperfusion damage, among others) and oxidative stress-induced cellular responses. Closely related to oxidative stress is the generation of oxygen reactive species, which cause direct cell damage in addition to acting as second intracellular messengers when modulating signal transduction pathways. The present paper presented the main antecedents of pieces of research related to this topic and described the most important characteristics of the oxygen reactive species.
Key words: Oxidative stress, free radicals, oxygen reactive species.
Referencias bibliográficas
1. Siân B, Astley, David G. European Research on the Functional Effects of Dietary Antioxidants. Mol Aspec Med. 2002;23(Suppl):1-38.
2. Marcus SC, Mark DE, Miral D, Joseph L. Oxidative DNA damage: mechanisms, mutation, and disease. FASEB J. 2003;17:1195-214.
3. Mukul D, Kishore B, Naveen PR, Lalit MS. Oxidative damage of plasma proteins and lipids in epidemic dropsy patients: Alterations in antioxidant status. Biochim Biophys Acta. 2005;1722:209-17.
4. Yogesh CA, Rajendra S, Cheng JZ, Yusong Y, Abha S, Sharad SS, et al. Role of 4-hydroxynonenal in stress-mediated apoptosis signaling. Mol Aspects Med. 2003;24:219-30.
5. Wulf D. Free Radicals in the Physiological Control of Cell Function. Physiological Rev. 2002;82:47-95.
6. Joe M. McCord. The Evolution of Free Radicals and Oxidative Stress. Am J Med. 2000;108:652-9.
7. Halliwell B, Gutteridge JMC. Free Radicals in Biology and Medicine. 2 ed. Oxford UK: Clarendon Press; 1989.
8. Scheele CW. Chemische Abhandlung von der Luft und dem Feuer. Uppsala and Liepzig. Secction 2. En: Schelle CW. The collected papers of Carl Wilhelm Scheele, Bell and Sons, London 1931 y Kraus Reprint Co. New York ; 1971. p. 85-178.
9. Priestley J. Experiments and observations on different kinds of air. Vol. II. Sections III-V. En: Priestley J, The discovery of oxygen. Part I. Edinburgh : The Alembic/club; 1923 .p. 29-103.
10. Sadie WC, Haugaard N. Oxygen poisoning V. The effect of high oxygen pressure upon enzymes: Succinil dehydrogenase and cytochrome oxydase. J Biol Chem. 1945;161:75-80.
11. Tjioe G, Haugaard N. Oxygen inhibition of crystalline glyceraldehide phosphate dehydrogenase and disappearance of enzyme sulphydryl groups. Life Sci. 1972;11:329-35.
12. Cabelli DEI, Bielski BHJ. Kinetics and Mechanism for the Oxidation of Ascorbic Acid/Ascorbate by H 2 O 2 /O 2 Radical. J Phys Chem. 1983;87:1809-12.
13. Aruoma OI. The Antioxidant Action of N-acetylcysteine: Its Reaction with H 2 O 2 , · OH, O 2 ·- y HOCl. Free Rad Biol Med. 1989;6:593-7.
14. Schoneich C. Thiyl Radical Attack on Polyunsaturated Fatty Acids. Biochem Biophys Res Commun. 1989;161:113-20.
15. Brent JA, Rumack BH. Role of Free Radicals in Toxic Hepatic Injury I. Free Radical Biochem. ClinToxicol. 1993;31:139-71.
16. Haber F, Weiss J. The Catalytic Decomposition of Hydrogen Peroxide by Iron Salts. Proc R Soc Ser A. 1934;147:332-52.
17. Aruoma OI, Halliwell B, Mahmood N, Burke A, Greenspan HC. Characterization of Drugs as Antioxidant Prophylactics. Free Rad Biol Med 1996;20:675-705.
18. Goldstein S. The Felton Reagents. Free Radic Biol Med. 1993;15:435-45.
19. Groutveld M, Halliwell B. Aromatic Hydroxylation as a Potential Measure of · OH Formation in vivo. Biochem J. 1988;237:499-504.
20. Grisham MB , McCord JM. Chemistry and Cytotoxicity of Reactive Oxygen Metabolites. En: Taylor AE, Matalon S, Ward P, editors,Physiology of Oxygen Radicals. Maryland: American Physiological Society; 1986. p. 1-18.
21. Thomas MM, Guy AZ, Stephen MP. Biologically Active Oxidized Phospholipids. J Biol Chem. 1999;274:25189-92.
22. Southorn PA, Powis G. Free Radicals in Medicine I. Chemical Nature and Biologic Reactions. Mayo Clinic Proc. 1988;63:381-9.
23. Jackson R, Morrow JD. Products of the isoprostane pathway: unique bioactive compounds and markers of lipid peroxidation. Cell Mol Life Sci. 2002;59:808-20.
24. Girotti AW. Introduction to serial reviews on regulatory and cytoprotective aspects of lipid hydroperoxide metabolism. Free Rad Biol Med. 2002;33:153.
25. Halliwell B. How to Characterize a Biological Antioxidant. Free Rad Res Comms. 1990;9:1-32.
26. Moncada S, Palmer RMJ, Higgs EA. Nitric Oxide: Physiology, Pathophysiology, and Pharmacology. Pharmacol Rev. 1991;43:109-43.
27. Claudio N, Louis JI. Nitric Oxide–Releasing Drugs. Ann Rev Pharmacol Toxicol. 2003;43:97-123.
28. Maxwell AJ. Mechanisms of Dysfunction of the Nitric Oxide Pathway in Vascular Diseases. Nitric Oxide: Biolo Chem. 2002;6:101-24.
29. Rojkind M, Domínguez-Rosale JA, Nieto N, Greenwel P. Role of hydrogen peroxide and oxidative stress in healing responses. CMLS Cell Mol Life Sci. 2002;59:1-20.
30. Weiss SJ. Tissue Destruction by Netrophils. New Engl J Med. 1989;320:365-76.
31. Ren-Feng G, Ward PA. Mediators and regulation of neutrophil accumulation in inflammatory responses in lung: insights from the IgG immune complex model. Free Rad Biol Med. 2002;33:303-10.
32. G regorio MS, Igor P, Saied MA, Rosemeres HD, Attilia G, Olga Sonia LF . Contribution to characterization of oxidative stress in diabetic patients. Acta Farm Bonaerense. 2005; 24:197-203.
33. Saed MAD, Taimy CR, Gregorio MS, Edilene FB, Olga Sonia LF. Equilibrio Redox en la Diabetes y sus Complicaciones. Acta Farm Bonaerense 2004;23:231-42.
34. Gilberto PT, Attilia G, Gregorio MS. Oxygen Free Radical and Antioxidant Defense Mechanism in Cancer. Front Biosci. 2004;9: 2029-44.
35. Lizette G, Gregorio MS, Rolando T, Osvaldo C, Daniel G, Lídice B. Oxidative Stress in Adult Dengue Patients. Am J Trop Med Hyg. 2004;71:652-7.
36. Lidianis L, Lizette G, Gregorio MS, Attilia G, Ivón G, Alicia T, et al. Effects of increase micronutrients intake on oxidative stress indicators in HIV/AIDS patients. Int J Vit Nut Res. 2005;75:19-27
Recibido: 26 de junio de 2005. Aprobado: 28 de julio de 2005.
Dr. Gregorio Martínez Sánchez. Apartado Postal 4301. Zona Postal 10400, Ciudad de La Habana, Cuba. Correo electrónico: gregorio@cieb.sld.cu