Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.41 n.1 Ciudad de la Habana ene.-abr. 2007
Artículos originales
Centro de Investigación y Desarrollo de Medicamentos
DaonilÒ y glibenclamida 5 mg de producción nacional: liberación in vitro
Diana Pereda Rodríguez1 y Lisette Martínez Miranda2
Resumen
Dentro del proceso global de la liberación de un fármaco, la disolución es el paso más importante pues está íntimamente relacionado con los procesos de absorción, determinantes en la biodisponibilidad de un medicamento administrado por vía oral. En el presente trabajo se realizaron los perfiles de disolución de 2 lotes de DaonilÒ (Hoechst Farma SA, Barcelona), medicamento líder del principio activo glibenclamida (DCI), y de 3 lotes de glibenclamida 5 mg de producción nacional. Los datos de porcentaje de principio activo liberado contra tiempo se sometieron a un estudio de ajuste a 4 modelos comunes a perfiles de disolución mediante el programa CurveExpert y se realizó la comparación estadística de los perfiles de disolución con la utilización de un método independiente de modelo matemático (f2: factor de similitud). Los lotes estudiados no cumplen con los criterios de la Food and Drug Administration (FDA) para los estudios de equivalencia in vitro y muestran diferencias significativas (p 0,05) sus perfiles de disolución.
Palabras clave: Glibenclamida, Daonil, disolución, comparación de perfiles de disolución.
En la actualidad se hacen necesarios los estudios de liberación in vitro en las etapas de Investigación-Desarrollo y control de calidad de medicamentos; en esta fase se realizan los perfiles de disolución y se obtienen las curvas de porcentaje de liberación contra tiempo las cuales deben ser similares a las curvas obtenidas para los correspondientes líderes de demostrada eficacia y seguridad.1-3 La FDA (Food and Drug Administration) considera como equivalentes al nivel de la liberación,2 formas farmacéuticas iguales que contengan el mismo fármaco a la misma dosis, cuando los ensayos disolución in vitro indican que por lo menos el 60 % del fármaco está solubilizado en 30 min y por lo menos el 85 % en 1 h.4 Otra de las finalidades de los ensayos de disolución es que sirven de base para intentar establecer una buena correlación entre velocidades de disolución y velocidad de absorción, de tal forma que, de ser posible, los ensayos de disolución in vitro informen acerca de la biodisponibilidad del fármaco en la forma de dosificación fabricada.5
La glibenclamida es una sulfonilurea con similar acción y uso que la clorpropamida. Después de una dosis única de glibenclamida las concentraciones de glucosa en sangre disminuyen en 3 h a su concentración basal y el efecto persiste alrededor de 15 h, lo mismo ocurre con la concentración de insulina cuando se ingiere el medicamento conjuntamente con alimentos al cabo de 2 h. La glibenclamida es rápidamente absorbida desde el tracto gastrointestinal, es excretada al igual que sus metabolitos por las heces fecales y por la orina. Este medicamento esta indicado para el tratamiento de la diabetes mellitus no insulino-dependiente.6,7 La obtención de formulaciones de glibenclamida para administración oral con un adecuado perfil de disolución y buena biodisponibilidad es un problema no resuelto en el ámbito mundial; estudios de 15 formulaciones en el mercado alemán demuestran diferencias significativas en los perfiles de disolución en sus fases iniciales que coinciden con diferencias en el paso a sangre por procesos de absorción. Un estudio posmercadeo realizado con 142 formulaciones de tabletas de 28 países demostró que aun cuando los productos cumplían los requisitos de identidad, pureza, valoración y uniformidad de contenido existían marcadas diferencias en sus perfiles de disolución causantes de fallos terapéuticos.8 El objetivo de este trabajo es la comparación de los perfiles de disolución de 3 lotes de glibenclamida de producción nacional con dos lotes de DaonilÒ (Hoechst Farma) medicamento líder.
Métodos
Se utilizaron 3 lotes (8124, 8125, 8126) elaborados en los laboratorios Medsol (Ciudad de La Habana, Cuba) y 2 lotes (M001, M004) de Daonil® de la firma (Hoechst Farma SA, Barcelona) como producto de referencia.
En la realización de los perfiles de disolución se utilizó un disolutor ERWEKA DT 6 RE Alemania, donde se utilizaron las siguientes condiciones de acuerdo con reportes de la literatura.9
Aparato: II (paleta).
Medio de disolución: 500 mL de solución amortiguadora fosfato pH= 7,6 a 37 ± 0,5 ºC
Velocidad de agitación: 75 rev . min-1.
La cuantificación del principio activo se realizó por cromatografía líquida de alta resolución (CLAR), para lo cual se utilizó una columna LiChrospherÒ 60 RP-18 (5 mm) de 250 x 4 mm de longitud, fase móvil: Acetonitrilo: solución amortiguadora fosfato pH= 3,0, flujo 2 mL/min a una longitud de onda de 300 nm. Las muestras se inyectaron directamente y se cuantificaron con una curva de calibración del material de referencia nacional de glibenclamida disuelto en el mismo medio. Se realizó además la valoración del principio activo en los lotes estudiados.10
El procesamiento estadístico se realizó mediante el programa Microcal Origin (Versión 5.0), con la utilización de la prueba de 2 poblaciones para el análisis de las medias, con un nivel de significación de 0,05.
Los datos de porcentaje de principio activo liberado contra tiempo para los lotes de producción nacional y los lotes de medicamento líder fueron sometidos a un estudio de ajuste a 4 modelos comunes a perfiles de disolución mediante el programa CurveExpert, el cual aplica una combinación de los métodos no lineales de máximo gradiente y de Newton, se obtiene un coeficiente de correlación r y un error estándar de estimación s como parámetros para evaluar la bondad de ajuste. Los modelos explorados fueron: modelo de orden cero, modelo de primer orden, modelo de raíz cúbica, función de Weibull.
Para comparar estadísticamente los datos generados en los perfiles de disolución del medicamento líder y el medicamento de producción nacional se utilizó un modelo independiente para calcular f2, que mide la similitud del porcentaje de disolución entre las curvas, y se comprueba que dos curvas son iguales si f2 es mayor de 50 y cercano a 100.11,12
El cálculo del factor de similitud (f2), se realizó a través de la ecuación siguiente:
![]()
donde:
n= número de puntos en el tiempo.
Rt= pomedio del porcentaje disuelto del producto de referencia en cada intervalo de tiempo.
Tt= pomedio del porcentaje disuelto del producto a ensayar en cada intervalo de tiempo.
Resultados
En la tabla 1 se reportan los resultados en porcentaje de glibenclamida disuelta con respecto al tiempo para 6 tabletas de cada lote del producto líder Daonil®. En la tabla 2 se reportan los resultados en porcentaje de glibenclamida disuelta con respecto al tiempo para 6 tabletas de cada lote de fabricación nacional.
Tabla 1. Resultados de los porcentajes de disolución de DaonilÒ (Hoechst Farma) con respecto al tiempo en 500 mL de solución amortiguadora fosfato pH= 7,6 a 37 ± 0,5 ºC, 75 rev . min-1, aparato II
| Tiempo | Lote M001 | Lote M004 | ||
| Media | DE | Media | DE | |
| 5 | 22,0 | 3,7 | 25,0 | 1,5 |
| 10 | 32,2 | 2,5 | 33,1 | 0,8 |
| 20 | 39,9 | 1,6 | 43,3 | 1,5 |
| 30 | 46,4 | 1,9 | 50,9 | 1,3 |
| 45 | 53,4 | 2,1 | 57,2 | 1,5 |
| 60 | 56,3 | 2,8 | 65,2 | 1,7 |
| 120 | 64,8 | 2,8 | 74,8 | 1,7 |
Tabla 2. Resultados de los porcentajes de disolución de glibenclamida de producción nacional con respecto al tiempo en 500 mL de solución amortiguadora fosfato pH= 7,6 a 37 ± 0,5 ºC, 75 rev . min-1, aparato II
| Tiempo | Lote 8124 | Lote 8125 | Lote 8126 | |||
| Media | DE | Media | DE | Media | DE | |
| 5 | 12,6 | 1,4 | 14,0 | 0,7 | 11,0 | 0,8 |
| 10 | 18,3 | 1,3 | 19,8 | 0,9 | 16,0 | 0,8 |
| 20 | 26,7 | 1,3 | 27,0 | 0,8 | 24,4 | 1,2 |
| 30 | 32,3 | 1,3 | 33,0 | 0,5 | 30,7 | 0,9 |
| 45 | 39,1 | 1,4 | 38,5 | 0,5 | 35,6 | 0,9 |
| 60 | 43,9 | 1,6 | 43,4 | 0,6 | 40,1 | 0,9 |
| 120 | 54,5 | 1,9 | 54,5 | 1,0 | 51,6 | 1,3 |
Los resultados de los mejores ajustes a modelos se muestran en tabla 3.
Tabla 3. Resultados del ajuste a modelos mediante el programa CurveExpert
| DaonilÒ, medicamento de referencia | Glibenclamida, medicamento de producción nacional (mejor ajuste) |
| Ecuación orden uno Q = Qi *(1,0-exp(Kd*(t-t0)) Q¥ = 71,03 Kd = -0,02 t0 = -10,30 Error estándar: 3,44 Coeficiente de correlación: 0,979 | Ecuación orden uno Q = Qi *(1,0-exp(Kd*(t-t0)) Q¥ = 56,83 Kd = -0,02 t0 = -7,54 Error estándar: 1,64 Coeficiente de correlación: 0,993 |
| Q¥: valor asintótico de disolución; Kd: constante de disolución; t0: tiempo de latencia | |
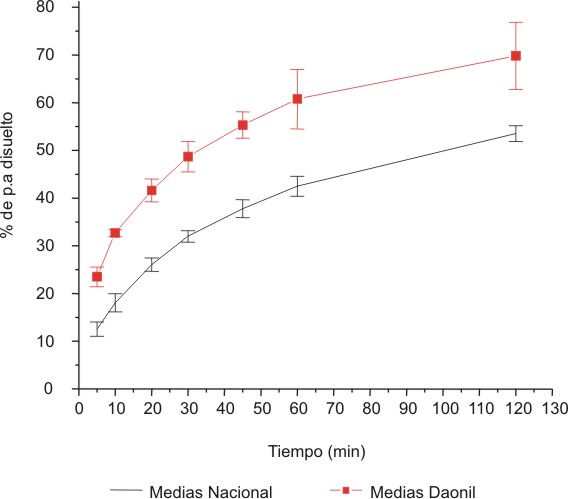
En la figura se muestran los gráficos de los valores medios de porcentaje de glibenclamida disuelta en función del tiempo para los tres lotes del líder y del producto nacional.
Fig. Valores medios de disolución Daonil® y glibenclamida producida en Cuba, en 500 mL de solución amortiguadora fosfato pH= 7,6 a 37 ± 0,5 ºC, 75 rev . min-1, aparato II.
En la tabla 4 se reporta el resultado de f2 obtenido en la comparación estadística de los perfiles de disolución.
Tabla 4. Resultados de f2 obtenido en la comparación estadística de los perfiles de disolución
| Tiempo | Promedio de porcentaje de liberación. Medicamento de referencia (DaonilÒ) | Promedio de porcentaje de liberación. Medicamento de producción nacional |
| 5 | 23,5 | 12,6 |
| 10 | 32,7 | 18,1 |
| 20 | 41,6 | 26,1 |
| 30 | 48,7 | 32,0 |
| 45 | 55,3 | 37,8 |
| 60 | 60,8 | 42,5 |
| 120 | 69,8 | 53,5 |
| f2 | 41,4 | |
En la tabla 5 se reportan los resultados analíticos de la valoración de los lotes estudiados.
Tabla 5. Resultados analíticos de la valoración del principio activo en las tabletas.
| Glibenclamida DCI | Lotes | Valoración (%) |
| DaonilÒ, medicamento de referencia | M001 | 97,0 |
| M004 | 93,7 | |
| Medicamento de producción nacional | 8124 | 101,8 |
| 8125 | 99,0 | |
| 8126 | 99,6 |
DCI: denominación común internacional.
Discusión
El Daonil® o medicamento líder, liberó mayor cantidad de principio activo desde los primeros tiempos muestreados con respecto a los lotes nacionales y aunque los valores se encontraban alrededor del 50 % a los 30 min para el medicamento líder; estos no cumplieron con la condición establecida por la FDA para los estudios de equivalencia in vitro. En el caso de la glibenclamida de producción nacional tampoco se cumplió este criterio.
Como resultado de la comparación estadística entre los porcentajes de liberación de la DaonilÒ (Hoechst Farma) y la glibenclamida de producción nacional para cada uno de los tiempos muestreados se obtuvo que existen diferencias significativas punto a punto para una probabilidad de 0,05.
Los resultados de los ajustes a modelos se muestran en la tabla 3. Como se puede apreciar los lotes de Daonil, producto líder de importación, y los lotes de glibenclamida de producción nacional tienen un mejor ajuste con el modelo de primer orden; lo que demuestra que son casos de funciones exponenciales relacionadas con los procesos físico-químicos que ocurren en una tableta en el proceso de disolución con superficie variable en el tiempo.4
El resultado de la comparación estadística de los perfiles (tabla 4) demuestra que el valor de f2 obtenido se encuentra por debajo de 50, límite inferior para este factor, por tanto no se cumple la condición de similitud de porcentaje de liberación entre las 2 curvas, es decir, las curvas no son equivalentes, lo que reafirma los resultados antes expuestos.
Está bien establecido que la biodisponibilidad y, por ende, la respuesta terapéutica a la glibenclamida a cualquiera de sus dosis es dependiente del comportamiento de su disolución ya que la velocidad de su absorción está relacionada con su velocidad de disolución. Las formulaciones con más de 80 % de liberación en 10 min han resultado bioequivalentes.8 En este estudio se puso de relieve que existen diferencias significativas (p < 0,05) entre el perfil de la formulación cubana y el Daonil®, la liberación al cabo de las 2 h fue baja en todos los casos y no cumplen los requisitos de la FDA para equivalencia in vitro. Aun cuando la valoración del principio activo en ambas formulaciones cumplen con los límites establecidos en la BP 2000 12 (tabla 5), los porcentajes de principio activo disueltos en cada medicamento hasta las 2 h son bajos, con una entrega lenta e incompleta y estas diferencias pueden ser responsables de fallos terapéuticos en la práctica clínica.8
Summary
Daonil ® and glibenclamide 5 mg of national production: release in vitro
Dissolution is the most important step in the global release process of a drug, since it is closely related to the absorption processes, which are determinant in the bioavailability of a drug administered by oral route. The dissolution profiles of two batches of Daonil® (Hoechst Farma SA Barcelona), a leading drug of the glibenclamide active principle (DCI), and of 3 batches of glibenclamide 5 mg of national production were studied. The percentage data of the active principle released against time were subjected to a study of adjustment of 4 models to common dissolution profiles by the CurveExpert program, and the statistical comparison of dissolution profiles was made by using a mathematical independent model (f2: similarity factor). All the batches studied do not fulfill the criteria of the Food and Drug Administration (FDA) for the in vitro equivalence studies and showed significant differences in their dissolution profiles.
Key words: Glibenclamide, Daonil®, dissolution, dissolution profile comparison.
Referencias bibliográfícas
- FDA. Guidance for Industry: Dissolution Testing of Immediate Release Solid Oral Dosage Forms. CDER. BP1 August, 1997. p. 1-6.
- Hanson WA . Handbook of dissolution testing. 2 ed. Eugene , Oregon : Aster Publishing; 1991. p. 2-23.
- FID. Guidelines for Dissolution Testing of Solid Oral Products. 1995. p. 11, 23.
- Domenech J, Mariño E. III curso de biofarmacia y farmacocinética experimental y clínica. Barcelona: Universidad, Facultad de Farmacia; 1991. p. 1-15.
- Amidon GL, Robinson JR, Williams RL. Scientific foundations for regulating drug product quality. AAPS Press, 1997. p. 399.
- Compendium of Pharmaceuticals and Specialties. 31 ed. Ottawa , Ontario : Canadian Pharmaceutical Association; 1996. p.1402-3.
- Martindale. The extra pharmacopoeia. 28 ed. London : Pharmaceutical Press; 1982. p. 854.
- Blume H, Ali SL, Siewert M. Pharmaceutical quality of glibenclamide products. A multinational postmarket comparative study. Drug Dev Ind Pharm. 1993;19(20):2713-41.
- Muñoz E, González E, Alfonso H, Armas R de. Estudios de bioequivalencia en formulaciones de glibenclamida. Ensayos de disolución de dos fases. Rev Cubana Farm. 1987;21(2):231-42.
- British Pharmacopoeia 2000. The Stationery Office Ltd. May, 2000. Versión 4.0:55-19.
- Amidon GL, Lennernas H, Shah VP, Crison JR. Theoretical basis for a biopharmaceutical drug classification: Correlation of in vitro drug product dissolution and in vivo bioavailability. Pharm Res. 1995;12(3):413-20.
- FDA. Guía para Industria. Exenciones de los estudios de biodisponibilidad y bioequivalencia in vivo para formas posológicas orales sólidas de liberación inmediata en base a un sistema de clasificación biofarmacéutica (CDER). 2000.
Recibido: 11 de octubre de 2006. Aprobado: 17 de noviembre de 2006.
Lic. Diana Pereda Rodríguez. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). Ave. 26 No. 1605 entre Boyeros y Puentes Grandes, municipio Plaza de La Revolución. La Habana, CP 10 600, Cuba. Correo electrónico: diana@cidem.quimefa.cu
1 Licenciada en Ciencias Farmacéuticas. Investigadora Agregada.
2 Licenciada en Bioquímica. Investigadora Auxiliar.