Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.41 n.1 Ciudad de la Habana ene.-abr. 2007
Pontificia Universidad Javeriana
Interferencias en la validación del ensayo de lisado de amebocitos de Limulus para oxitetraciclina 50 mg/mL
Olga Osorio Rojas,1 Ximena Carolina Pérez Mancilla,1 Janeth Arias Palacios,2 Dora Marcela Rodríguez Vargas1 y Cindy Marlene Fernández López1
Resumen
El análisis de endotoxina por medio del lisado de amebocitos de Limulus (LAL) es uno de los principales ensayos en el control de calidad de la fabricación de inyectables por su repercusión en la salud humana y animal, razón por la que se requiere la validación de la técnica para los productos parenterales. Se empleó el método de LAL gel-clot para validar la detección de endotoxina bacteriana en la oxitetraciclina producida por un laboratorio maquilador de productos farmacéuticos veterinarios de Bogotá, Colombia. Para este objetivo se tomaron muestras al inicio, intermedio y final de 3 lotes diferentes del medicamento y se realizó la prueba de validación tal y como lo especifica la United States Pharmacopea XXV. Los resultados para la máxima dilución válida del producto (1:80) de la prueba Spike mostraron el 100 % de inhibición hasta la dilución 1:16 y 0 % de inhibición en las siguientes diluciones. En la prueba Unspike se muestra un realce de la prueba a partir de la dilución 1:32. El rótulo para un reactivo de LAL con sensitividad (l) de 0,25 unidades de endotoxinas por mililitro (UE/mL) y el operario que realizó el ensayo quedaron validados.
Palabras clave: Endotoxina, lisado de amebocitos de Limulus (LAL), máxima dilución válida, Spike, Unspike, validación.
En la actualidad los principales organismos a nivel internacional, encargados de regular la elaboración de productos farmacéuticos exigen cada vez más en sus protocolos de calidad la aplicación del ensayo de lisado de amebocitos de Limulus (LAL), en el control de calidad en la fabricación de medicamentos administrados por vía intravenosa. Esto teniendo en cuenta que la presencia de pirógenos en estas y su subsiguiente administración provoca respuestas fisiológicas severas que pueden provocar la muerte. Así pues, las endotoxinas bacterianas se refieren al complejo de lipopolisacáridos asociados con la membrana externa de las bacterias gramnegativas como Escherichia coli, Salmonella, Shigella, Neisseria, y otros patógenos importantes.1,2
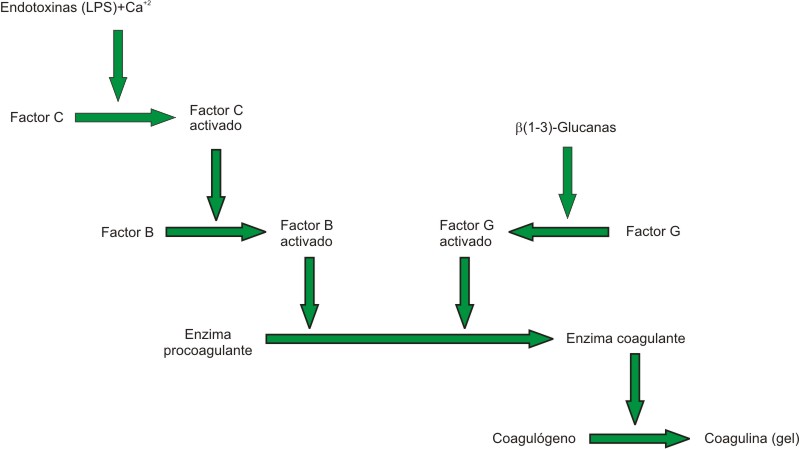
Ahora bien, el método de LAL se fundamenta en la coagulación de la hemolinfa por medio de la interacción de la endotoxina con los amebocitos contenidos en esta, causando la liberación de una cascada de reacciones que hacen que se forme un gel visible y consistente (fig. 1).3-5 Muchos productos interfieren con el ensayo del LAL, no obstante, es tan sensible que detecta las cantidades de endotoxinas que son de interés. Para realizar la validación de la técnica el producto debe ser diluido para eliminar la interferencia siempre y cuando aun permita que la concentración crítica de endotoxinas sea detectada.6,7
Tomado de: Perdomo 2004.
Fig. 1. Cascada de reacción de LAL activado por endotoxinas para formar gel.
Entre los factores que pueden inhibir o incrementar la reacción de coagulación están el pH, los cationes divalentes, los agentes quelantes, los excipientes, el material de vidrio y el magnesio, entre otros.8
Por otra parte, es importante resaltar que la validación, entendida como la obtención de pruebas convenientemente documentadas demostrativas de que un proceso es lo suficientemente confiable como para producir el resultado previsto dentro de intervalos definidos,9 y toma cada día más importancia para las autoridades sanitarias, lo cual ha llevado a todas las empresas productoras o maquiladoras de productos farmacéuticos a disponer de documentación detallada de la validación de los sistemas, equipos y procesos de fabricación, así como la validación de los métodos analíticos. El objetivo del presente estudio fue validar la prueba de endotoxinas por el método de LAL para un producto farmacéutico, oxitetraciclina (50 mg), en un laboratorio de servicios farmacéuticos veterinarios, mediante pruebas preliminares de interferencia de inhibición y realce entre el producto y el reactivo de LAL.
Métodos
Muestreo
El producto farmacéutico inyectable que se ensayó fue oxitetraciclina 50 mg suministrado por un laboratorio de servicios farmacéuticos. Las muestras se tomaron por medio de un muestreo aleatorio simple. Se seleccionó una muestra al inicio, intermedio y final de cada lote, con una diferencia mínima de una semana por lote y de conformidad con la programación de producción del laboratorio. El número de lotes por producto usado para el desarrollo del proyecto fue de tres, por lo tanto se obtuvieron 9 muestras al final.
Ensayo de endotoxinas bacterianas
Preparación de las muestras
El material de vidrio utilizado fue apirogénico y la preparación de las muestras se hizo asépticamente para evitar contaminación. Para garantizar una correcta despirogenización (reducción en al menos 3 ciclos logarítmicos de la carga de endotoxinas) por medio de calor seco, las condiciones se controlaron permanentemente a 250 °C por 30 min. Se midió el pH de las muestras, considerando que debía estar en un intervalo de 6,0-8,0.
Procedimiento de la validación
- Generalidades
La prueba de LAL por el método gel-clot se realizó adicionando 0,1 mL del reactivo de LAL de sensitividad l = 0,25 UE/mL con 0,1 mL de la muestra. El tubo se agitó suave pero completamente, se incubó en un baño de agua no circulante a 37 ± 1 ºC por 60 ± 2 min. Al final de este periodo de incubación, se retiró el tubo del baño y se invirtió en un ángulo de 180 ºC para realizar la lectura.
- Valoración del operario y sensitividad del LAL
Se prepararon muestras con concentraciones conocidas de endotoxina, mediante diluciones a partir del control estándar de endotoxina con potencia de 5 000 UE/mL (reconstituido con agua LWR según recomendaciones del proveedor) para obtener concentraciones de 1,0 (4l); 0,5 (2l); 0,25 (l); 0,125 (1/2l) y 0,06 (1/4l) UE/mL. Se adicionó 0,1 mL de reactivo LAL (reconstituido según indicadores del fabricante con agua LWR) a 0,1 mL de cada dilución en análisis (1,0; 0,5; 0,25; 0,125 y 0,06 UE/mL) y a los controles negativos, consistentes en 0,1 mL de agua libre de pirógenos, en un tubo de vidrio (10 x 75 mm) despirogenizado, se realizó el análisis por cuadruplicado a cada dilución, se puso en baño de María a 37 ºC durante 1 h y una vez completado el tiempo se realizaron las lecturas. Se determinó la desviación estándar y promedio geométrico para el analista.
-
Estimación de la máxima dilución válida
Se calculó la máxima dilución válida (MDV) que puede ser aplicada a cada producto terminado utilizando la fórmula del LAL para la MDV: MDV= límite de endotoxina (UE/mL)/sensitividad del LAL.10
En la ecuación el límite de endotoxina corresponde al límite permitido por la USP, para el caso de la oxitetraciclina fue 0,4 UE/mg. La sensitividad del reactivo de LAL fue 0,25 l.
- Ensayos preliminares
Para la realización de los ensayos preliminares de los lotes de producto terminado se practicaron las diluciones de volumen final de 0,1 mL de acuerdo con el cálculo de la MDV por duplicado, en agua para el caso del ensayo Unspike (realce), o en una concentración conocida de endotoxina, que en este caso fue 0,5 UE/mL (2l) para el ensayo Spike (inhibición). Se analizaron además controles negativos consistentes en 0,1 mL de agua libre de pirógenos. Se probaron todas las muestras con 0,1 mL de reactivo de LAL, se incubaron y se determinó su absorbancia.
- Tratamiento estadístico de los resultados
Se llamó punto final al último punto en el cual se midió un valor de absorbancia positivo. A cada punto final se le calculó el logaritmo. Una vez obtenidos los respectivos logaritmos se halló la sumatoria (å) y luego el promedio (
). Con el valor del promedio (
) se calculó el promedio geométrico (GM) según la ecuación:
GM = antilog ![]()
El promedio debía encontrarse entre l/2 y 2/l , para que los resultados fuesen válidos.
La desviación estándar (sn–1 ), también se calculó con base en los datos obtenidos al calcular el logaritmo del punto final, según la fórmula:
donde:
n=
número de datos
X= logaritmos punto final
Resultados
Preparación de las muestras
Al momento de medir el pH al producto a analizar se obtuvo un valor de 7,2, que no ocasiona interferencia con los ensayos, razón por la que no fue necesario realizar un ajuste de pH.
Validación del operario y la sensitividad del reactivo de LAL
El valor de la sensitividad (l) del reactivo dictado por el certificado entregado por el proveedor es de 0,25 UE/mL. En primera instancia se realizó el ensayo de validación de sensitividad y operario (realizado simultáneamente) con el agua producida por la empresa, la cual pasa por un sistema de osmosis reversa y ultrafiltración, que demostró no ser apta para realizar los ensayos posteriores; esto teniendo en cuenta que en los ensayos realizados los controles negativos (realizados con agua de la empresa) dan valores positivos. Por esta razón el agua utilizada fue agua comercial libre de pirógenos.
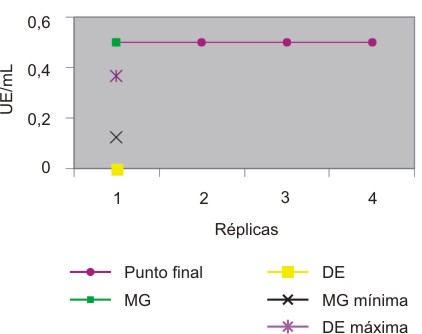
Al realizar nuevamente la validación de la sensitividad y el operario con agua apirógena, los valores de la media geométrica y la desviación estándar fueron de 0,5 y 0 respectivamente. Los resultados de este ensayo se muestran en la figura 2. Los valores de la media geométrica y la desviación estándar para estos ensayos, realizados simultáneamente, fueron de 0,5 y 0 respectivamente.
Fig. 2. El operario y la sensitividad se encuentran dentro de los parámetros establecidos.
Máxima dilución válida
Ya que la oxitetraciclina 50 mg se encuentra incluida en las monografías de la United States Pharmacopea, se calculó el valor de la MDV con base en el límite de endotoxina encontrado en la USP XXV (0,4 UE/mg), de la siguiente manera siguiente:
- Se expresó el límite de endotoxina en UE/mL:
0,4 UE/mg (límite de endotoxina)* 50 mg/mL (potencia del producto)= 20 UE/mL (límite de endotoxina en UE/mL)
- Se halló la MDV utilizando el valor de la sensitividad o l y el límite anteriormente hallado:
La MDV para oxitetraciclina 50 mg fue 1:80, lo que significa que no debe diluirse más de 1:80 el producto en los ensayos preliminares.
Conforme a esto se prepararon diluciones de producto para las pruebas Spike y Unspike hasta la dilución 1:64 que es el múltiplo de 2 anterior a 1:80.
Ensayos preliminares
Los ensayos preliminares son útiles para determinar la dilución de trabajo para el producto. El primer lote de oxitetraciclina utilizado fue el 31 967 con una presentación de 500 mL.
Ensayo de inhibición (Spike)
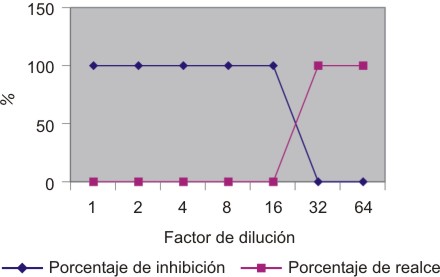
Se contaminó la muestra con endotoxina equivalente a 2l (0,5 UE/mL), esperándose por ende, formación de un gel firme en todas las diluciones. Los resultados se evidencian en la figura 3, donde se muestra inhibición hasta la dilución 1:16.
Fig . 3. En el ensayo Spike (inhibición) se evidencia una inhibición total de la reacción hasta una dilución 1:16 y a partir de la dilución 1:32 se dan resultados positivos, mientras que en el ensayo Unspike (realce) se muestra un realce de la prueba en las diluciones 1:32 y 1:64.
Ensayo de realce (Unspike)
Se realizaron diluciones del producto en agua libre de pirógenos, esperándose resultados negativos. Tal y como se muestra en la figura 3, existe realce de la prueba ya que se formó gel en las diluciones 1:32 y 1:64.
Discusión
Se realizaron todos los procedimientos tal y como lo indica la USP XXV11 y el proveedor del producto. El método utilizado para realizar el ensayo de LAL fue el de gelificación, debido a que es sensible, reproducible, sencillo; se diferencia fácilmente un resultado positivo y uno negativo, es ampliamente usado y además implica menos costos que otros métodos como el cromogénico.12
En lo referente a los reactivos empleados, deben tenerse en cuenta 2 parámetros como son la sensitividad del reactivo de LAL (l) y la potencia del control de endotoxina estándar (CSE), que en nuestro caso fueron l = 0,25 y 5 000 UE/mL. Estos parámetros son dictados por el certificado de calidad entregado por el proveedor, que garantiza que se está utilizando un CSE con la potencia indicada.
La sensitividad (l) del reactivo es importante porque por medio de esta se define qué concentración de endotoxina se quiere detectar, razón por la cual debe asegurarse que este valor (l) sea el mismo o cercano a lo que dicta el certificado. En nuestro caso particular, el reactivo mostró tener una sensitividad de 0,5 UE/mL, lo que significa que detecta a partir de dicha concentración de endotoxina, y no a partir de 0,25 UE/mL como dictaba el certificado. Este fenómeno pudo deberse a variables como el almacenamiento, el procedimiento de rehidratación o la manipulación.13
Es probable entonces que si se forma un gel viscoso en una prueba, pero este no mantiene su integridad, se encuentren endotoxinas en el producto o en lo que se esté analizando, pero en concentraciones menores a la sensitividad del reactivo.
La potencia del CSE es importante porque a partir de esta se realizan diluciones para valorar al reactivo, lo que puede ocasionar un cambio dramático en el estimado de la sensitividad si no se reconstituye de la forma adecuada. Además, también se valora al operario que va a realizar las pruebas, por ende, del buen manejo del CSE también puede depender la confiabilidad de los resultados de la validación del ensayo de LAL. Por estas razones es importante seguir un esquema estandarizado y preciso para mezclar y diluir el CSE, así se asegura la reproducibilidad de los resultados.13
En los primeros resultados se determinó que el agua de la empresa no era apta para realizar el ensayo, por cuanto los controles negativos y las últimas diluciones de endotoxina mostraron datos positivos. Es entonces de gran trascendencia que el agua tenga buenos parámetros fisicoquímicos y sea apirógena, porque esta va a ser usada para realizar diluciones de producto, ocasionando falsos resultados positivos si no cumple con estos requisitos. Por la misma razón es importante usar controles negativos durante la prueba que muestren que el agua no está interfiriendo con los resultados.
Es preciso ejecutar ensayos en los que se valide el operario, ya que de la realización de diluciones y el depósito exacto de las cantidades estipuladas de cada reactivo siguiendo procedimientos estandarizados, depende el éxito, la confiabilidad y la reproducibilidad del ensayo de LAL. El operario también debe asegurar que no se está introduciendo endotoxina durante la manipulación. Por esta última razón, es de carácter fundamental que todos los equipos que use el operario estén libres de endotoxina y que sean los más adecuados para realizar el ensayo.
La MDV para oxitetraciclina 50 mg/mL indicó que solo era posible diluir el producto hasta 1:80, ya que a diluciones mayores no es posible detectar el valor límite de endotoxina. Por este motivo se realizaron los ensayos hasta la dilución 1:64. Además se escogió esta dilución debido a que el factor de dilución que se utiliza es de 2, y 64 es el múltiplo de 2 anterior más cercano a 80, lo que permite mayor facilidad a la hora de hacer el ensayo.
En lo referente a los ensayos preliminares realizados para oxitetraciclina 50 mg, cabe anotar que en el ensayo Spike se denota una interferencia inhibitoria hasta la dilución 1:16 de producto; los resultados de las diluciones 1:32 y 1:64 resultan positivos. Se descarta el pH como inhibidor en la prueba ya que este fue tomado previo al ensayo y fue cercano a 7, aunque existen diversas variables que también pueden contribuir a que se dé este fenómeno inhibitorio. Entre estas encontramos diferentes componentes de los productos, como alcoholes, sustancias inmiscibles con el reactivo y agentes quelantes como el EDTA disódico, que es empleado en el laboratorio en la producción de oxitetraciclina 50 mg/mL, y que podría enlazar los cationes divalentes causando inhibición en la reacción de coagulación. El porcentaje de inhibición es de cero a partir de la dilución 1:32, lo que daría a pensar que el componente que causa esta interferencia en el ensayo desaparece o está presente en niveles insignificantes a partir de esta dilución.
En el ensayo Unspike, que permite ver el realce de la prueba, ya sea por presencia de endotoxina o cualquier otro compuesto que induce la reacción enzimática, se observaron resultados positivos en las diluciones 1:32 y 1:64, lo que indica que el producto analizado no podía quedar validado por cuanto alguno de sus múltiples componentes como el cloruro de magnesio podían potenciar un resultado positivo. Según Tsuji y Steindler en 1983,14 el magnesio incrementa la sensibilidad de LAL de diferentes formas; por ejemplo, actuando en la fase inicial del reconocimiento de la endotoxina modificando su tamaño para una identificación más fácil por el LAL, o acelerando la tasa de producción de la reacción en cascada, o contribuyendo a la formación de un gel más firme formando puentes sobre las micelas del gel. Existen otras razones por las que se pueden observar resultados positivos en la prueba Unspike, como la aparición de endotoxina en el producto, o la presencia de sustancias como los glucanos y la tripsina. Los valores negativos de las primeras diluciones en esta prueba, son coherentes con la respuesta presentada en los ensayos Spike, que presentan inhibición hasta la dilución 1:16, razón por la que no se observó el realce de la prueba sino en las 2 últimas diluciones.
Por sugerencia del proveedor de los reactivos, y para corroborar los resultados de los ensayos preliminares, específicamente en Unspike, se realizó una prueba de rutina utilizando la MDV, volviéndose a obtener resultados positivos en cada uno de los 3 lotes muestreados. Ya que el agua de la empresa no fue apta para realizar la validación del rótulo y del operario, y a partir de esta misma se fabrica la oxitetraciclina. Se tomó la determinación de asegurar la ausencia de pirógenos en el agua y el resto de la materia prima para poder realizar la validación del producto terminado.
Esta prueba, como todos las prácticas por las que se realizan mediciones, permite tener controles en los procesos productivos, manifestando problemas si los hubiere y permitiendo tomar diversas decisiones sobre los procedimientos, materiales y equipos. Por esta razón, aunque la oxitetraciclina no haya sido validada para realizar análisis de LAL, y los resultados no hayan sido los esperados, estos ayudan a dilucidar todos aquellos factores en la fabricación del producto que pueden interferir en cuanto a su calidad, y cambiar a favor de las necesidades que tiene la empresa, como lo es una certificación; para lo que es necesario la validación de las pruebas de endotoxina. Igualmente, aportan porque se puede tener un mayor control de todos los parámetros que pueden a llegar a causar falencias en el resultado de los ensayos de LAL, en oxitetraciclina o cualquier otro producto del laboratorio que requiera una valoración de endotoxinas bacterianas.
Agradecimientos
Agradecemos la colaboración y ayuda de Janeth Arias, e igualmente a Valerio Castaño y a Marcela Rodríguez por permitir el desarrollo de este proyecto.
Tomado de: Perdomo 2004
Summary
Interferences in the validation of the Limulus amebocyte lysate for oxytetracyline 50 mg/mL
The endotoxin analysis by the Limulus amebocyte lysate (LAL) assay is one of the main tests in the quality control of the manufacture of injectables due to their repercussion on human and animal health. That's why the validation of the technique is required for parenteral products. The LAL gel-clot method was used to validate the detection of bacterial endotoxin in the oxytetracycline produced by a veterinary pharmaceutical laboratory of Bogota-Colombia. To this end, samples were taken at the beginning, interval and end of 3 different batches of the medicine and the test of validation was made just as it is specified in the United States Pharmacopea XXV. The results for the Maximum Valid Dilution of the product (1:80) of the Spike test showed a 100 % of inhibition until dilution 1:16, and 0 % of inhibition in the following dilutions. In the Unspike test, it is seen an enhancement of the test from dilution 1:32. The label for a reagent of LAL with sensitivity (l) of 0.25 UE/mL and the operator who made the test made were validated.
Key words: Endotoxin, Limulus Amebocyte Lysate (LAL), maximum valid dilution, Spike, Unspike, validation.
Referencias bibliográficas
- Todar K. Mechanisms of bacterial pathogenicity: endotoxins. University of Wisconsin-Madison Department of Bacteriology. 2002. [Cited Mar 2004]. Available from: http://textbookofbacteriology.net/endotoxin.html
- Iriarte MJ, Ugarte JC. Utilidad de la determinación de endotoxinas en diferentes ambientes laborales como indicador de riesgo por agentes biológicos MAGFRE Medicina. 2001;12(4):234-40.
- Perdomo M R. Ensayo del lisado de amebocitos de Limulus (LAL). Revista Cubana Farm. 2004;38(1). [citado Oct 2004]. D isponible en: http://bvs.sld.cu/revistas/far/vol38_1_04/far08104.htm
- Roth R, Tobia, PS. Lipopolysaccharide-binding proteins of Limulus amebocyte yeast. Infection Immunity. 1993;61(3):1033-9.
- Speer BR. 2003. Xiphosura: Horseshoe crabs. Associates of Cape Cod Inc. Routine testing and retest. LAL Update. Jun 1997;15(2). [Cited Mar 2004]. Available from: http://www.ucmp.berkeley.edu/arthropoda/chelicerata/ xiphosura.html
- Cooper J. Validation of bacterial endotoxins test methods. LAL Times. 1999;6(2).
- Agudelo CM. V aloración de endotóxinas bacterianas en sueros antiofídicos de origen equino, optimización de métodos en control de calidad. Bogotá: Universidad Nacional de Colombia; 1999.
- Chaloner-Larsson G, Anderson R, Egan A. Guía de la OMS sobre los requisitos de las prácticas adecuadas de fabricación (PAF). II parte: Validación. Ginebra. 1998. [citado Feb 2004] . Disponible en: http://www.who.ch/gpv-documents
- Guidance for Human and Veterinary Drus Products & Biologicals. Departament of health and human services, Public health services, Food & Drug Administration, appendix E. USA. Julio, 1991.
- United States Pharmacopeia XXV. The US Pharmacopeial Convention, Inc. Rockville: Marck Printing; 2001.
- Górny R, Douwes J, Versloot P, Heederik, D, Dutkiewicz J. Application of the Classic Limulus Test And The Quantitative Kinetic Chromogenic Lal Method For Evaluation of Endotoxin Concentration In Indoor Air. Ann Agric Environ Med. 1999;6:45-51
- Rastogi S, Seligmann E, Hochstein D, Dawson J, Farag, L. Statistical procedure for evaluating the sensitivity of Limulus Amoebocyte Lysate by using a Reference lysate. Appl Environ Microbiol. 1979;38(5):911-5.
- Tsuji K, Steindler K. Use of Magnesium To Increase Sensitivity of Limulus Amoebocyte Lysate for Detection of Endotoxin. Appl Environ Microbiol. 1983;45(4):1342-50.
Recibido: 11 de octubre de 2006. Aprobado: 17 de noviembre de 2006.
Olga Osorio Rojas . Pontificia Universidad Javeriana. Sede Bogotá D.C. Carrera 7 No. 40-62. Bogotá, Colombia. Correo electrónico: osorioo@javeriana.edu.co