Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.42 n.2 Ciudad de la Habana Mayo-ago. 2008
ARTÍCULOS DE REVISIÓN
Fundamentos del uso clínico de la eritropoyetina como neuroprotector
Foundations of the clinical use of erythropoietin as a neuroprotective agent
Alain Valdivia AcostaI; Gregorio Martínez SánchezII
I Licenciado en Ciencias Farmacéuticas. Centro de Estudios para las Investigaciones y Evaluaciones Biológicas. Instituto de Farmacia y Alimentos, Universidad de La Habana (IFAL-UH) La Habana, Cuba.
II Doctor en Ciencias Farmacéuticas. Investigador Titular. Centro de Estudios para las Investigaciones y Evaluaciones Biológicas. IFAL-UH La Habana, Cuba.
RESUMEN
Hace aproximadamente una década, se reportaron por primera vez, las propiedades neuroprotectoras de la eritropoyetina en estudios preclínicos. Todavía no se ha podido esclarecer con firmeza el posible mecanismo de acción neuroprotector de esta hormona, pero existen varias hipótesis. La eritropoyetina ha mostrado buenos resultados en preclínica como agente neuroprotector y todavía queda mucho camino por recorrer para lograr una adecuada efectividad y seguridad en la clínica en este sentido. Se investiga para lograr una eritropoyetina con actividad neuroprotectora que carezca, o al menos tenga disminuida su actividad hematopoyética. Disminuir sus efectos adversos, lograr una significativa biodisponibilidad al sistema nervioso central, alargar el tiempo de vida media y con ello evitar una alta frecuencia de administración al paciente, es lo que principalmente se está buscando. En este trabajo se realizó una búsqueda sobre los mecanismos de acción neuroprotectora hasta ahora propuestos para la eritropoyetina y se detallaron importantes consideraciones a tomar en cuenta, que pudieran influir sobre su utilización en la clínica.
Palabras clave: Eritropoyetina, neuroprotector, clínica, mecanismo de acción, efectos adversos, seguridad.
ABSTRACT
The neuroprotective properties of erythropoietin were reported for the first time in preclinical studies approximately a decade ago. The possible mechanism of neuroprotective action of this hormone has not been cleared yet, but here are diverse hypotheses. Erythropoietin has showed good results in preclinic as a neuroprotective agent and there is still a long way to go to attain an adequate effectivity and safety in the clinic in this sense. Research is being carried out to obtain an erythropoietin with neuroprotective activity that lacks or at least has a diminished hematopoietic activity. To reduce its adverse effects, to achieve a significant bioavailability to the central nervous system, to prolong its mean life and to avoid this way a high frequency of administration to the patient, is our main objective. In this paper, it is made a search of the mechanisms of neuroprotective action proposed for erythropoietin so far, and important considerations that may influence on its use in the clinic are stressed.
Key words: Erythropoietin, neuroprotective, clinic, mechanism of action, adverse effects, safety.
INTRODUCCIÓN
El mecanismo por el cual la eritropoyetina (Ep) actúa en el sistema nervioso central (SNC) todavía es materia de controversia. Recientes evidencias indican, que las actividades hematopoyéticas y tejido-protectoras de la Ep podrían estar separadas y que sus acciones hormonales y locales probablemente, ocurran por mecanismos con diferentes vías de señalización.1
Se conoce que los efectos hematopoyéticos de la Ep son mediados por un receptor homodimérico, mientras que el complejo receptor que media sus efectos neuroprotectores, difiere del primero en cuanto a la aparente afinidad para la Ep, masa molecular y proteínas asociadas.2,3
Se plantea que una región de la Ep no dentro de los dominios de unión clásicos del receptor de la eritropoyetina (Epr), puede estar asociada a efectos protectores en el SNC4 y que la Ep carbamilada o ciertas mutantes de la Ep que no se unen al Epr, son aun citoprotectores in vitro y neuroprotectores in vivo.5
Actualmente se conoce que cada uno de los receptores de membrana de la Ep se compone de una subunidad a única (que se requiere para la eritropoyesis) y de una subunidad común b.6 La subunidad común a del heteroreceptor, que es la subunidad compartida por receptores de factores de crecimiento estimulantes de colonias de granulocitos, macrófagos, IL-3 y IL-5,7 podría estar involucrada en los efectos neuroprotectores mediados por la Ep y sus derivados.8,9
Se están realizando estudios para obtener una región de la molécula de Ep, solamente con acción neuroprotectora.
Ofrecer una actualización de las acciones moleculares estudiadas hasta el momento de la Ep como neuroprotector y detallar importantes aspectos a tomar en cuenta, que pueden influir sobre su seguridad y efectividad en la clínica, son los principales objetivos de esta revisión.
La búsqueda y localización de la información incluyó una revisión de artículos científicos en la Base de Datos MEDLINE, entre los años 2000-2007, para lo cual se utilizaron los descriptores: eritropoyetina, neuroprotección, mecanismo de acción, seguridad y efectos adversos, fundamentalmente. Se localizaron las fuentes de información primaria (artículos originales). La búsqueda bibliográfica incluyó artículos científicos de revisión y de resultados experimentales. La mayoría de los artículos seleccionados estaban relacionados con la nueva propiedad neuroprotectora de la Ep, su mecanismo de acción, biodisponibilidad al cerebro, características moleculares, efectos adversos y uso en la clínica.
MECANISMOS DE ACCIÓN NEUROPROTECTORA DE LA Ep
Los mecanismos de la Ep con acción neuroprotectora parecen ser multifactoriales, con beneficios directos e indirectos sobre las neuronas. Los efectos biológicos de la Ep en el SNC son causados por activación de su receptor específico, seguido de las vías de señales de transducción correspondientes.
Aunque el mecanismo molecular exacto de los efectos neuroprotectores de la Ep no está totalmente aclarado, menos aun en el cerebro en desarrollo, se conoce que la Ep puede actuar a múltiples niveles.
Existen varios mecanismos posibles de neuroprotección la Ep y los más marcados se involucran con: 1) Mecanismos antiapoptóticos y generación de factores antiapoptóticos neuronales (inhibición de la apoptosis).9 2) Reducción de la toxicidad del glutamato (prevención de la toxicidad glutamato-inducida).10 3) Prevención del daño oxidativo con efectos antioxidantes directos, vía activación de enzimas antioxidantes e inhibición de la peroxidación lipídica (efectos antioxidantes).11 4) Disminución del daño mediado por inhibición de la producción de óxido nítrico (NO) (Inhibición de la producción de NO).12 5) Estímulo de la angiogénesis.9 6) Modulación de la neurogénesis.13 7) Reducción de la Inflamación (efectos antiinflamatorios).14 8) Prevención de la pérdida de autoregulación del flujo sanguíneo cerebral.9 9) Mantención del potencial de membrana mitocondrial (activando la proteína cinasa B).9 10) Inhibición de la formación de caspasa-3 y liberación de citocromo C.9
Por analogía de las células precursoras eritroides, localizadas en la médula ósea donde la Ep promueve la viabilidad celular por represión de la apoptosis, 15 se podría especular que mecanismos similares operan en células neuronales y endoteliales.
En relación a este mecanismo, la Ep al enlazarse a su receptor, activa la proteína tirosina-cinasa-2-Janus (JAK2) la cual fosforila moléculas involucradas en diferentes vías de señalización e incluyen la proteína mitogénica activadora cinasa RAS (MAPK), fosfatidil inositol-3-cinasa (PI3K-AkT), transductor de señal y activador de transcripción-5 (STAT-5)16 y el factor nuclear-kb (NF-kb). STAT 5 y NF-kb se translocan al núcleo y se enlazan al ADN, promoviendo expresión de genes antiapoptóticos (Bcl-xL y bcl-2), además de la expresión de la proteína inhibidora de apoptosis (IAP) y la superóxido dismutasa (SOD)17 (fig.).
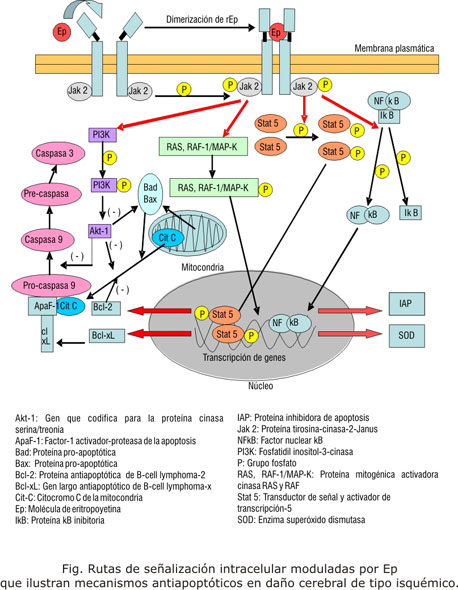
Recientemente se demostró que la Ep constituye un potente estímulo fisiológico para la movilización de células progenitoras endoteliales y estimula la neurovascularización neonatal.18 Como en el caso de las células precursoras eritroides y neuronales, la Ep parece ser un factor de sobrevida para células endoteliales a través de la activación de genes Akt-1 e inhibición de la liberación de citocromo C y la actividad de la caspasa.19 Además, el hecho de que las células endoteliales cerebrales expresen dos formas de ARNm para el Epr implica la angiogénesis activada por la Ep en cerebro.20 Parece ser que la Ep también puede influir directamente en la activación del receptor del factor de crecimiento endotelial (VEGF/VEGFr).15 En el daño cerebral experimental, la densidad de los microvasos cerebrales en la zona infartada, se incrementa después del tratamiento con Ep.
Como se conoce que los astrocitos contribuyen a la protección neuronal frente al estrés oxidativo por detoxificación de especies reactivas de oxígeno21 y la Ep aumenta la actividad cerebral de la glutatión peroxidasa, 22 los receptores de la Ep en los astrocitos pueden participar en la defensa astrocítica antirradical.
De forma general la neuroprotección por la Ep, puede estar dada por su acción directa en cualquier paso de la cascada isquémica: edema, ruptura de la homeostasis cálcica, excitoxicidad por calcio (Ca+2) y glutamato, generación de radicales libres y activación inmune, que conlleva a la muerte neuronal.15, 23
Por otra parte, la adición de la Ep a células neuronales, mostró propiedades protectoras contra los efectos del ácido kaínico,24 N-metil-D-aspartato15,25 (NMDA) y el ácido á-amino-3-hidroxi-5-metil-4-isoxazolepropiónico 26 (AMPA). La Ep previno muerte neuronal excitotóxica por agonistas del receptor del glutamato y bloqueó la liberación de Ca+2 inducido por glutamato en neuronas granulosas cerebrales inmersas en la isquemia química in vitro.10
Esta hormona previene la acción del glutamato en el correspondiente receptor27 y como consecuencia suprime la muerte celular isquémica por inhibición de exocitosis del glutamato. La sobreactivación de los receptores del glutamato puede conducir a una producción excesiva de NO, el cual después de la reacción con superóxido y formación de peroxinitrito induce muerte celular neuronal.15,23 Se ha propuesto que la Ep disminuye el NO mediado por daño isquémico, aunque no afecta las concentraciones basales de NO directamente.28,29
La Ep también reduce el reclutamiento de células inflamatorias,30 sin embargo, no afecta la producción de citocinas proinflamatorias en cultivos de astrocitos o células periféricas mononucleares sanguíneas.31 Su efecto antiinflamatorio puede ser en parte indirecto.32
Finalmente una expresión elevada de factores neurotróficos derivados del cerebro,32,33 puede contribuir a una neurogénesis incrementada una vez que se administra la Ep después del daño cerebral.33-35
CONSIDERACIONES PARA EL USO DE ERITROPOYETINA COMO NEUROPROTECTOR
En la década de los 80, varios estudios después de la identificación, aislamiento y clonación36 del gen de la Ep humana, impulsaron la obtención de esta hormona de forma recombinante mediante ingeniería genética.37 Este procedimiento ha permitido la provisión de grandes cantidades de Ep para el uso clínico terapéutico y para completar estudios químicos y biofarmacéuticos. La Ep humana recombinante (rHu-Ep) se ha empleado en el tratamiento de la anemia causada por diferentes afecciones como el cáncer, el SIDA, las afecciones renales y la cirugía; pero desde hace una década se investiga su efecto en la protección de las células cerebrales.15
El éxito de los estudios preclínicos ha sido confirmado por el primer estudio clínico con rHu-Ep en pacientes con daño cerebral agudo.38 A pesar de esto, existen importantes elementos a tomar en consideración para un futuro tratamiento con rHu-Ep en la clínica: 1) Reproducción de las propiedades neuroprotectoras de la Ep en humanos. 2) Posible enmascaramiento de las propiedades neuroprotectoras de la Ep durante el tratamiento. 3) Variaciones en la molécula (farmacocinética). 4) Paso a través de la barrera hematoencefálica. 5) Toxicidad. Efectos adversos. Administración junto a otras afecciones.
Reproducción de las propiedades neuroprotectoras de la Ep en humanos
El cerebro de los roedores, donde se prueban la mayoría de los productos con acción neuroprotectora hipotética, es comparativamente más pequeño en relación con el humano. El contenido de sustancia blanca, considerablemente inferior; por lo que una disminución del área o volumen del infarto en el modelo animal tendrá un valor poco significativo en el cerebro humano.39 La protección de la neurona no puede estar separada de la protección de la materia blanca. Sin la preservación de sus conexiones axonales con las células gliales, hay pocas probabilidades de lograr un beneficio funcional39 y puede que los efectos beneficiosos en humanos no sean igual de significativos que en animales.
Por otra parte, en la práctica, el tiempo en que aparece una isquemia y su tratamiento constituye un factor crítico que determina la eficacia de la neuroprotección. Se plantea que es muy poca la población que recibe la asistencia médica en un período menor a las 3 h de producida la isquemia.40 En neuroprotección la ventana terapéutica para el inicio del tratamiento más aceptada, se considera hasta las 12 h; sin embargo, existen experiencias que demuestran que la viabilidad de parte del tejido cerebral en penumbra isquémica puede extenderse más allá de 48 o 72 h.39
De ahí podemos inferir, que en dependencia de la farmacocinética de la rHu-Ep utilizada, su toxicidad y efectos adversos es recomendable que la duración del tratamiento se prolongue al menos 72 h.39
Posible enmascaramiento de las propiedades neuroprotectoras de la Ep durante el tratamiento
La no evaluación de las vías respiratorias, la presión arterial, la glicemia, fiebre e infecciones asociadas, puede aumentar la mortalidad y enmascarar el supuesto efecto beneficioso del fármaco estudiado.25,39,41-43
Vías respiratorias. Cuando el paciente es ingresado, resulta obligatoria la evaluación de sus vías respiratorias, investigar la presencia de cuerpos extraños y su capacidad para manejar las secreciones; deben realizarse las maniobras necesarias para mantener una adecuada ventilación. Lo anterior incluye la intubación orotraqueal. Deben evaluarse los gases arteriales y administrar oxígeno, para mantener una saturación de por lo menos 95 %,41 ya que la hipoxia empeora la evolución de la isquemia. Por otra parte, es necesario tener en cuenta, que la aparición de convulsiones compromete la oxigenación del paciente y por ello, deben ser rápidamente manejadas en la misma forma que cualquier otra convulsión. Para algunos autores resulta recomendable la hiperoxigenación del paciente, sin embargo, los beneficios de esta medida requieren comprobación.
Presión arterial. La evaluación de la circulación debe incluir tensión arterial, frecuencia del pulso y presencia de arritmias. Diversos trabajos en animales de experimentación han mostrado una relación directa entre el tamaño del infarto y los valores de tensión arterial, de tal manera, que el descenso de la presión arterial incrementa la extensión de la zona infartada. En humanos, los estudios clínicos revelan que la hipotensión ocasiona una disminución del flujo sanguíneo cerebral en el área lesionada, lo cual empeora la situación de la zona de penumbra. Como durante la isquemia la autorregulación cerebral se encuentra comprometida e incluso anulada y puede persistir por varias semanas en caso de oclusión prolongada,44 la perfusión en las áreas isquémicas está directamente relacionada a los valores de la presión arterial media. Por ello en hipertensos crónicos valores aparentemente normales de tensión arterial pueden constituir realmente hipotensión.
Glicemia. En condiciones de hipoxia e isquemia, el tejido cerebral es mucho más vulnerable a las alteraciones metabólicas e hidroelectrolíticas que en condiciones normales. En diversos estudios se ha encontrado una fuerte asociación entre la presencia de hiperglicemia y el incremento de la morbimortalidad. La influencia negativa de la glucosa, está relacionada con la perpetuación del metabolismo anaeróbico en la zona lesionada y la consiguiente producción de ácido láctico. Esto conduce a una intensa acidosis celular y edema cerebral, de tal manera, que los valores elevados de glicemia constituyen un factor predictivo, sin relación con la gravedad del ictus y la existencia de otros factores de riesgo cardiovascular.44
Fiebre. La elevación de la temperatura corporal y por ende, de la temperatura cerebral, produce empeoramiento de la isquemia neuronal. Esto conlleva a un incremento en su severidad, al aumento del tamaño del infarto, de la mortalidad y a un agravamiento del pronóstico. Por cada grado de elevación de la temperatura corporal el riesgo de mal pronóstico se incrementa por un factor de 2,2.44 Se ha demostrado que la hipertermia favorece respuestas inflamatorias nocivas, incrementa la lactacidosis y acelera la muerte neuronal,44 particularmente durante las primeras 24 h de evolución; de tal manera, que la fiebre de cualquier grado debe ser tratada con antipiréticos y su causa debe ser investigada.
El género y la edad también influyen en la efectividad de un neuroprotector y ha sido demostrado en la investigación con animales de experimentación39,45 y a nuestro criterio pueden ser perfectamente extrapolables al humano.
Variaciones estructurales de la molécula (farmacocinética)
Se conoce que la Ep nativa es una glicoproteína con una masa molecular de 30-35 kDa y la proteína madura tiene 165 aminoácidos que está altamente glicosidada (40 % de su peso).
El producto recombinante es estructuralmente muy similar a la Ep humana nativa, existiendo un péptido de 193-aminoácidos, del cual se escinde una secuencia principal de 27-aminoácidos. Las evidencias indican que el residuo de arginina en el extremo carboxiterminal ha sido también eliminado en ambas, la rHuEPO y la Ep nativa aislada de la orina humana.46 La proteína madura de 34 kDa y 165-aminoácidos, contiene 2 puentes disulfuro, 3 cadenas de carbohidratos con enlaces N a asparagina y 1 cadena de carbohidrato con enlace O a serina. Cada una de las cadenas ligada a N puede contener un máximo de 4 residuos de ácido siálico y la cadena ligada a O puede contener hasta 2 residuos de ácido siálico. Las unidades de carbohidrato y ácido siálico se requieren para la estabilidad in vivo.46 La variación de glicosilación de la proteína da lugar a cierta heterogeneidad de las moléculas de rHuEPO, existiendo varias isoformas46 que hacen variar algunos parámetros farmacocinéticos.
La remoción química o enzimática del ácido siálico (desialilación) expone un residuo galactosílico en la molécula que puede entonces ligarse rápidamente a receptores de galactosa en hepatocitos, lo que contribuye a su metabolización e influye entonces en su tiempo de vida media.37 Relacionado con lo anterior, en el año 1994, Masuda y otros compararon la Ep cerebral y la Ep del suero y encontraron que la Ep del cerebro era más pequeña (33 kDa) que la del suero (35 kDa) lo que puede estar dado por el diferente contenido de ácido siálico en ambas moléculas.
También se demostró, que asialoeritropoyetina (asialo-Ep) obtenida por desialilación enzimática de rHuEp, tuvo un tiempo de vida corto en plasma y una actividad neuroprotectora, en marcado contraste con rHuEp. La asialo-Ep en las dosis y frecuencias de administración en las cuales rHuEp exhibió eritropoyesis, no incrementó los valores de hematócrito en ratones y ratas.47 Por tal motivo para estimular la acción neuroprotectora endógena que tiene lugar en el cerebro ante un daño hipóxico, se debe utilizar una Ep con bajo contenido de ácido siálico, similar a la que este produce en estas condiciones.47 Así, podría prevalecer la actividad neuroprotectora y se minimizarían efectos eritropoyéticos indeseables, aunque existe el inconveniente de que sea metabolizada con mayor rapidez.
Por otra parte, una secuencia aminoacídica de Ep que no interactúa con el sitio de unión clásico Epr parece estar asociada con efectos protectores en el SNC y no a una actividad eritropyética.4 Adicionalmente, la vía de administración de la rHuEp también desempeña una importantísima función en la biodisponibilidad de la Ep en el cerebro.48
Paso a través de la barrera hematoencefálica (BHE)
La capacidad de la Ep para penetrar la BHE es fundamental en su uso como agente neuroprotector en el plano clínico. Cuando la Ep se administra en dosis apropiadas para la eritropoyesis (200-400 U/kg/dosis), no atraviesa la BHE en una cantidad detectable.49 Sin embargo, la Ep administrada de forma sistemática, produce concentraciones en el líquido cefalorraquídeo (LCR) que varían de 50-350 mU/mL a las 3-3,5 h después de la inyección en ratas adultas y primates no humanos.17 Cuando se administra en dosis supra-farmacológicas (2 000-5 000 U/kg/dosis)49-51 aumentan las concentraciones en LCR a 100 mU/mL en 30 min. Por muchos años se asumió que la Ep, una glicoproteína de gran peso molecular no atravesaba la BHE. Se pensó que era impermeable a moléculas > 500 Da. Resultados de varios estudios indicaron que la Ep endógena producida por el riñón, solamente tenía acceso al cerebro después de la pérdida de parte de la integridad de la BHE por un daño cerebral.49 Sin embargo, estudios con citocinas indicaron que un transporte preferencial a través de la BHE puede existir para algunos tipos de moléculas grandes49 y es ahora conocido que la Ep puede ser una de esas moléculas.
Estudios inmunohistoquímicos han demostrado que el Epr está presente en alta densidad, alrededor de capilares cerebrales en animales y humanos, lo que sugiere que la Ep circulante podría enlazarse a estos receptores y podría ser transportado a través de la BHE por transcitosis. Cuando grandes dosis de Ep son administradas sistemáticamente, esta aparece en el LCR; sin embargo, la transferencia es menos que el 1 % de la dosis administrada.49,52
Deben ser consideradas estrategias de alternativas terapéuticas, que de alguna manera logren eludir el limitado acceso de la Ep aplicada de forma intravenosa y ahí evitar la necesidad de dosis más altas de esta para obtener concentraciones protectoras en el SNC.
Minimizar el peligro de valores aumentados de hematócrito que resultan por las altas concentraciones de Ep y su administración repetida, debe ser una preocupación primaria. La viscosidad elevada de la sangre es causada por un alto hematócrito, lo que puede ocasionar déficit de perfusión sanguínea en el cerebro15 y en este caso no ayudaríamos al paciente. Una rHuEp con actividad neuroprotectora, que llegara al SNC evadiendo su paso por el hígado y la BHE, de forma más rápida y segura, sería bastante aceptable.
En los estudios preclínicos y clínicos donde se ha utilizado la rHuEp como neuroprotector, en sus diferentes variantes moleculares, se han escogido como vías de administración: la vía parenteral, la vía endovenosa, intraperitoneal, subcutánea e intracerebro-ventricular para hacer llegar la rHuEp al SNC. La última es clínicamente impracticable y las primeras requieren desde su aplicación hasta su acción, de un tiempo relativamente largo.
Recientemente se ha propuesto una nueva vía de administración que tiene grandes posibilidades y se acerca bastante a los criterios antes descritos: la vía nasal.53,54 En la parte superior de la cavidad nasal se encuentran las terminales nerviosas responsables de conducir la información del olor a través de la placa cribiforme.53 Una posible explicación del paso de la molécula por la vía intranasal, es su participación en un mecanismo más general y rápido. Mediante el proceso de difusión a través del mucus y ulterior permeación por las discontinuidades que se presentan en regiones del epitelio olfatorio, en particular en la lámina cribiforme, contactando con el LCR, la Ep puede ser ampliamente diseminada por el SNC.43 Ciertamente, hacer llegar la rHuEp al cerebro a través de la vía nasal permite evadir la BHE, podría ser más segura y 10 veces más rápida que la vía endovenosa,53 aunque todavía habría que investigar los efectos de la Ep en los receptores olfatorios y la posibilidad de nuevos efectos adversos indeseados.
La búsqueda de alternativas terapéuticas en adición a las consideraciones antes mencionadas, se desarrolla paulatinamente e incluye la obtención de moléculas con efecto solamente neuroprotector, es decir, sin acción eritropoyética.5
Efectos adversos. Toxicidad. Administración junto a otras afecciones
Como procoagulante, la Ep puede inducir desórdenes de la coagulación. Además, consecuencias a largo plazo como aplasia de glóbulos rojos que puede derivarse del desarrollo de anticuerpos anti-Ep. Esto se ha comunicado en pacientes adultos.46, 55
Los anticuerpos anti-Ep han sido detectados hasta ahora en pacientes tratados con rHuEp para controlar la anemia de la insuficiencia renal crónica. Esto no excluye que también puedan desarrollarlos pacientes tratados con rHuEp por anemia en otras afecciones como: el cáncer, SIDA, en estados preoperatorios de cirugía electiva, en el futuro tratamiento de daño cerebral e incluso en aquellos atletas que usan ilegalmente productos eritropoyéticos, para aumentar su rendimiento. La constatación de que el desarrollo de anticuerpos anti-Ep, que reaccionan de forma cruzada con otras proteínas eritropoyéticas, asociados con un cuadro de aplasia pura de células rojas, es una complicación no tan infrecuente como se creía. Esto añade un argumento de peso contra el empleo de las proteínas eritropoyéticas al margen de las indicaciones médicas establecidas.55
Por otra parte, la Agencia Española del Medicamento en su informe sobre riesgos de medicamentos para profesionales sanitarios en año 2002, consideró necesario contraindicar la utilización de epoetina alfa® (eritropoyetina humana) por vía subcutánea en pacientes con insuficiencia renal crónica56 (IRC). Esto se debió al aumento del número de casos de sospecha de aplasia pura de células rojas comunicados en pacientes con IRC a quienes se les administró epoetina alfa® por vía subcutánea.
Aunque la rHuEp es bien tolerada, su uso puede causar hipertensión, policitemia, efectos indeseados proangiogénicos, interrupción de la producción endógena de la Ep, encefalopatía hipertensiva, atereoesclerosis acelerada, ataques y eventos vasculares trombóticos;48 además de edema, pirexia y efectos gastrointestinales como vómitos, diarrea y enterocolitis necrotizante.9
Un estudio de toxicidad a dosis límite en ratas, efectuado por el Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB, Cuba), evaluó las variantes de rHuEp: iorEPO CIM® y EPO-hrTA® fabricadas por el Centro de Inmunología Molecular (CIM Cuba,) con demostrada similitud a formulaciones de referencia internacional. Ninguna de estas variantes provocó muertes, signos clínicos, modificaciones en el peso corporal, o cambios en las variables hematológicas que respondieran a efectos tóxicos por las sustancias de ensayo. La descripción de la necropsia tampoco reportó alteraciones anatomopatológicas.57
Es importante destacar que la seguridad probada por algunos estudios de rHuEp frente al tratamiento de la anemia no se debe asumir igual en pacientes con afecciones cerebrales. Esto es extremadamente peligroso, pues la interacción y la influencia de rHuEp en variables fisiológicas y con otros fármacos comúnmente usados en estos pacientes son desconocidas.1 Hay que tener bien claro el efecto de los posibles eventos adversos, su posible influencia en pacientes con otras afecciones agudas y crónicas y los mecanismos posibles de neuroprotección y acción eritropoyéticas de rHuEp que hasta ahora se conocen.
En recientes estudios controlados de la Ep con pacientes que padecían cáncer hubo un riesgo incrementado de eventos vasculares trombóticos o un efecto adverso en la progresión del tumor y en la mortalidad.58-60 Se debe tener en cuenta que además de los efectos adversos mencionados, la Ep provoca angiogéneis lo que pudiera facilitar y acelerar el proceso carcinogénico.
La Sociedad Americana de Oncología Clínica, la Sociedad Americana de Hematología61 y la unión Europea para la Investigación y Tratamiento del Cáncer62 han desarrollado de forma independiente, guías prácticas basada en evidencia clínica, para el uso de la Ep en pacientes con cáncer. Estas brindan una orientación minuciosa y confiable de cómo utilizar la Ep en estos pacientes.
Es importante que estudios clínicos más amplios se encaminen a determinar la seguridad, dosis óptimas tolerables, tiempo de ventana terapéutica y duración del tratamiento para esta nueva aplicación clínica de la Ep (neuroprotección), tomando en consideración todas las reflexiones que hemos analizado en el presente artículo de revisión y los nuevos conocimientos que se generen de la experimentación preclínica.
Por otra parte, la experimentación preclínica deberá centrar su atención en el desarrollo de péptidos o en Ep modificadas que permitan obtener un fármaco optimizado y selectivo para los efectos neuroprotectores, con capacidad de alcanzar la BHE por la vía de administración menos traumática.
AGRADECIMIENTOS
Agradecemos a los profesores del Diplomado: Balance antioxidante pro-oxidante/salud y enfermedad, del Instituto de Farmacia y Alimentos de la Universidad de La Habana, por su contribución a nuestra formación y a sus orientaciones en la confección del presente trabajo.
REFERENCIAS BIBLIOGRÁFICAS
1. Grasso G. Erythropoietin: A new paradigm for neuroprotrection. (Editorial). J Neurosurg Anesthesiol. 2006;18:91-2.
2. Fisher JW. Erythropoietin: physiology and pharmacology update. Exp Biol Med. 2003;228:1-14.
3. Bernaudin M, Bellail A, Marti HH, Yvon A, Vivien D, Duchatelle I, MacKenzie ET and Petit E. Neurons and astrocytes express EPO mRNA: oxygen-sensing mechanisms that involve the redox-state of the brain. Glia. 2000;30:271-8.
4. Buemi M, Caballaro E, Floccari F, Sturiale A, Aloisi C, Trimarchi M, et al. Erythropoietin and the brain: from neurodevelopment to neuroprotection. (Review). Clin Science. 2002;103:275-82.
5. Leist M, Ghezzi P, Grasso G. Derivatives of erythropoietin that are tissue protective but not erythropietic. Science. 2004;305:239-42.
6. Brines M, Grasso G, Fiordaliso F, Sfacteria A, Ghezzi P, Fratelli M, et al. Erythropoietin mediates tissue protection through an erythropoietin and common beta-subunit heteroreceptor. Proc Natl Acad Sci (USA). 2004;101:14907-12.
7. Hamilton JA. GM-CSF in inflammation and autoimmunity. Trends Immunol. 2002;23:403-8.
8. Brines M, Cerami A. Emerging biological roles for erythropoietin in the nervous system. Nat Rev Neurosci. 2005;6:484-94.
9. Sola A, Wen TC, Hamrick EG, Ferriero DM. Protection and Repair Following Injury to the Developing Brain: A Role for Erythropoietin? Pediatr Res. 2005;57(5):110-17.
10. Kawakami M, Sekiguchi M, Sato K, Kozaki S, Takahashi M. Erythropoietin receptor-mediated inhibition of exocytotic glutamate release confers neuroprotection during chemical ischemia. J Biol Chem. 2001;276:39469-75.
11. Solaroglu I, Solaroglu A, Kaptanoglu E, Dede S, Haberal A, Beskonakli E, et al. Erythropoietin prevents ischemia-reperfusion from inducing oxidative damage in fetal rat brain. Childs Nerv Syst. 2001;19:19-22.
12. Kumral A, Baskin H, Gokmen N, Yilmaz O, Genc K, Genc S, et al. Selective inhibition of nitric oxide in hypoxic-ischemic brain model in newborn rats: is it an explanation for the protective role of erythropoietin? Biol Neonate. 2004;85:51-4.
13. Shingo T, Sorokan ST, Shimazaki T, Weiss S. Erythropoietin regulates the in vitro and in vivo production of neuronal progenitors by mammalian forebrain neural stem cells. J Neurosci. 2001;21:9733-43.
14. Gorio A, Gokmen N, Erbayraktar S, Yilmaz O, Madaschi L, Cichetti C. Recombinant human erythropoietin counteracts secondary injury and markedly enhances neurological recovery from experimental spinal cord trauma. Proc Natl Acad Sci USA. 2002;99:9450-5.
15. Marti HH. Erythropoietin and the hypoxic brain (review). Exp Biology J. 2004;207:3233-42.
16. Chong ZZ, Kang JQ, Maiese K. Erythropoietin: cytoprotection in vascular and neuronal cells. Curr Drug Targets Cardiovasc Haematol Disord. 2003;3:141-54.
17. Juul S. Erythropoietin in the central nervous system, and its use to prevent hypoxic-ischemic brain damage. Acta Paediatr. 2002;91(Suppl):36-42.
18. Heeschen C, Aicher A, Lehmann R, Fichtlscherer S, Vasa M, Urbich C. Erythropoietin is a potent physiologic stimulus for endothelial progenitor cell mobilization. Blood. 2003;102:1340-6.
19. Chong ZZ, Kang JQ, Maiese K. Erythropoietin is a novel vascular protectant through activation of Akt1 and mitochondrial modulation of cysteine proteases. Circulation. 2002;106:2973-9.
20. Marti HH, Bernaudin M, Petit E, Bauer C. Neuroprotection and angiogenesis: a dual role of erythropoietin in brain ischemia. News Physiol Sci. 2000;15:225-9.
21. Dringen R, Hirrlinger J. Glutathione pathways in the brain. Biol Chem. 2003; 384:505-516.
22. Kumral A, Gonenc S, Acikgoz O, et al. Erythropoietin increases glutathione peroxidase enzyme activity and decrease lipid peroxidation levels in hypoxic-ischemic brain injury in neonatal rats. Biol Neonate. 2005;87:15-8.
23. Lee JM, Grabb MC, Zipfel GJ, Choi DW. Brain tissue responses to ischemia. J Clin Invest. 2000;106:723-31.
24. Siren AL, Fratelli M, Brines M, Goemans C, Casagrande S, Lewczuk P, et al. Erythropoietin prevents neuronal apoptosis after cerebral ischemia and metabolic stress. Proc Natl Acad Sci USA. 2001a;98:4044-9.
25. Cerami A, Brines M, Ghezzi P, Cerami C, Itri LM. Neuroprotective properties of erythropoietin alpha. Nephrol Dial Transplant. 2002;17(1):8.
26. Sinor AD, Greenberg DA. Erythropoietin protects cultured cortical neurons, but not astroglia, from hypoxia and AMPA toxicity. Neurosci Lett. 2000;290:213-5.
27. Buemi M, Cavallaro E, Floccari F, Sturiale A, Aloisi C, Trimarchi M, et al. The pleiotropic effects of erythropoietin in the central nervous system. J Neuropathol Exp Neurol. 2003;62:228-36.
28. Digicaylioglu M, Lipton SA. Erythropoietin-mediated neuroprotection involves cross-talk between Jak2 and NF-KB signalling cascades. Nature. 2001;412:641-7.
29. Calapai G, Marciano MC, Corica F, Allegra A, Parisi A, Frisina N, et al. Erythropoietin protects against brain ischemic injury by inhibition of nitric oxide formation. Eur J Pharmacol. 2000;401:349-56.
30. Villa P, Bigini P, Mennini T, Agnello D, Laragione T, Cagnotto A, et al. Erythropoietin selectively attenuates cytokine production and inflammation in cerebral ischemia by targeting neuronal apoptosis. J Exp Med. 2003;198:971-5.
31. Vairano M, Dello Russo C, Pozzoli G, Battaglia A, Scambia G, Tringali G, et al. Erythropoietin exerts anti-apoptotic effects on rat microglial cells in vitro. Eur J Neurosci. 2002;16:584-92.
32. Wang L, Zhang Z, Wang Y, Zhang R, Chopp M. Treatment of stroke with erythropoietin enhances neurogenesis and angiogenesis and improves neurological function in rats. Stroke. 2004;35:1732-7.
33. Viviani B, Bartesaghi S, Corsini E, Villa P, Ghezzi P, Garau A, et al. Erythropoietin protects primary hippocampal neurons increasing the expression of brain -derived neurotrophic factor. J Neurochem. 2005;93:412-21.
34. Lu D, Mahmood A, Qu C, Goussev A, Schallert T, Chopp M, et al. Erythropoietin enhances neurogenesis and restores spatial memory in rats after traumatic brain injury. Proc Natl Acad Sci USA. 2002;99:2258-63.
35. Sirén AL, Radyushkin K, Boretius S, Kämmer D, Riechers CC, Natt O. Global brain atrophy after unilateral parietal lesion and its prevention by erythropoietin. Brain. 2006;129:480-9.
36. Marsden TJ. Erythropoietin-measurement and clinical applications. Ann Clin Biochem. 2006;43:97-104.
37. Malgor LA, Valsecia ME. 2000. Farmacología Médica. Volumen 4. Farmacología de la hematopoyesis, farmacología gástrica, farmacología del dolor: AINES y opioides, anestésicos locales y generales y bloqueantes neuromusculares. [Citado 3 Abr 2002]. Disponible en: http://med.unne.edu.ar/catedras/farmacologia/temas_farma/indice_v4.htm
38. Tolias CM, Bullock MR. Critical appraisal of neuroprotection trials in head injury: What have we learned? Neuro Rx. 2004;1:71-9.
39. Sosa TI, García SJD, Subirós N, González C, Rodríguez Y, García RJC. Alternativa terapéutica en la isquemia cerebral empleando la eritropoyetina humana recombinante (rHu-EPO) como neuroprotector. Rev CNIC Cienc Biol. 2005; 36(No. Especial):CB-49. [citado 20 Oct 2006]. Disponible en: http://revistas.mes.edu.cu/eduniv/03RevistasCientificas /Rev.CENICCienciasBiologicas/2005/e/09105e049.pdf
40. Navarro T, Henríquez D. Aspectos fisiopatológicos de la neuroprotección: en busca del tiempo perdido. Cuadernos de Neurología [en línea] 2000 [Acceso 10 Oct 2006]; 21. Disponible en: http://escuela.med.puc.cl/paginas/publicaciones/Neurologia/cuadernos/2000 /pub_01_2000.htm
41. Auer RN. Non-pharmacologic (physiologic) neuroprotection in the treatment of brain ischemia. Ann N Y Acad Sci. 2001;939:271-82.
42. Sirén AL, Ehrenreich H. Erytropoietin a novel concept for neuroprotection. Eur Arch Psychiatry Clin Neurosci. 2001;251:179-84.
43. Hoke JF, Dyker AG, Barnaby R, Lees KR. Pharmacokinetics of a glycine antagonist (gavestinel) following multiple dosing in patients with acute stroke. Eur J Clin Pharmacol. 2000;55:867.
44. Marcano TM. Neuroprotección en enfermedad cerebro vascular. Gac Méd Caracas. 2004;112(1):3-13.
45. Bohemi M, Grasso G. In vivo evidence that erythropoietin has a neuroprotective effect during subarachnoid hemorrhage. Eur J Pharmacol. 2000;392:31.
46. Peces R. Anticuerpos anti-Eritropoyetina recombinante (Comentario Editorial). Nefrología. 2003;XXIII(1):10-12.
47. Erbayraktar S, Grasso G, Sfacteria A, Xie QW, Coleman T, Kreilgaard M, et al. Asialoerythropoietin is a nonerythropoietic cytokine with broad neuroprotective activity in vivo. Proc. Natl. Acad. Sci. USA. 2003;100:6741-6.
48. Hasselblatt M, Ehrenreich H, Sirén AL. The brain erythropoietin system and its potential for therapeutic exploitation in brain disease. J Neurosurg Anesthesiol. 2006;18:132-8.
49. Brines ML, Ghezzi P, Keenan S, Agnello D, Lanerolle NC, Cerami C, et al. Erythropoietin crosses the blood-brain barrier to protect against experimental brain injury. Proc Natl Acad Sci USA. 2000;97:10526-53.
50. Ehrenreich H, Hasselblatt M, Dembowski C, Cepek L, Lewczuk P, Stiefel M, et al. Erythropoietin therapy for acute stroke is both safe and beneficial. Mol Med. 2002;8:495-505.
51. Ehrenreich H, Degner D, Meller J, Brines M, Behe M, Hasselblatt M, et al. Erythropoietin: a candidate compound for neuroprotection in schizophrenia. Mol Psychiatry. 2004;9:42-54.
52. Juul SE, McPherson RJ, Farrell FX, Jolliffe L, Ness DJ, Gleason CA. Erythropoietin concentrations in cerebrospinal fluid of nonhuman primates and fetal sheep following high-dose recombinant erythropoietin. Biol. Neonate. 2004;85;138-44.
53. Sosa TI, García Rodríguez JC, García Salman JD, Santana J, Subirós MN, González TC. Intranasal administration of recombinant human erythropoietin exerts neuroprotective effects on post-ischemic brain injury in Mongolian gerbils. Pharmacologyonline 2006 [cited 2006 Dec 3];1:100-112. Available from: http://www.pharmacologyonline.unisa.it/archivies/2006 /volume1/8_SosaTeaste.pdf
54. Yu YP, Xu QQ, Zhang Q. Intranasal recombinant human erythropoietin protects rats against focal cerebral ischemia. Neurosci Lett. 2005;387(1):5-10.
55. Casadevall N, Nataf J, Viron B, Kolta A, Kiladjian JJ, Martin-Dupont P, et al. Pure red-cell aplasia and antierythropoietin antibodies in patients treated with recombinant erythropoietin. N Engl J Med. 2002;346:469-75.
56. AEMPS. Epoetina alfa: contraindicación de la administración por vía subcutánea en pacientes con insuficiencia renal crónica. Agencia Española del Medicamento sobre riesgos de medicamentos para profesionales sanitarios. [En línea] 2002 [citado 9 Sept 2006]. Nota Informativa. Disponible en: http://www.agemed.es/actividad/alertas/usoHumano/seguridad /epoetina_dic02.htm
57. Arteaga PM, León GA, Bada AB, Piedra SP, Fuentes MD. Toxicidad a dosis límite de la EpHur (IORR EPOCIM y la EPO-HR TA) por vía endovenosa en ratas. Anuario Toxicología. 2001;1(1):48-56.
58. WHO. Erythropoietin: caution in cancer patients. WHO Drug Information. 2005;19(2):110-11.
59. Henke M, Laszig R, Rübe C, Schäfer U, Haase KD, Schilcher B, et al. Erythropoietin to Treat Head and Neck Cancer Patients With Anaemia Undergoing Radiotherapy: Randomised, Double-Blind, Placebo-Controlled Trial. Lancet 2003;362:1255-60.
60. Leyland-Jones B. Breast cancer trial with erythropoietin terminated unexpectedly. Lancet Oncology. 2003;4:459-60.
61. Rizzo JD, Lichtin AE, Woolf SH, Seidenfeld J, Bennett CL, Cella D, et al. Use of epoetin in patients with cancer: Evidence-based clinical practice guidelines of the American Society of Clinical Oncology and the American Society of Hematology. J Clin Oncol. 2002;20:4083-107.
62. Bokemeyer C, Aapro MS, Courdi A, Foubert J, Link H, Osterborg A, et al. EORTC guidelines for the use of erythropoietic proteins in anaemic patients with cancer. Eur J Cancer. 2004;40:2201-16.
Recibido: 9 de enero de 2008.
Aprobado: 11 de febrero de 2008.
Lic. Alain Valdivia Acosta. Centro de Estudios para las Investigaciones y Evaluaciones Biológicas. Instituto de Farmacia y Alimentos. Universidad de La Habana. Ave. 23 No. 21425 e/ 214 y 222, La Lisa, La Habana 4, Cuba. Correo electrónico: armando@cieb.sld.cu














