Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.43 n.1 Ciudad de la Habana ene.-abr. 2009
TRABAJOS ORIGINALES
Efecto neuroprotector de una formulación nasal de eritropoyetina con bajo contenido de ácido siálico
Neuroprotective effect of a nasal formulation of erythropoietin with low sialic acid content
Yanier Nuñez FigueredoI; Viviana Bueno PavónII; Carmen Carrillo DomínguezIII; Narda Jiménez AlemánIV; Odalys Valdés MartínezV; Vivian Montero AlejoIV; Adriana Muñoz CernudaVI; Esther Alonso JiménezIII
ILicenciado en Ciencias Farmacéuticas. Master en Farmacología. Investigador Agregado. UCTB Control Biológico, Centro de Investigación y Desarrollo de Medicamentos (CIDEM). La Habana, Cuba.
IIEspecialista en Anatomía Patológica. UCTB Control Biológico, CIDEM. La Habana, Cuba.
IIITécnico Medio en Farmacia. UCTB Control Biológico, CIDEM. La Habana, Cuba.
IVLicenciada en Ciencias Farmacéuticas. Investigadora Aspirante. UCTB Tecnologías Complejas, CIDEM. La Habana, Cuba.
VTécnico Medio en Anatomía Patológica. UCTB Control Biológico, CIDEM. La Habana, Cuba.
VILicenciado en Ciencias Farmacéuticas. Master en Tecnología y Control. Investigador Agregado. UCTB Tecnologías Básicas, CIDEM. La Habana, Cuba.
RESUMEN
La administración intranasal de eritropoyetina humana recombinante con bajo contenido de ácido siálico (rHu-EPOb) puede ser empleada como un agente neuroprotector eficaz en el tratamiento de la isquemia cerebral. En el presente trabajo fueron administradas 10 µg de rHu-EPOb 3 veces al día durante 2 días, comenzando inmediatamente antes de la inducción de la isquemia focal transitoria en ratas. Los resultados demostraron que la administración nasal de rHu-EPOb mejoró significativamente el comportamiento neurológico en animales sometidos a isquemia focal transitoria y disminuyó el área de infarto en las diferentes zonas cerebrales estudiadas. La evaluación histopatológica de la zona del hipocampo de los animales sometidos al daño neuronal, evidenció ligeras alteraciones caracterizadas por la presencia de neuronas picnóticas. Los resultados mostraron el efecto neuroprotector de la administración intranasal de una formulación a partir de rHu-EPOb en ratas sometidas a isquemia focal transitoria y confirman la necesidad de realizar estudios clínicos para evaluar el posible efecto anti-isquémico de esta formulación.
Palabras clave: Eritropoyetina, administración intranasal, isquemia cerebral, neuroprotección.
ABSTRACT
Intranasal administration of recombinant human erythropoietin (rHu-EPOb) may be used lake an effective neuroprotective agent in treatment of cerebral ischemia. In present paper 10 µg of rHu-EPOb three times/day during 2 days were administered, starting immediately before induction of a transitory focal ischemia in rats. Results showed that nasal administration of rHu-EPOb improved significantly the neurologic behavior in animals underwent to transitory focal ischemia, and decreased infarction area in the different cerebral zones studied. Histopathological assessment of hippocampus zone of animal underwent to neuronal damage, showed slight alterations characterized by presence of pycnotic neurons. Results showed the neuroprotective effect of intranasal administration of a formula from rHu-EPOb in rats underwent to transitory focal ischemia, and confirm the need of clinical studies to assess the possible anti-ischemic effect of this formula.
Key words: Erythropoietin, intranasal administration, cerebral ischemia, neuroprotection.
INTRODUCCIÓN
Los avances alcanzados en los últimos años en el campo de la farmacología y la neurobiología molecular han propiciado importantes progresos en el conocimiento de la fisiopatología de numerosas enfermedades, permitiendo a su vez el desarrollo de nuevas clases de agentes terapéuticos que actúan de manera específica sobre dianas moleculares intracelular o extracelulares que intervienen en diferentes afecciones.
En el caso específico de las enfermedades del sistema nervioso central (SNC), la baja permeabilidad de la barrera hematoencefálica (BHE) ha sido una limitante importante para el empleo de numerosos candidatos terapéuticos administrados por vías convencionales (orales o parenterales). Sin embargo, la administración de fármacos por vía nasal ofrece un número de ventajas que la hacen ideal para dirigir agentes terapéuticos al cerebro, entre las más importantes se encuentran: rápida absorción, se evita el metabolismo intestinal y el de primer paso hepático y se transportan medicamentos por rutas que no involucran la BHE.1
Las enfermedades cerebrovasculares (ECV) constituyen la segunda causa de muerte y la primera causa de discapacidad de la mayoría de los países que tienen un elevado desarrollo en su sistema de salud, dentro de las ECV más frecuente se encuentra la isquemia cerebral, siendo la obstrucción del flujo sanguíneo en la arteria cerebral media (ACM)la causa más común.2 El periodo de ventana para el tratamiento de este tipo de enfermedad es muy corto y el daño neuronal se expande rápidamente, ocasiona secuelas irreversibles o la muerte del paciente; es por ello que solo una rápida detección del accidente cerebrovascular acompañado de un abordaje terapéutico eficaz que incluya la rápida llegada del fármaco neuroprotector al cerebro, puede evitar o revertir los daños que se ocasionan.
La eritropoyetina (EPO) es una glicoproteína que además de estimular la proliferación, diferenciación y maduración de los eritrocitos y otras células hematopoyéticas, siendo eficaz para el tratamiento de la anemia, se le han atribuido otros efectos fisiológicos que lo relacionan con el tratamiento de la isquemia cerebral a través de una cascada de fosforilación que incluye la vía de la Janus kinasa-2 y la familia de serina/treonina kinasa,3 y vías de transducción de señales y activadores de la transcripción4 que convergen en el efecto de la familia de las proteínas BCL para proteger las neuronas de la apoptosis, sin embargo, estos efectos solo se manifiestan con isoformas de EPO que tienen un elevado contenido de ácido siálico (resto de carbohidratos) en su estructura que lo protege del metabolismo hepático. En el Centro de Investigación y Desarrollo de Medicamentos, CIDEM (La Habana, Cuba) se realizó una formulación a partir de isoformas de EPO que contiene menos de un 40 % de ácido siálico, lo que la hace muy vulnerable a los procesos metabólicos de primer paso hepático, dichas isoformas representa alrededor del 70 % de la producción de EPO en el Centro de Inmunología Molecular (La Habana, Cuba) y constituye un residual de la producción de EPO destinada al tratamiento de la anemia a nivel hospitalario.
La carencia de efectos eritropoyéticos de la EPO con bajo contenido de ácido siálico y sus múltiples mecanismos neuroprotectores unido a la elevada disponibilidad de esta materia prima, propiciaron el desarrollo de un proyecto en el CIDEM para el desarrollo de una formulación nasal a partir de EPO con bajo contenido de ácido siálico potencialmente efectiva en el tratamiento de la isquemia cerebral. El presente trabajo tuvo como objetivo evaluar el efecto neuroprotector de una formulación nasal a partir de EPO básica en el modelo de isquemia focal transitoria en ratas.
METODOS
Se emplearon ratas Wistar machos de 270 a 300 g de masa corporal procedentes de la colonia de la UCTB Control Biológico del CIDEM. Estas fueron alojadas en una estancia con condiciones de temperatura controlada de 22 ± 2 °C, cama con viruta con cambio cada 48 horas y un ciclo de luz-oscuridad de 12/12 h. El pienso peletizado CMO 1 000, dieta proveniente del Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB), La Habana, Cuba, y el agua fueron administradas a libre demanda.
Procedimiento quirúrgico
Se formaron 3 grupos experimentales con 20 animales cada uno. Las ratas fueron anestesiadas con una mezcla de pentobarbital 40 mg/kg y diazepam 0,3 mg/kg administrada por vía intraperitoneal. Posteriormente se realizó una incisión con la tijera en la línea media de la cara anterior del cuello de aproximadamente 3 cm a partir de la horquilla esternal, se expuso la arteria carótida izquierda común y se realizó la disección de esta en sentido cefálico hasta llegar a su bifurcación y localizar la arteria carótida interna (ACI), externa (ACE) la occipital y la pterigoidea. Se ligó la ACE y arteria carótida común (ACC) y se ocluyó la arteria pterigopalatina; con una micro-fórceps se realizó una pequeña arteriotomía en la cara anterior de la ACC y se introdujo lentamente en el vaso un filamento de nylon 4/0 con la punta ovalada en dirección a la base del cráneo hasta que se observó una pequeña resistencia al recorrido de la sutura, como indicativo de que el filamento había ocluido la ACM. Las condiciones experimentales seleccionadas fueron 2 h de oclusión y 48 h de reperfusión, la recuperación de la operación en los animales se auxilió de una plancha caliente capaz de mantener una temperatura constante de 37 ± 2 ºC.5-7
Se realizó la evaluación neurológica de los animales pertenecientes a los diferentes grupos experimentales, al inicio e inmediatamente antes del sacrificio. Para ello se empleó una escala neurológica de 6 puntos como sigue:8-10
0: animales normales; 1: dificultad para extender la pata izquierda totalmente; 2: caminata en circulo hacia la izquierda; 3; caída hacia la izquierda; 4: locomoción no espontánea con depresión en el nivel de conciencia y 5: muerte.
En todos los grupos después del sacrificio 10 animales fueron reperfundidos transcardialmente con 20 mL de solución salina a 4 ºC, posteriormente los cerebros fueron removidos y se colocaron a 0 ºC durante 30 min. Pasado este tiempo se realizaron 6 cortes del cerebro de 2 mm cada uno y se colocaron en una solución de 2,3,5 cloruro de trifenil tetrazolio (TTC) al 2 % en cloruro de sodio al 0,9 % a 37 ºC durante 30 min. Luego, las diferentes rebanadas de cerebro fueron escaneadas y las imágenes obtenidas fueron analizadas con la ayuda del programa Photoshop, versión, 7.0, la selección del área infartada (no teñida) se realizó de manera manual; las áreas de infarto (cortical, subcortical y total) fueron calculadas de manera individual para cada rebanada. Para el cálculo del volumen de infarto se multiplicó el área (cortical, subcortical y total) por el espesor de las rebanadas (2 mm). El volumen de infarto total por cada región (cortical y subcortical) fue obtenido sumando los volúmenes individuales de estas. El volumen de infarto total fue la suma de los 2 volúmenes anteriores.10
El resto de los animales fueron reperfundidos con 20 mL de formol neutro al 10 % para realizar el estudio histopatológico de diferentes cortes cerebrales empleando el método de inclusión en parafina y tinción con hematoxilina-eosina.
Esquema de tratamiento
El tratamiento consistió en la aplicación nasal de 10 µg de rhEPOb o su correspondiente vehículo (procedentes de la UCTB Tecnologías Básicas del CIDEM) tres veces al día durante 2 días, comenzando inmediatamente después de la cirugía. La última administración fue realizada 16 horas antes de sacrificio. Para ello los animales fueron colocados en posición decúbito supino y con el empleo de una micropipeta se aplicaron 10 µL de la solución de rhEPOb en cada fosa nasal de forma lenta, se tapó la boca para que el animal respirase por la nariz y absorbiera toda la aplicación.
Sesenta animales fueron distribuidos aleatoriamente en cada uno de los grupos experimentales.
1. Control negativo (n= 20): falsos operados.
2. rhEPOb (n= 20): isquemia inducida por oclusión transitoria de la ACM.
3. Vehículo (n= 20): isquemia inducida por oclusión transitoria de la ACM.
Procesamiento estadístico
Los resultados, en los diferentes ensayos, se expresaron a través de la media ± desviación estándar. Los mismos se procesaron mediante un análisis de varianza de una vía y posteriormente se realizó la prueba de Duncan con un nivel de significación de p < 0,05.11
RESULTADOS
En el modelo de oclusión de la arteria cerebral media (OACM), el método de tinción con TTC 2 % de los diferentes cortes cerebrales, permitieron identificar áreas infartadas en la corteza tempororietal y en la región laterocaudal del putamen caudado en los animales pertenecientes al grupo vehículo sometidos a 2 h de oclusión de la ACM y 48 h de reperfusión. También se detectaron alteraciones neurológicas severas (> 2) en estos animales.
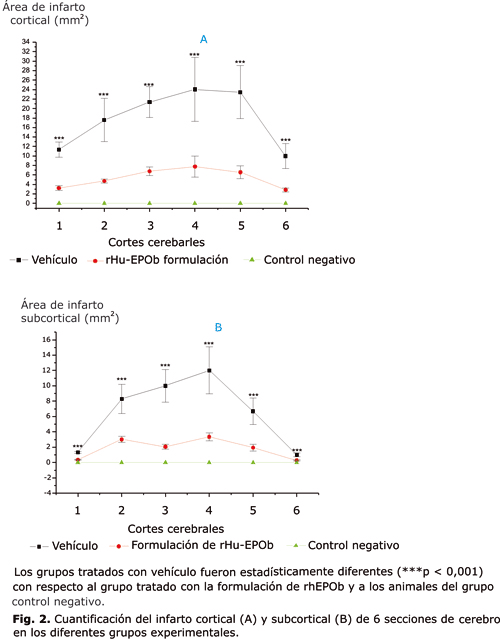
Mediante esta tinción se muestra la presencia de un área infartada reproducible en el hemisferio ipsilateral a la oclusión de la ACM en los animales tratados con el vehículo. El área infartada corresponde a la región coloreada de blanco pálido (fig. 1); el hemisferio contralateral no evidenció daño neuronal apreciable en estos mismos animales (área coloreada de rojo). La administración intranasal de rhEPOb redujo significativamente (p < 0,001) el área de infarto ipsilateral en todos los cortes cerebrales estudiados (fig. 2, A y B); el volumen de infarto cerebral calculado, en los animales tratados con la formulación nasal de rhEPOb también fue significativamente menor (p < 0,001) que el de los animales tratados con el vehículo (fig. 3).
El valor de los parámetros conductuales obtenidos para los diferentes grupos experimentales se muestra en la tabla, en esta se puede observar que los animales tratados con la formulación nasal de rhEPOb presentaron una disminución del daño neurológico (p < 0,001) con respecto a los animales tratados con vehículo; las ratas pertenecientes al grupo control negativo no mostraron déficit neurológico y el valor obtenido fue estadísticamente similar al obtenido para los animales tratados con rhEPOb. Las condiciones experimentales seleccionadas no provocan muerte de los animales por infarto cerebral.
En el inicio del experimento, todos los animales presentaron conductas neurológicas normales (valor de 0), ***p < 0,001, con respecto al grupo tratado con la formulación de rhEPOb y a los animales del grupo control negativo.
La evaluación histopatológica del daño cerebral en los animales sometidos a MCAO identificó la presencia de picnosis, edema, áreas de necrosis, gliosis y pérdida de neuronas del hipocampo en las zonas CA1, CA2, CA3 y girus dentado en los animales pertenecientes al grupo tratado con el vehículo; los animales tratados con la formulación nasal de rhEPOb solo presentaron pequeñas alteraciones caracterizadas por picnosis en neuronas del hipocampo, en el grupo control negativo no se presentaron alteraciones visibles (fig. 4.).
DISCUSIÓN
En condiciones normales el cerebro utiliza glucosa y O2 para la producción de ATP. La isquemia conduce rápidamente (en segundos) a un agotamiento de O2 y cesa la fosforilación oxidativa. En estas circunstancias, la única fuente de ATP es la glucólisis anaerobia, la cual no es suficiente para el funcionamiento normal de la célula nerviosa, por lo que se activan otras vías como la conversión de fosfocreatina en ATP (por acción de la creatín quinasa) y la producción de ATP por la adenilato quinasa (que utiliza 2 ADP para formar ATP y AMP). A pesar de todas estas alternativas, el ATP se agota casi completamente durante los primeros 4 minutos del comienzo de la isquemia.12
Posteriormente se desencadenan una serie de eventos metabólicos que involucran acidosis celular, la liberación de excesivas cantidades de glutamato que conducen a la excitotoxicidad, el influjo de Ca2+, la estimulación de la degradación de los fosfolípidos de membrana y la generación de radicales libres, acompañado de procesos inflamatorios y apoptóticos que conducen a la muerte neuronal.6
En el presente trabajo se evaluó el efecto neuroprotector de la administración intranasal de una formulación de rhEPOb en el modelo de oclusión transitoria de la ACM en ratas.
La OACM es la causa más común de todos los tipos de isquemia en humanos (88 %). Durante décadas, la introducción intraluminar de una sutura de nylon para ocluir la ACM ha constituido el modelo animal más ampliamente utilizado para estudiar fármacos neuroprotectores. El procedimiento quirúrgico no requiere craniotomía y muchos de los cambios fisiopatológicos originados se corresponden con los observados en el hombre.2
Las lesiones isquémicas comienzan en una región denominada centro isquémico, el cual se hace mayor a medida que se prolonga el tiempo de oclusión. La muerte neuronal está asociada además con una variedad de daños neurotóxicos que incluyen excitotoxicidad mediada por glutamato, peroxidación lipídica e hiperprodución de mediadores inflamatorios.13,14
La utilización de estrategias terapéuticas que potencien el efecto de los neuroprotectores endógenos ha sido sugerida recientemente.15 Teniendo en cuenta que la EPO es una molécula capaz de ejercer sus efectos neuroprotectores por diferentes vías, entre las que se encuentran, inhibición de la apoptosis neuronal, inflamación cerebral, bloqueo de la transmisión glutamatérgica, formación de nuevos vasos, entre otras,16,17 numerosos grupos de investigación han focalizado su interés en demostrar las propiedades neuroprotectoras de esta molécula.18-23
La eritropoyetina es una glicoproteína con un peso molecular de 34 kDa producida fundamentalmente en el riñón, hígado y cerebro y está muy involucrada en la proliferación, diferenciación y maduración de eritrocitos y otras células hematopoyéticas.24 Los carbohidratos presentes en la molécula tienen un papel fundamental en la protección de la glicoproteína de la acción de las proteasas y, por lo tanto, de su inactivación y pérdida de actividad biológica.25 Las isoformas de EPO con un reducido contenido de ácido siálico presentan un muy limitado tiempo de vida media y por lo tanto, son totalmente inactivas in vivo.26-29
Por otra parte, los procesos inflamatorios pueden incrementar el daño cerebral a través de diferentes mecanismos, uno de ellos es la inhibición de la expresión de EPO endógena e impiden así que esta ejerza sus efectos neuroprotectores en afecciones como la isquemia cerebral y justifica la potencial aplicación de EPO exógena para el tratamiento de este tipo de enfermedades.
El efecto neuroprotector de la EPO administrada por vía endovenosa en modelos de isquemia en ratones mostró una reducción del daño isquémico entre el 50 y 75 %.17 Sin embargo, en la actualidad no existen suficientes resultados para demostrar la eficacia clínica de la EPO ácida en el tratamiento de la isquemia cerebral, la capacidad de esta molécula de inducir eritropoyesis y con ello aumentar la viscosidad de la sangre y su baja permeabilidad a través de la BHE, exigen la realización de estudios más profundos. Por otro lado, la baja afinidad de la EPOrh con su receptor en el SNC, trae como consecuencia la necesidad de aplicación de cantidades relativamente grandes de EPO para lograr el efecto farmacológico, aumentándose así las probabilidades de aparición de efectos indeseables como los antes mencionados.30-32
Por otra parte es bien conocido que algunas moléculas neuroprotectoras son administradas al cerebro a través de la cavidad nasal.33,34 La administración de agentes terapéuticos al SNC ha sido especialmente recomendada para fármacos con baja biodisponibilidad o para compuestos de alto peso molecular como proteínas y péptidos. La región olfatoria tiene atributos anatómicos y fisiológicos únicos que definen vías extracelular e intracelular hacia el SNC, que evaden la BHE. Las células receptoras olfatorias son las únicas neuronas de primer orden cuyos cuerpos celulares se localizan en el epitelio distal. Sus procesos dendríticos están expuestos directamente al ambiente exterior en la vía nasal superior, mientras que sus axones no mielinados, luego de penetrar la membrana basal, se proyectan a través de las perforaciones de la placa cribiforme del hueso etmoides hacia los glomérulos sinápticos en el bulbo olfatorio.35 Recientemente fue administrada intranasalmente la EPOrh ácida en ratas sometidas a MCAO con resultados muy satisfactorios.36
En este trabajo, se administraron isoformas básicas de EPO (rHu-EPOb) (con ausencia de propiedades eritropoyéticas in vivo) por vía nasal con el objetivo de evitar el metabolismo de primer paso y los problemas de permeabilidad a través de la BHE de esta proteína, en ratas sometidas a MCAO. Previos reportes realizados por Sosa y otros37 demostraron la eficacia de la administración nasal de rHu-EPOb frente al daño inducido por oclusión permanente de la carótida derecha en gerbils de Mongolia; sin embargo, fue necesario demostrar las propiedades neuroprotectoras de la rHu-EPOb en el modelo de oclusión transitoria de la ACM en ratas, por ser este modelo el que más similitud presenta con los procesos isquémicos que ocurren en humanos; los resultados demostraron que la administración intranasal de rHu-EPOb posee propiedades neuroprotectoras sobre el SNC, particularmente en condiciones de daño neuronal, como hipoxia o isquemia.
La tinción de diferentes áreas cerebrales con TTC, es una metodología efectiva para estimar la capacidad neuroprotectora de diferentes compuestos,38 los resultados muestran una significativa reducción (p < 0,001) del área infartada en animales sometidos a isquemia focal y tratados con rhEPOb, comparado con los animales que fueron tratados con el vehículo de la formulación.
La isquemia focal produce una extensa área de daño neuronal caracterizado fundamentalmente por necrosis, en la que la muerte neuronal es acompañada por gliosis, muerte de células vasculares y pérdidas de elementos celulares, los estudios histopatológicos realizados a los animales sometidos a oclusión transitoria de la ACM, muestran una mayor intensidad de estos eventos en los animales tratados con el vehículo, mientras que los animales que fueron administrados con la formulación de rHu-EPOb evidenciaron un notable efecto neuroprotector de esta proteína, lo cual fue corroborado a través de los ensayos conductuales realizados. Los resultados demostraron la capacidad neuroprotectora de una formulación de rHu-EPOb administrada por vía intranasal, en el modelo de oclusión transitoria de la ACM en ratas, como una nueva alternativa para el tratamiento de los accidentes cerebrovasculares, sin riesgo de incremento de la viscosidad sanguínea, ni problemas de permeabilidad de la BHE.
REFERENCIAS BIBLIOGRÁFICAS
1. Talegaonkar S, Mishra PR. Intranasal delivery: An approach to bypass the blood-brain barrier. Indian J Pharmacol. 2004; 36:140-7.
2. Sayeed I, Guo Q, Hoffman SW, Stein DG. Allopregnanolone, a Progesterone Metabolite, Is more effective than progesterone in reducing cortical infarct volume after transient middle cerebral artery occlusion. Ann Emerg Med. 2006; 47:381-9.
3. Siren AL, Ehrenreich H. Erythropoietin -a novel concept for neuroprotection. Eur Arch Psychiatry Clin Neurosci. 2001; 251(4):179.
4. Digicaylioglu M, Garden G, Timberlake S, Fletcher L, Lipton SA. Acute neuroprotective synergy of erythropoietin and insulin-like growth factor I. Proc Natl Acad Sci USA. 2004; 101(26):9855-60.
5. Coert BA, Anderson RE, Meyer FB. Reproducibility of cerebral cortical infarction in the Wistar rat after middle cerebral artery occlusion. J Stroke Cerebrovasc Dis. 1999; 8:380-7.
6. Lipton P. Ischemic cell death in brain neurons. Physiological Rev. 1999; 79 (4):1432-568.
7. Tamura A, Graham DI, Teasdale GM. Focal cerebral ischaemia in the rat: 1. Description of technique and early neuropathological consequences following middle cerebral artery occlusion. J Cereb Blood Flow Metabol. 1981; 1:53-60.
8. Longa EZ, Weinstein PR, Carlson S, Cummins R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 1989; 20:84-91.
9. Minematsu K, Li L, Sotak CH, Davis MA, Fisher M. Reversible focal ischemic injury demonstrated by diffusion-weighted magnetic resonance imaging in rats. Stroke. 1992; 23:1304-10.
10. González FA, Eduardo Candelario EJ, García CM, León SO. Effects of pyruvate administration on infarct volume and neurological deficits following permanent focal cerebral ischemia in rats. Brain Res. 2003; 990:1-7.
11. Sigarroa A, Biometría y diseño experimental. La Habana: Ed. Pueblo y Educación; 1985. p. 430.
12. Farooqui AA, Haun SE, Horrocks LA. Ischemia and hypoxia. In: GJ Siegel. Basic Neurochemistry: Molecular, cellular and medical aspects. 5th ed. New York: Raven Press; 1994. p. 867-83.
13. Dirnagl U, Iadecola C, Moskowitz M.A. Pathobiology of ischaemic stroke: an integrated view. Trends Neurosci. 1999; 22:391-7.
14. Lo EH, Dalkara T, Moskowitz MA. Mechanisms, challenges and opportunities in stroke. Nat Rev Neurosci. 2003; 4:399-415.
15. García S JD. Protección neuronal endógena: un enfoque alternativo. Rev Neurol. 2004;38(2):150-5.
16. Shingo T, Soracan ST, Shimazaki T, Weis S. Erythropoietin regulates the in vitro and production of neuronal progenitors be mammalian forebrain neural stem cells, J Neurosci. 2001; 21:9733-43.
17. Brines ML, Ghezzi P, Keenan S. Erythropoietin cross the blood brain barrier to protect against experimental brain injury. Proc Natl Acad Sci. 2000; 97:10526-31.
18. Sakanaka M, Wen T-C, Matsuda S, Seiji Masuda S, Morishita E, Nagao M, Sasaki R. In vivo evidence that erythropoietin protects neurons from ischemic damage. PNAS. 1998;95:4635-40.
19. Eid T, Brines M. Recombinant human erythropoietin for neuroprotection: what is the evidence? Clin Breast Cancer. 2002; Suppl 3:109-15.
20. Marti HH, Bernaudin M, Petit E, Bauer C. Neuroprotection and angiogenesis: Dual role of erythropoietin in brain ischemia. News Physiol Sci. 2000;15:225-9.
21. Bernaudin M, Marti HH, Roussel S, Divoux D, Nouvelot A, Mackenzie ET, Petit E. A potential role for erythropoietin in focal permanent cerebral ischemia in mice. J Cereb Blood Flow Metab. 1999; 19:643-51.
22. Siren AL, Ehrenreich H. Erythropoietin: a novel concept for neuroprotection. Eur Arch Psychiatry Clin Neurosci. 2001; 251:179-84.
23. Digicaylioglu M, Lipton SA. Erythropoietin-mediated neuroprotection involves cross-talk between Jak2 and NF-kappaB signalling cascades. Nature. 2001;412:641-7.
24. Maiese K, Li F, Chong ZZ. New Avenues of Exploration for Erythropoietin JAMA. 2005; 293:90-5.
25. Toyoda T, Arakawa T, Aoki K, Yamaguchi H. Stabilization of human recombinant erythropoietin through interactions with the highly branched N-glycans. J Biochem 2000; 128:731_7.
26. Jelkmann W. The enigma of the metabolic fate of circulating erythropoietin (Epo) in view of the pharmacokinetics of the recombinant drugs rhEpo and NESP. Eur J Haematol. 2002; 69:265_74.
27. Dordal MS, Wang FF, Goldwasser E. The role of carbohydrate in erythropoietin action. Endocrinology. 1985; 116:2293-9.
28. Weikert S, Papac D, Briggs J. Engineering Chinese hamster ovary cells to maximize sialic acid content of recombinant glycoproteins. Nature Biotechnol. 1999; 17:1116-21.
29. Goldwasser E, Kung CK, Eliason J. On the mechanism of erythropoietin-induced differentiation. The role of sialic acid in erythropoietin action. J Biol Chem. 1974; 249:4202-6.
30. Wiessner C, Allegrini PR, Ekatodramis D, Jewell UR, Stallmach T, Gassmann M. Increased cerebral infarct volumes in polyglobulic mice overexpressing erythropoietin. J Cereb Blood Flow Metab. 2001; 21:857-64.
31. Gassmann M, Heinicke K, Soliz J, Ogunshola OO. Non-erythroid functions of erythropoietin. In: Roach RC. Hypoxia: Through the Lifecycle. Chapter 21. New York: Kluwer Academic/Plenum Publishers; 2003.
32. Ajmani RS, Metter EJ, Jaykumar R. Hemodynamic changes during aging associated with cerebral blood flow and impaired cognitive function. Neurobiol Aging. 2000; 21:257-69.
33. Banks AW. Are the extracelluar pathways a conduit for the delivery of therapeutics to the brain? Current Pharmaceutical Design. 2004; 10:1365-70.
34. Frey HW, Liu J, Chen X, Thoner RG, Fawcett JR. Delivery of 125 I-NGF to the brain via the olfactory route. Drug Delivery. 1997; 4:87-92.
35. Sosa TI. Estudio del efecto neuroprotector de la eritropoyetina humana recombinante con bajo contenido de ácido siálico aplicada por vía intranasal en biomodelos experimentales de isquemia cerebral. Tesis Doctoral, La Habanaa. CENPALAB; 2007.
36. Yu YP, Xu QQ, Zhang Q, Zhang WP, Zhang LH, Wei EQ. Intranasal recombinant human erythropoietin protects rats against focal cerebral ischemia. Neurosci Lett. 2005;387(1):5-10.
37. Sosa TI, García R JC, García S JD, Santana J, Subirós MN, González TC, et al. Intranasal administration of recombinant human erythropoietin exerts neuroprotective effects on post-ischemic brain injury in mongolian gerbils. Pharmacology Online. 2006(1):100-12.
38. Joshi CN, Jain SK, Murthy PS. An optimized triphenyltetrazolium chloride method for identification of cerebral infarcts. Brain Res Brain Res Protoc. 2004;13(1):11-7.
Recibido: 5 de octubre de 2008.
Aprobado: 6 de noviembre de 2008.
MC. Yanier Nuñez Figueredo. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). Ave 26, No. 1 605 entre Boyeros y Calzada de Puentes Grandes, CP 10 600, municipio Plaza de la Revolución, La Habana, Cuba. Correo electrónico: yaniernf@infomed.sld.cu