Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.43 n.2 Ciudad de la Habana Mayo-ago. 2009
ARTÍCULOS ORIGINALES
Evaluación de la eficacia in vitro e in vivo del tratamiento antimicrobiano combinado por el tablero de damas
Effectiveness of a combined antimicrobial treatment by means of the draughtboard. In vitro and in vivo assessment
María Espino HernándezI; Isabel Martínez MotasII; María Julia Couto RamosIII; Jorge L. Zuazo SilvaIV
ILicenciada en Bioquímica. Máster en Microbiología Clínica. Profesora e Investigadora Auxiliar. Escuela Latinoamericana de Medicina (ELAM). La Habana, Cuba.
IIDoctora en Ciencias Médicas. Especialista de II Grado en Microbiología. Instituto Finlay. La Habana, Cuba.
IIIEspecialista de II Grado en Neonatología. Máster en Atención al Niño. Hospital Ginecobstétrico Universitario "América Arias". La Habana, Cuba.
IVEspecialista de II Grado en Microbiología. Máster en Enfermedades Infecciosas. Investigador Titular. Profesor Consultante. Facultad de Medicina de 10 de Octubre. La Habana, Cuba.
RESUMEN
El presente trabajo tuvo como objetivo, evaluar la eficacia clínica del tratamiento antimicrobiano combinado mediante pruebas de sinergismo in vitro y determinar la eficacia del procedimiento empleado para orientar la aplicación de estas formas de tratamiento en el paciente con sepsis por bacterias con resistencia variada. Se evaluó el tratamiento aplicado a 163 recién nacidos con sepsis corroborada por hemocultivo positivo en el Hospital Ginecobstétrico Universitario "América Arias", durante el periodo de enero de 1993 a diciembre de 2000, por el método tablero de damas (checkerboard) en placas de microtitulación. Las combinaciones de fármacos sinérgicas in vitro presentaron una alta probabilidad de eficacia clínica, independiente del patrón de susceptibilidad del microorganismo aun frente a cepas resistentes a los 2 antimicrobianos utilizados en el tratamiento. Todos los resultados antagónicos in vitro se correspondieron con un fallo clínico terapéutico. El procedimiento utilizado puede constituir una valiosa herramienta para orientar la terapéutica en pacientes con sepsis por microorganismos resistentes.
Palabras clave: Sinergismo farmacológico, antagonismo de drogas, terapia combinada, antimicrobianos.
ABSTRACT
The aim of present paper was to evaluate clinical effectiveness of combined antimicrobial treatment by means of in vitro synergism tests and to determine effectiveness of used procedure to direct applications of these treatment strategies in patient presenting with sepsis from varied resistance bacteria. Treatment applied was assessed in 163 newborn patients presenting with sepsis from positive hemoculture in "America Arias" University Gynecology-Obstetrics Hospital from January 1993 to December 2000, by checkerboard method in microtritate plates. In vitro synergic drug combinations showed a high probability of clinical effectiveness, independently of susceptibility pattern of microorganism event versus resistant strains to both antimicrobials used in treatment. All in vitro antagonistic results correspond both with a therapeutic clinical failure. Procedure used may be a valuable tool to direct therapeutics in patients presenting with sepsis from resistant microorganisms.
Key words: Pharmacologic synergism, drugs antagonism, combined therapy, antimicrobials.
INTRODUCCIÓN
La determinación de la susceptibilidad antimicrobiana in vitro constituye una de las funciones más importantes de los laboratorios de Microbiología Clínica. Esta actividad permite monitorear los niveles de resistencia de los microorganismos a los antimicrobianos para instaurar las políticas terapéuticas adecuadas y evaluar el desarrollo futuro de los nuevos fármacos.1,2
Desde las primeras contribuciones realizadas por Fleming hasta la fecha, y con el propósito de satisfacer las crecientes demandas terapéuticas, se crean, perfeccionan e introducen en la práctica clínica, numerosos procedimientos basados en la difusión o la dilución de los antimicrobianos.1
Al igual que los procedimientos para evaluar la susceptibilidad individual de los fármacos, existen pruebas para determinar el efecto de sus combinaciones. Para ello, uno de los métodos de laboratorio más utilizados es el tablero de damas o checkerboard (de su nombre en inglés).3-5
En el tratamiento del paciente con sepsis grave asociada a microorganismos hospitalarios (la mayoría multirresistentes) es muy común que se utilicen combinaciones de antimicrobianos para tratar de obtener un efecto más rápido y superior al que pudiera esperarse con un solo medicamento. No obstante, muchas veces se obtienen resultados contrarios a los esperados lo cual atenta contra la salud del paciente y los costos hospitalarios.
En la literatura, aunque existen múltiples estudios en los que se emplea el tablero de damas para evaluar el efecto in vitro de las combinaciones de fármacos contra una gran variedad de agentes causales, escasean los trabajos que permiten comprobar, paralelamente, la eficacia clínica de los tratamientos propuestos.6
En el Hospital Ginecobstétrico Universitario "América Arias" de La Habana, se desarrolló durante el periodo desde enero de 1993 hasta diciembre de 2000, una investigación dirigida a evaluar la eficacia clínica de una variedad de tratamientos aplicados al recién nacido séptico. Para ello se realizó el montaje y se introdujo en el diagnóstico clínico microbiológico, por primera vez en el país, del método tablero de damas.
El presente trabajo tuvo como objetivo evaluar la eficacia clínica del tratamiento antimicrobiano combinado, aplicado a los pacientes por pruebas de sinergismo in vitro y determinar la eficacia del procedimiento empleado para orientar la aplicación de estas formas terapéuticas en el paciente con sepsis por bacterias con resistencia variada.
MÉTODOS
Se realizó u estudio de casos en serie desarrollado durante el periodo comprendido desde enero 1993 a diciembre de 2000, para evaluar el tratamiento antimicrobiano combinado, aplicado a recién nacidos con sepsis por pruebas de sinergismo in vitro.
El universo de trabajo estuvo constituido por 200 recién nacidos con sepsis corroborada por hemocultivo positivo, a quienes se les aplicó tratamiento con antimicrobianos combinados, según criterios clínicos y acorde con el Programa para el Uso de los Antimicrobianos establecido en la Unidad de Cuidados Intensivos Neonatal (UCIN), del Hospital Universitario "América Arias" durante el periodo señalado. La muestra estuvo conformada por 163 niños que cumplieron con los siguientes criterios de inclusión: pacientes en los que no se modificó el tratamiento aplicado antes de las primeras 72 h (momento en que se efectuó la primera evaluación) y a los que después de culminar el tratamiento previsto (7 a 10 d), se les realizó un hemocultivo evolutivo.
La evaluación de la terapéutica se realizó tomando como punto de partida el estado clínico del paciente, junto con los resultados microbiológicos (características morfológicas y tintoriales del agente causal, patrón de susceptibilidad de la cepa y resultado del sinergismo in vitro.
Criterios para evaluar la eficacia clínica del tratamiento
Tratamiento eficaz: cuando al concluir este, además de desaparecer los signos y síntomas clínicos de sepsis, no se obtuvo crecimiento microbiano en el hemocultivo evolutivo.
Tratamiento no eficaz: cuando se realizaron cambios en la terapéutica sustituyendo, al menos, uno de los fármacos de la combinación; cuando al finalizar el tratamiento se aisló en el hemocultivo evolutivo el mismo agente causal, acompañado o no de la persistencia de los signos y síntomas clínicos de sepsis o cuando el paciente mantuvo la misma sintomatología a pesar de ser el hemocultivo evolutivo negativo.
Estudios microbiológicos
El aislamiento y la identificación microbiana se realizaron por los métodos convencionales de diagnóstico.7
Sinergismo in vitro: Se realizaron por el tablero de damas en placas de microtitulación según lo establecido en el protocolo del National Committe for Clinical and Laboratory Standard (NCCLS).8 Para preparar las soluciones patrones de los antimicrobianos se emplearon polvos de calidad y potencia conocida con una concentración equivalente a 5 120 µg/mL, según lo sugerido por el Clinical and Laboratory Standard Institute (CLSI).9 Se evaluaron 10 combinaciones de ß-lactámicos y aminoglucósidos, frente a una variedad de microorganismos grampositivos y gramnegativos. Estas fueron: penicilina G/kanamicina, penicilina G/gentamicina/, penicilina G/amikacina, azlocilina/amikacina; meticilina/kanamicina, meticilina/gentamicina, meticilina/amikacina, ceftriaxona/amikacina, cefotaxima/amikacina y cefazolina/amikacina.
En los pocillos de la placa de microtítulo se depositaron diluciones dobles seriadas de los fármacos ensayados (individuales y combinados) las que se inocularon con una concentración bacteriana final equivalente a 1-5 x 105 UFC/mL. Para todas las combinaciones de antimicrobianos probadas el rango de concentraciones investigados fue 0,06-64 µg/mL, excepto para la azlocilina cuyo rango probado fue 0,125-128 µg/mL. La interpretación de los resultados se realizó a través del cálculo del índice de la concentración fraccionaria inhibitoria (SCFI) según la siguiente fórmula:
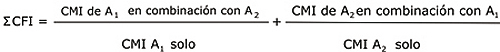
Se consideró sinergismo (S) si åCFI £ 0,5; sinergismo parcial o bajo (SP) si 0,5 < åCFI < 1; indiferencia o adición (I) si 1 £ åCFI < 2 y antagonismo (A) cuando åCFI ³ 2, tomando como referencia los criterios propuestos por Berenbaum10 y señalados posteriormente por Eliopoulos.11
Para el control de la calidad se utilizaron las cepas de referencia: S. aureus ATCC 29213, E. coli ATCC 25922 y P. aeruginosa ATCC 27853 según lo establecido por el CLSI.9
Análisis de los resultados
Para resultados S, SP, I y A, se determinaron los valores åCFI mínimo (åCFImin) y åCFI máximo (åCFImax), (valores mínimo y máximo obtenidos para dicho indicador), la media geométrica de åCFI y de su intervalo [åCFImin-åCFImax] así como la media geométrica de las CMI de los fármacos individuales y en la combinación.
Se estableció la relación entre los resultados del sinergismo in vitro, la eficacia clínica del tratamiento y la susceptibilidad de la cepa a los fármacos de la combinación ensayada, por pruebas de dependencia. Se prepararon tablas de contingencia con 1 a 3 grados de libertad (g.l.), se aplicó la prueba convencional de Ji-cuadrado de la estadística no paramétrica con un nivel de significación a= 0,05 y la prueba exacta de Fisher para muestras pequeñas o cuando el valor fue cero en alguna de las celdas. Para evaluar la eficacia del procedimiento diagnóstico se determinaron los siguientes indicadores: sensibilidad, especificidad, valor predictivo positivo y negativo, así como las razones de verosimilitud positiva y negativa con un intervalo de confianza del 95 %, según la metodología de Johnson y Oski.12 Se establecieron los siguientes criterios: enfermos: pacientes en los que el tratamiento no fue eficaz; sanos: pacientes en los que el tratamiento fue eficaz; prueba positiva: resultados no sinérgicos; prueba negativa: resultados sinérgicos; verdaderos positivos (VP): tratamiento no eficaz y resultado no sinérgico; falsos positivos (FP): tratamiento eficaz y resultado no sinérgico; verdaderos negativos (VN): tratamiento eficaz y resultado sinérgico y falsos negativos (FN): tratamiento no eficaz y resultado sinérgico. El procesamiento de los datos se realizó por medio del programa EPIDAT, versión 3.0.
RESULTADOS
Se estudiaron 10 combinaciones de ß-lactámicos y aminoglucósidos que se enfrentaron indistintamente a 75 cepas de estafilococo coagulasa negativa (46,0 %), 32 S. aureus (19,6 %), 35 enterobacterias (21,5 %), 16 bacilos gramnegativos no fermentadores (BNF) (9,8 %) y 5 enterococos (3,1 %). Del total de tratamientos evaluados, 56 pruebas fueron sinérgicas (34,4 %); 25 parcialmente sinérgicas (15,3 %); 72 indiferentes (44,2 %) y 10 antagónicas (6,1 %) (tabla 1).
Tabla 1. Resultados de las pruebas de sinergismo in vitro. Hospital América Arias. Enero de
| Combinación de antimicrobianos | Pruebas (número) | Agente causal | Cepas (número) | Sinergia in vitro | |||
| Sc | SPd | Ie | Af | ||||
| Penicilina G/kanamicina | 92 | ECNa | 44 | 15 | 4 | 23 | 2 |
| Penicilina G/gentamicina | 16 | ECN | 6 | 1 | 1 | 2 | 0 |
| Penicilina G/amikacina | 15 | ECN | 5 | 1 | 3 | 1 | 0 |
| Azlocilina/amikacina | 19 | ECN | 10 | 6 | 1 | 3 | 0 |
| Cefazolina/amikacina | 2 | ECN | 2 | 1 | 0 | 1 | 0 |
| Cefotaxima/amikacina | 2 | ECN | 1 | 1 | 0 | 0 | 0 |
| Ceftriaxona/amikacina | 8 | S. aureus | 1 | 1 | 0 | 0 | 0 |
| Meticilina/amikacina | 3 | ECN | 3 | 0 | 0 | 3 | 0 |
| Meticilina/gentamicina | 1 | S. aureus | 1 | 0 | 0 | 1 | 0 |
| Meticilina/kanamicina | 5 | ECN | 4 | 0 | 0 | 4 | 0 |
| Total | 163 | 163 | 56 | 25 | 72 | 10 | |
Para resultados sinérgicos, la media del índice CFI fue 0,276. En la combinación de los antimicrobianos, el ß-lactámico disminuyó 3 veces su valor (1/8) como promedio, mientras que la CMI del aminoglucósido disminuyó 5 veces (1/32). Para resultados indiferentes, también se observó un descenso de la CMI del aminoglucósido en combinación con el ß-lactámico, equivalente a un valor medio de 7 diluciones (1/128), en muchos casos esta reducción fue hasta de 10 diluciones (1/2048), sin que se produjera, aparentemente, ningún beneficio para el antibiótico ß-lactámico (tabla 2).
Sinergismo in vitro y eficacia clínica del tratamiento: Cuando se compararon de forma general estas dos variables, se encontró una la relación estadísticamente significativa (p= 0,0000) (tabla 3). Cuando se realizó este mismo análisis, agrupando los resultados en sinérgicos y no sinérgicos (SP, I y A), la diferencia volvió a ser significativa (c2= 13,78; p= 0,0002); lo cual expresa que para resultados sinérgicos, la probabilidad de obtener un tratamiento eficaz, fue superior. No se encontró diferencia estadísticamente significativa entre la probabilidad de obtener eficacia clínica con un tratamiento cuando el resultado de la prueba fue sinérgico o indiferente (c2= 0,05; p= 0,81).
Sinergismo in vitro y susceptibilidad del microorganismo: Un total de 77 (47,2 %) cepas fueron sensibles al menos a uno de los 2 antimicrobianos utilizados en la combinación, mientras que 86 (52,8 %) fueron resistentes a los dos (tabla 4). El resultado global de este análisis mostró dependencia entre las variables (c2= 10,59; p= 0,014). Sin embargo, cuando la relación se estableció, al agrupar los resultados en sinérgicos y no sinérgicos, no se encontró diferencia estadísticamente significativa (c2= 1,78; p= 0,181), pero sí lo fue, cuando la relación se estableció al agrupar los resultados en antagónicos y no antagónicos (p= 0,001). De ello se infirió que para las cepas resistentes a los dos fármacos de la combinación, existió una mayor probabilidad de antagonismo que cuando la cepa fue sensible. Sin embargo, la probabilidad de obtener un resultado sinérgico con una combinación donde la cepa es resistente a los 2 antimicrobianos, fue similar a cuando la cepa fue sensible a uno de ellos o a ambos.
Susceptibilidad del microorganismo y eficacia clínica del tratamiento: De los 86 pacientes con sepsis por bacterias resistentes a los 2 antimicrobianos utilizados en el tratamiento, en 59 la terapéutica fue eficaz para un 68,6 %. Al contrastar este resultado con el de 62 tratamientos eficaces del total de 77 pacientes con sepsis por bacterias sensibles, al menos uno de los 2 fármacos utilizados para el tratamiento (80,5 %), no se encontró diferencia estadísticamente significativa (p= 0,119) (tabla 5).
Evaluación de la eficacia del tablero de damas como procedimiento diagnóstico: De acuerdo con los criterios adoptados, se contrastaron los resultados obtenidos en las pruebas in vitro con la eficacia clínica del tratamiento (tabla 6). El resultado del cálculo de los indicadores para evaluar la eficacia del procedimiento arrojó una sensibilidad equivalente a 88,1 % acompañado de una valor predictivo negativo del 90,06 % (tabla 7).
DISCUSIÓN
Desde hace más de 50 años se estudian cuidadosamente los mecanismos de la acción sinérgica; sin embargo, no todos están esclarecidos. El efecto letal de la combinación de un ß-lactámico y un aminoglucósido se basa en la remoción que puede producir el ß-lactámico sobre la pared de la bacteria para facilitar la penetración intracelular del aminoglucósido.4,11 A partir de este principio, es fácil comprender el mecanismo cuando se enfrentan los antimicrobianos contra cepas sensibles; no obstante, éste no parece ser tan simple en las cepas resistentes al ß-lactámico, y mucho menos, en las resistentes a ambos antimicrobianos.
La demostración del sinergismo entre los fármacos requiere que el efecto de la combinación sea significativamente mayor que el resultado individual de cada uno, lo cual equivale a que la CMI de ambos fármacos disminuya en la combinación al menos 2 diluciones (1/4). El término sinergismo parcial, es controversial entre los investigadores y se sustenta en el criterio del beneficio que puede existir cuando en la combinación de los fármacos, uno de ellos disminuye su CMI en una sola dilución (1/2). A partir de aquí, la controversia radica en lo variable que puede ser una dilución de diferencia cuando se trata de determinar el punto final de cualquier prueba donde se emplee un método como este, en el que pueden incidir una gran variedad de factores técnicos y biológicos.9,11
Al igual que se hizo en este trabajo, diferentes autores establecen criterios para diferenciar el sinergismo parcial de la indiferencia o la adición.13-15 Sin embargo, otros consideran verdadero antagonismo para valores del índice åCFI ³ 4; es decir, cuando la CMI de cada uno de los antimicrobianos por separado supere, en la combinación, como mínimo 2 diluciones el valor de su CMI individual.11-17 La razón de la variabilidad en los criterios, radica en las dificultades de estandarización que presenta este procedimiento, entre otras causas, por la carencia de trabajos que correlacionen los resultados clínicos con los del laboratorio 9.
En este estudio, al evaluar si existió alguna diferencia entre la probabilidad de obtener eficacia clínica con un tratamiento cuando el resultado de la prueba fue parcialmente sinérgico o indiferente, no se encontró diferencia estadísticamente significativa, por lo que la diferenciación entre estos 2 términos podría no pasar de ser una simple curiosidad de laboratorio para el método empleado y que la probabilidad de obtener un resultado clínico eficaz con el tratamiento, sea la misma para ambos casos. No obstante, este hallazgo pudo estar determinado por el tamaño de la muestra y quizás se requiera de un mayor número de evidencias para ofrecer conclusiones más precisas. Asimismo, para todos los resultados antagónicos, el tratamiento no fue eficaz por lo que el criterio asumido en este estudio (CFI ³ 2) parece ser adecuado, contrario a lo consideran otros investigadores.11-17
Es importante destacar que en los microorganismos resistentes a los dos fármacos de la combinación, se obtuvo eficacia clínica del tratamiento aun cuando el resultado de la prueba fue indiferente. Como se destacó en los comentarios de la tabla 2, en muchas de estas pruebas se observó una marcada potenciación de la actividad del aminoglucósido por el ß-lactámico, traducida en una disminución de hasta 1/2048 veces (10 diluciones) el valor inicial de la CMI obtenida para el aminoglucósido, sin que se observara ningún efecto en la CMI del ß-lactámico. Al respecto, sería aconsejable preguntarse si el efecto observado, como en el sinergismo parcial, no pasa de ser otra curiosidad de laboratorio, o si se trató de interacciones sinérgicas incapaces de ser detectadas por el procedimiento empleado.
Para el método utilizado se encontró una sensibilidad aceptable cuando los resultados in vitro se compararon con los resultados clínicos (88,1 %) y se tradujo en su buena capacidad para predecir los tratamientos no eficaces, a pesar que fue baja la probabilidad de que todos fueran verdaderamente ineficaces (34,58 %). No obstante, un resultado no sinérgico fue 1,52 veces más probable que se correspondiera con tratamientos no eficaces. Por otra parte, la especificidad del método pudiera no parecer buena (42,15 %); si se valora éste como una herramienta para medir la eficacia del tratamiento desde el punto de vista general, pero cuando se evalúa a partir de la eficacia clínica obtenida para los resultados sinérgicos, entonces hay que considerarlo aceptable (91,07 %). En otros términos, es 3,6 veces más probable (resultado de dividir 1/0,28) que los tratamientos eficaces se correspondan con un resultado sinérgico.
Cuando se analizaron los resultados de este trabajo con el criterio que el método empleado sea una herramienta que sirva como pauta orientadora para la selección de un tratamiento antimicrobiano en los momentos necesarios, se puede concluir que el tablero de damas es un buen procedimiento diagnóstico. Si bien la baja especificidad encontrada, pudo parecer un inconveniente a la hora de decidir la aplicación de una terapéutica donde el efecto obtenido no fue ni sinérgico ni antagónico, este no se considera el principal problema a tener en cuenta, ya que lejos de alcanzar la certeza absoluta en estos casos, lo que se persigue es reducir el nivel de incertidumbre que provoca, el tener que tratar un paciente con una sepsis grave asociada, por lo general, con un agente causal resistente a todos o casi todos los antimicrobianos disponibles. Si solo se tomara en cuenta la correspondencia encontrada en este estudio, entre la eficacia clínica del tratamiento y los resultados sinérgicos y antagónicos, habría que decir entonces, que el tablero de damas es un procedimiento valioso para evaluar la aplicación de un tratamiento basado en las combinaciones de fármacos.
La no existencia hasta el momento de una prueba de referencia, de sensibilidad y especificidad conocida, comparable con el método empleado, impidió realizar una evaluación más precisa de su eficacia.
REFERENCIAS BIBLIOGRÁFICAS
1. Andrews JM. The development of the BSAC standardized method of disc diffusion testing. J Antimicrob Chem. 2001;48(Suppl S1):29-42.
2. MacGowan AP, Wise R. Establishing MIC breakpoints and interpretation of in vitro susceptibility tests. J Antimicrob Chem. 2001;(Suppl S1):17-28.
3. Mackay ML, Milne K, Gould IM. Comparison of method for assessing synergic antibiotics interactions. Int J Antimicrob Agents. 2000;15(2):125-9.
4. Lambert RJ, Lambert R. A model for the efficacy of combined inhibitors. J Appl Microbiol. 2003;95(4):734-43.
5. Grzybowska W, Banaszczyk-Ru M, Wójcik A, Tyski S. Comparison of checkerboard and time-kill methods for the analysis of two antibiotics combined. Med Dosw Mikrobiol. 2004;56(4):391-403.
6. Weiss G. Antimicrobial combination therapy. Wien Med Wochenschr. 2003;153(7-8):153-5.
7. Loza-Fernández E, Planes A, Rodríguez M. Hemocultivos. Procedimientos en Microbiología Clínica. Recomendaciones de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica. 2003. [Sitio en Internet]. [citado 14 jun 2006]. Disponible en: http://www.seimc.org/protocolos/microbiologia /cap3a.htm
8. National Committee for Clinical Laboratory Standards. Method for dilution antimicrobial susceptibility tests for bacteria that grow aerobically. Wayne, Pa. NCCLS; 1993. (Document M7-A3, Supplement 1).
9. Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing; Sixteenth Informational Supplement. CLSI; 2006. (Document M100-S16).
10. Berenbaum MC. A method for testing the synergy with any number of agents. J Infect Dis. 1978;137(2):122-30.
11. Eliopoulos GM. Synergism and antagonism. Infect Dis Clin North Am. 1989;3(3):399-406.
12. Johnson KB, Oski FA. Evaluation and use of laboratory test. En: Oski's Essential Pediatrics. Philadelphia: Lippincott-Raven Publishers; 1997. p. 649-52.
13. Grzybowska W, Banaszczyk-Ru, Tyski S. Comparison of the checkerboard and E-test methods used for the analysis of two antibiotics combination. Med Dosw Mikrobiol. 2005;57(1):65-75.
14. Bonapace CR, Bosso JA, Friedrich LV, White RL. Comparison of methods of interpretation of checkerboard synergy testing. Diagn Microbiol Infect Dis. 2002;44(4):363-6.
15. Kiffer CRV, Sampaio JLM, Sinto S, Oplustil CP, Koga PCM, Arruda AC, et al. In vitro synergy test of meropenem and sulbactam against clinical isolates of A. baumanii. Diag Microbiol Infec Dis. 2005;52(4):317-22.
16. Tasaka K, Ishida A, Chinzei T. Antimicrobial activity of carbapenems and the combined effect with aminoglycoside against recent clinical isolates of P. aeruginosa. Jpn J Antibiot. 2002;55(2):181-6.
17. Snydman DR, McDermott LA, Jacobus NV. Evaluation of in vitro interaction of Daptomycin with Gentamicin or beta-lactam antibiotics against S. aureus and enterococci by FIC index and timed-kill curves. J Chemother. 2005;17(6):614-21.
Recibido: 12 de enero de 2009.
Aprobado: 17 de febrero de 2009.
Lic. María Espino Hernández. Escuela Latinoamericana de Medicina (ELAM). Carretera Panamericana km 3 ½, Santa Fe, municipio Playa, La Habana, Cuba. Correo electrónico: mespino@elacm.sld.cu















