Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.44 n.2 Ciudad de la Habana abr.-jun. 2010
ARTÍCULOS ORIGINALES
Diseño de una formulación de ketotifeno 0,025 % colirio
Design of a Ketotifen formula: 0.025 % eyedrops
Yenilen Troche ConcepciónI; Caridad Margarita García PeñaII; Jacqueline Aylema Romero DíazIII; MSc. Martha Botet GarcíaI; Marisleydi BeguéIV
ILicenciada en Ciencias Farmacéuticas. Empresa Farmacéutica "Julio Trigo". La Habana, Cuba.
IIILicenciada en Bioquímica. Aspirante a Investigadora. CIDEM. La Habana, Cuba.
IVTécnica en Tecnología de la Salud. Empresa Farmacéutica "Julio Trigo". La Habana, Cuba.
RESUMEN
El colirio de ketotifeno se indica para aliviar los signos y síntomas de las conjuntivitis alérgicas, por ser este un potente antihistamínico H1 que muestra cierta capacidad para inhibir la liberación de histamina y otros mediadores en mastocitos. El objetivo del presente trabajo consistió en realizar el desarrollo tecnológico del colirio de ketotifeno 0,025 %, de producción nacional teniendo en cuenta que es un medicamento muy utilizado en la "Operación Milagro", en la cual participa la República de Cuba, para lo que se hace un diseño y los estudios de preformulación. Se estudió además, las especificaciones de calidad de la formulación seleccionada, la estabilidad del producto y el tiempo de vigencia de este. Se realizó el estudio de estabilidad acelerado y por vida de estante, para lo cual se emplearon 3 lotes del producto a escala piloto. El colirio resultó estable física, química y microbiológicamente envasado en frascos de polietileno de baja densidad, por espacio de 12 meses a temperatura ambiente
Palabras clave: Ketotifeno, estudio acelerado, vida de estante.
ABSTRACT
The Ketotifen eyedrops is prescribed to relieve the signs and symptoms of allergic conjunctivitis due to it is a powerful H1 antihistaminic with certain ability to inhibit the histamine release and other mediators in the case of mast cells. The aim of present paper was to perform the technological development of 0.025 % eyedrops Ketotifen of national production considering that it is a drug very used in the "Operación Milagro" with participation of the Republic of Cuba and with its own design and the pre-formula. Also, we studied the selected formula specifications, the product stability and its expiry date. An accelerated stability study was conducted and by shelf life using 3 batches of pilot scale product. The eyedrops was physically, chemically and microbiologically stable when it is bottling in low-density polyethylene flasks during 12 months at room temperature.
Key words: Ketotifen, accelerated study, shelf life.
INTRODUCCIÓN
La conjuntivitis alérgica es un trastorno que afecta a todas las edades, es muy frecuente y, a menudo, se asocia con otras enfermedades atópicas, como la rinitis alérgica. La conjuntivitis puede ser estacional (asociada al polen) o perenne (asociada a los ácaros ambientales); a menudo existen antecedentes familiares de alergia.1,2
Para su tratamiento existen medicamentos preventivos para los síntomas y otros de efecto dual, sintomático y preventivo a la vez. Los sintomáticos deben aplicarse cuando el paciente presenta picor y enrojecimiento ocular. Para estas situaciones sobresalen los derivados de la efedrina y antialérgicos antihistamínicos. En la categoría de los fármacos preventivos están los antialérgicos de acción dual, principalmente el ketotifeno, un antialérgico por vía ocular de efectos sintomáticos y preventivos.1,2
El ketotifeno es un potente antihistamínico H1 que muestra cierta capacidad para inhibir la liberación de histamina y otros mediadores en mastocitos. Se cree que actúa inhibiendo la liberación de mediadores químicos producidos por los leucocitos y los mastocitos sensibilizados.
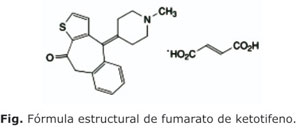
El fumarato de ketotifeno se conoce químicamente como: 4,9-dihidro-4-(1-metil-4-piperidinilideno)-10 H-benzo [4,5] ciclohepta [1,2-a] tiofen-10-ona (E)-butenodioato. De fórmula global C19H19NOS.C4H 4O4 y peso molecular 425,50. En la figura se muestra la estructura de este principio activo.1-3
Los colirios son disoluciones o suspensiones estériles, acuosas u oleosas, de uno o más principios activos destinados a su instalación en el ojo. El colirio de ketotifeno se indica para aliviar los signos y síntomas de las conjuntivitis alérgicas, por ser un antihistamínico de excelencia. Este medicamento se fabricará en la Empresa Laboratorio Farmacéutico "Julio Trigo", único productor de dicha forma farmacéutica en el país.4
La estabilidad de los productos farmacéuticos representa un importante eslabón en el desarrollo y formulación de toda forma terminada. De esta manera se puede definir las condiciones de almacenamiento en el envase propuesto y establecer la vida útil del producto farmacéutico. Estos estudios contemplan la conservación de la potencia, pureza, características organolépticas y su efectividad.5,6
El Centro para el Control Estatal de la Calidad de los Medicamentos (CECMED) establece para el registro de un nuevo medicamento la realización de los estudios de estabilidad.
Con el objetivo de sustituir importaciones al país, por concepto de medicamentos, se hace necesario el desarrollo del colirio de ketotifeno 0,025 % de producción nacional, que cumpla con las especificaciones de calidad establecidas.
MÉTODOS
Análisis del ingrediente farmacéutico activo
El fumarato de ketotifeno empleado para las investigaciones, es del fabricante Zhejiang, país: China; proveedor: FARMACUBA. Los ensayos analíticos se realizaron según la técnica desarrollada y validada en el Centro de Investigación y Desarrollo de Medicamentos; se evaluaron los parámetros que se mencionan a continuación: descripción, solubilidad, identificación, valoración, pérdida por desecación, punto de fusión, residuos de ignición, sustancias relacionadas.
Diseño de las formulaciones
Se elaboraron varias formulaciones con la finalidad de seleccionar la mejor, para diseñar el colirio a producir, para lo cual se utilizó la materia prima que cumplió con los requerimientos de calidad farmacéutica.
Se diseñaron 6 formulaciones que se muestran en el cuadro. Para ello se trabajó haciendo variaciones en los componentes, en cuanto a proporciones de los componentes de las formulaciones con el objetivo de lograr un producto terminado que cumpliera con las especificaciones de calidad establecidas por el fabricante. Se realizó además un estudio de pre-estabilidad de cada una de las formulaciones desarrolladas a fin de seleccionar la formulación donde existiera la menor disminución de los principios activos, así como la mayor estabilidad del pH en el tiempo, con el objetivo de determinar la formulación más estable.
Control de la calidad del producto terminado
Se evaluaron los parámetros establecidos, por el fabricante, en las especificaciones de calidad del producto terminado, entre los que podemos citar: características organolépticas, identificación, pH, valoración, contenido de preservo, producto de degradación, volumen, esterilidad, con el objetivo de determinar si el producto cumplía con las especificaciones de calidad establecidas y emplearlo en los estudios de estabilidad.
El método analítico empleado por cromatografía líquida de alta resolución, en la identificación y en la valoración del principio activo en el producto terminado, aplicable al control de la calidad y al estudio de estabilidad, fue desarrollado y validado en el Centro de Investigación y Desarrollo de Medicamentos, porque no existen reportes para la cuantificación del ketotifeno en el producto terminado, el que resultó lineal, específico, preciso y exacto en el rango de concentraciones estudiados.
Estudio de estabilidad
El presente estudio se realizó por el método de estabilidad acelerada y de vida de estante. Se emplearon muestras de 3 lotes industriales, identificados como: 7001, 7002 y 700, envasados en frascos plásticos de polietileno de baja densidad por 5 mL (conformados, dosificados y sellados en la máquina Bottelpack, con tapas perforantes de polipropileno de alta densidad, prefabricadas).
En el estudio de estabilidad acelerada, se almacenaron las muestras de los lotes estudiados a temperatura de 40 ± 2 ºC y 75 ± 5 % de humedad relativa; se analizaron al inicio, al mes, a los 2, 3 y 6 meses de fabricado; se evaluron en el estudio el comportamiento de las características organolépticas, el pH, la valoración del principio activo y los productos de degradación.
En el estudio de estabilidad por vida de estante, los lotes estudiados se almacenaron a temperatura ambiente: 30 ± 2 ºC y 70 ± 5 % de humedad relativa; protegidos de la luz; se valoraron al inicio, a los 3, 6, 9 y 12 meses de fabricados; se evaluaron en el estudio el comportamiento de las características organolépticas, el pH, la valoración del principio activo, el contenido de preservo, los productos de degradación y la esterilidad. Se realizó además las pruebas de efectividad de preservo, al inicio y al final de estudio, con el objetivo de demostrar la efectividad del cloruro de benzalconio.
Teniendo en cuenta que el producto terminado se presenta en envases multidosis, se realizó el estudio de estabilidad de frasco en uso, se estudió un lote por 7 días almacenado a temperatura ambiente (30 ºC).
RESULTADOS
Análisis de la materia prima
El ketotifeno fumarato cumplió con las especificaciones establecidas en la Farmacopea China (CP, 2000); adicionalmente se analizaron también las sustancias auxiliares con que se preparó la formulación teniendo la calidad farmacéutica requerida.
Diseño de las formulaciones
Como parte del diseño se probaron varias preformulaciones, las cuales fueron chequeadas en el tiempo por espacio de 3 meses. Los resultados aparecen en la tabla 1, en la cual se observa que la formulación VI es donde se evidencia la menor disminución del principio así como menor variación en los valores de pH, con el empleo de esta en la fabricación de los lotes industriales para efectuar posteriormente los estudios de estabilidad, realizando previamente el control de la calidad de cada uno de los lotes.
Control de la calidad del producto terminado
En el proceso de elaboración del colirio de ketotifeno se obtuvieron buenos resultados en relación a la disolución de las materias primas, a los valores de pH, valoración del producto terminado, volumen, contenido de preservo, productos de degradación y esterilidad.
Los resultados de los análisis de los lotes 7001, 7002 y 7003 envasados en frascos plásticos de polietileno de baja densidad, material de envase similar al que se emplea en el medicamento líder, se reportan en la tabla 2.
Estudio de estabilidad
Los resultados del estudio de estabilidad acelerada a 40 ºC y 75 % de humedad relativa, correspondiente a los lotes 7001, 7002 y 7003, se reportan en la tabla 3; se demuestra que el producto terminado no presenta cambios significativos.
Los resultados del estudio de vida de estante, al inicio, 3, 6, 9 y 12 meses, se muestran en la tabla 4, donde se observa que el producto terminado cumple con las especificaciones de calidad durante el estudio. Se realizó además las pruebas de efectividad de preservo, al inicio y al final de estudio, lo que demuestra que el preservo empleado era idóneo.
Tabla 4. Resultados del estudio de estabilidad por vida de estante
| Ensayos | Inicial | 3 meses | 6meses | 9 meses | 12 meses |
| Lote 7001 | |||||
| C. organolépticas | Responde | Responde | Responde | Responde | Responde |
| pH | 5,40 | 5,35 | 5,36 | 5,29 | 5,22 |
| Valoración | 98,39 % | 98,02% | 97,46 % | 97,34 % | 97,22 % |
| Contenido de preservo | 91,0 % | - | - | - | 90,9 % |
| Esterilidad | Responde | - | - | - | Responde |
| Producto de degradación | Inapreciables | Inapreciables | Inapreciables | Inapreciables | Inapreciables |
| Lote 7002 | |||||
| C. organolépticas | Responde | Responde | Responde | Responde | Responde |
| pH | 5,41 | 5,41 | 5,22 | 5,15 | 5,10 |
| Valoración | 100,53 % | 100,49 % | 100,11 % | 100,02 % | 99,83 % |
| Contenido de preservo | 95,0 % | - | - | - | 94,5 % |
| Esterilidad | Responde | - | - | - | Responde |
| Producto de degradación | Inapreciables | Inapreciables | Inapreciables | Inapreciables | Inapreciables |
| Lote 7003 | |||||
| C. organolépticas | Responde | Responde | Responde | Responde | Responde |
| pH | 5,38 | 5,41 | 5,38 | 5,52 | 5,67 |
| Valoración | 102,24 % | 102,02 % | 102,24 % | 101,89 % | 101,80 % |
| Contenido de preservo | 99,5 % | - | - | - | 99,0 % |
| Esterilidad | Responde | - | - | - | Responde |
| Producto de degradación | Inapreciables | Inapreciables | Inapreciables | Inapreciables | Inapreciables |
Los resultados del estudio de frasco en uso, se reportan en la tabla 5, donde se demuestra que el producto se mantiene estable durante su uso.
DISCUSIÓN
Análisis de la materia prima
Los resultados de los ensayos que se realizaron a la materia prima de ketotifeno fumarato, demuestran que se encuentra aprobada para su uso en la formulación porque todos los resultados de los ensayos realizados se encuentran dentro de los límites establecidos.
Todas las sustancias auxiliares empleadas en la formulación fueron analizadas cumpliendo con la calidad requerida para su uso en formulaciones farmacéuticas.
Diseño de las formulaciones
En el estudio de preformulaciones se ensayaron 6 variantes, teniendo en cuenta las características del ingrediente farmacéutico activo y la necesidad de preservar la formulación para evitar contaminación microbiana.
Los resultados obtenidos del estudio de preformulación demostraron que la formulación VI, era la idónea porque todos los parámetros evaluados se encontraban dentro de los límites establecidos para el producto terminado en los 3 meses de duración del estudio de preformulación.
Control de la calidad del producto terminado
En los 3 lotes del producto terminado evaluados, todos los resultados obtenidos se encuentran dentro de los límites establecidos en las especificaciones de calidad del colirio de ketotifeno 0,025 %, lo que demuestra que los lotes analizados podían emplearse para realizar los estudios de estabilidad correspondientes.
Estudio de estabilidad
Los resultados obtenidos en el estudio de estabilidad acelerado, se encuentran dentro de los límites establecidos. No se observan cambios significativos en las características organolépticas, ni en el pH, ni en la valoración de las muestras estudiadas, lo que demuestra que las condiciones drásticas no afectaron la estabilidad química, ni física del producto terminado.
Los resultados del estudio de estabilidad por vida de estante, demuestran que en el producto terminado los parámetros evaluados de características organolépticas, el pH, y la valoración se encuentran dentro de los límites de las especificaciones de calidad. Los resultados correspondientes al conteo microbiológico se encuentran dentro de los límites establecidos, en ausencia de microorganismos patógenos, a diferentes intervalos de tiempo, durante el período analizado, lo que se corresponde con los resultados observados para el contenido de preservo (cloruro de benzalconio), que mantiene su cuantía en el tiempo. El estudio de efectividad de preservo realizado al inicio y al finalizar el estudio demostró que el preservo empleado en la formulación es efectivo y evita la contaminación microbiana de la formulación, lo cual demuestra que el preservo empleado impedía la proliferación microbiana y era capaz de preservar la formulación desarrollada.
Los resultados obtenidos en el estudio de frasco en uso, se encuentran dentro de los límites establecidos para el producto terminado, lo cual demuestra que el medicamento se mantiene estable durante su uso por los pacientes que lo necesitan en el tratamiento, almacenado a temperatura ambiente.
Se puede concluir que el producto terminado es estable por un período de 12 meses, ya que cumple con las especificaciones de calidad descrita por el fabricante.
REFERENCIAS BIBLIOGRÁFICAS
1. Pharmacopoeia of the People's Republic of China. Volume II. English Edition. Beijing: Chemical Industry Press; 2000. p. 372.
2. Real Farmacopea Española. 3ra ed. Madrid: Ministerio de Sanidad y Consumo; 2005. p. 1992-4.
3. British National Formulary. British Medical Association, Royal Pharmaceutical Society of Great Britain. Volume I & II. Monographs: Medicinal and Pharmaceutical substances. Ketotifen Fumarate. London: BMA, RPS; 2003.
4. Iraizoz A. Conferencia de Tecnología Farmacéutica II. La Habana: Instituto de Farmacia y Alimentos (IFAL); 1990. p.162-268.
5. Regulación No. 16-2000: Buenas Prácticas de Fabricación de Productos Farmacéuticos. La Habana: Centro Estatal para el Control de Medicamentos (CECMED); 2000.
6. Regulación No. 23-2000: Requerimientos de los estudios de estabilidad para el registro de productos farmacéuticos nuevos y conocidos. La Habana: Centro Estatal para el Control de Medicamentos (CECMED); 2000.
Recibido: 8 de diciembre de 2009.
M. C. Caridad Margarita García Peña. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). Ave. 26 No. 1 605 entre Boyeros y Puentes Grandes. CP 10 600. Plaza de la Revolución, La Habana, Cuba. Correo electrónico: caridadgp@infomed.sld.cu