Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.44 n.2 Ciudad de la Habana abr.-jun. 2010
ARTÍCULOS ORIGINALES
Diseño de una formulación de fenilefrina 10 % y tropicamida 1 % colirio
Design of a 10 % Phenylephrine and 1 % Tropicamide formula: eyedrops
Georgy Armando Zuñiga DedoriteI; Caridad Margarita García PeñaII; Martha Botet GarcíaIII; Yenilen Troche ConcepciónIII; Yanet Montes de Oca PortoIV; Gerardo Baró RománV
IIngeniero Químico. Empresa Farmacéutica "Julio Trigo". La Habana, Cuba.
IIILicenciada en Ciencias Farmacéuticas. Empresa Farmacéutica "Julio Trigo". La Habana, Cuba.
IVTécnica en Química. CIDEM. La Habana, Cuba.
VLicenciado en Microbiología. Centro de Inmunoensayo. La Habana, Cuba.
RESUMEN
El colirio de fenilefrina 10 % y tropicamida 1 % se emplea en la práctica médica como antihistamínico, analgésico, midriáticos y ciclopléjico. El objetivo del presente trabajo consistió en desarrollar una formulación de fenilefrina 10 % y tropicamida 1 % que cumpliera con las especificaciones de calidad establecidas por el fabricante, que fuera estable física, química y microbiológicamente, para lo cual se realizó un diseño y los estudios de preformulación. Se estudió además, las especificaciones de calidad de la formulación seleccionada, la estabilidad del producto y el tiempo de vigencia de este. Se desarrolló y validó un método analítico para el control de la calidad y el estudio de estabilidad del producto terminado por cromatografía líquida de alta resolución. Se realizaron los resultados analíticos del estudio de estabilidad acelerado y por vida de estante, para lo cual se emplearon 3 lotes del producto a escala piloto. El colirio resultó estable física, química y microbiológicamente envasado en frascos de polietileno de baja densidad, por un tiempo de 12 meses almacenados a temperatura ambiente.
Palabras clave: Fenilefrina, tropicamida, estudio acelerado, vida de estante.
ABSTRACT
The 10 % Phenylephrine and 1 % Tropicamide eyedrops is used in medical practice as antihistaminic, analgesic, mydiatric and cycloplegic. The aim of present paper was to develop a 10% Phenylephrine and 1 % Tropicamide formula fulfilling the quality specifications established by manufacturer physically, chemically and microbiologically stable with the performing of a design and pre-formula studies. Also, we studied the quality specifications of selected formula, the product stability and its expiry time. An analytical method was developed and validated to quality control and stability study of the finished product by high-performance liquid chromatography. Analytical results of accelerated stability study and by shelf life using 3 batches of product at pilot scale. Eyedrops was physically, chemically and microbiologically stable when it was bottling in low density polyethylene flasks during 12 months of storage at room temperature.
Key words: Phenylephrine, Tropicamide, accelerated study, shelf life.
INTRODUCCIÓN
En Cuba, con vistas al desarrollo de la Industria Farmacéutica fue necesario modernizar la tecnología de fábrica e incrementar el arsenal terapéutico de los productos, para ello el Laboratorio Farmacéutico "Julio Trigo", único productor en el país de medicamentos de uso oftálmico tiene un programa de desarrollo de colirios con el objetivo de disponer de productos que mejoren la calidad de vida de la población y permitan ser competitivos en el ámbito internacional.
En la actualidad se han incrementado las operaciones de la vista en Cuba, como parte de la "Operación Milagro", lo que conlleva la importación de productos oftálmicos para el tratamiento pre y posoperatorio. Entre los productos que se emplean, en esta operación, se encuentra el colirio de fenilefrina 10 % y tropicamida 1 % por su acción como: antihistamínico, analgésico, midriáticos y ciclopléjico.1,2
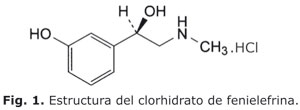
El clorhidrato de fenilefrina se conoce químicamente como: benzenometanol, 3-hidroxi-a-[(metilamino)metil]-, hidrocloruro (R)-.(-)-m-
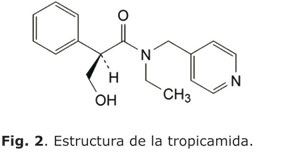
hidroxi-a-[(metilamino)metil]benzil alcohol hidrocloruro. De fórmula global C9H13NO2.HCl y peso molecular 203,67. En la figura 1 se muestra la estructura de este principio activo.3La tropicamida es el nombre genérico del principio activo, siendo el nombre químico: (2RS)-N-etil-3-hidroxi-2-fenil-N-(piridin-4-ilmethil)propanamida, la fórmula global C17H20N2O2 y peso molecular 284,4. En la figura 2 se muestra la estructura de este principio activo.3
Con el objetivo de sustituir importaciones al país, por concepto de medicamentos, se hace necesario el desarrollo del colirio de fenilefrina 10 % y tropicamida 1 % de producción nacional, que cumpla con las especificaciones de calidad establecidas.
MÉTODOS
Análisis de la materia prima
Los principios activos empleados para la investigación fueron la fenilefrina clorhidrato y la tropicamida, ambas del fabricante Bocheringer y fueron importada por FARMACUBA desde Alemania.
Los ensayos analíticos se realizaron según la Farmacopea de Estados Unidos, (USP 30, 2007)4 para ambos principios activos.
Diseño de las formulaciones
Se elaboraron varias formulaciones con la finalidad de seleccionar la que evitara la oxidación de la fenilefrina clorhidrato y tuviera mayor estabilidad químico-física, para ello se utilizaron materias primas que cumplían con los requerimientos de calidad farmacéutica reportados en la USP 30, 2007.4
Se diseñaron 6 formulaciones que se muestran en el cuadro. Se realizó primeramente el análisis de los parámetros de calidad establecidos por el fabricante, teniendo en cuenta el pH reportado en la literatura para el producto terminado, así como el límite establecido para la valoración de la fenilefrina y la tropicamida. Se realizó además un estudio de pre-estabilidad de cada una de las formulaciones desarrolladas con el objetivo de seleccionar la formulación donde existiera la menor disminución de los principios activos, así como la mayor estabilidad del pH en el tiempo, a fin de determinar la formulación más estable.
Control de la calidad del producto terminado
Se evaluaron los parámetros establecidos en las especificaciones de calidad del producto terminado, entre los que se puede citar: características organolépticas, identificación de fenilefrina, identificación de tropicamida, pH, valoración de fenilefrina, valoración de tropicamida, contenido de preservo, producto de degradación, volumen, esterilidad.
El método analítico empleado por cromatografía líquida de alta resolución, en la identificación y en la valoración de cada uno de los principios activos en el producto terminado, fue desarrollado y validado en el Centro de Investigación y Desarrollo de Medicamentos, porque no existen reportes en la literatura de métodos analíticos para la determinación simultánea de ambos principios activos, basado en la separación del principio activo a través de una columna cromatográfica Lichrosorb RP-18 (5 µm) (250 x 4 mm), con detección UV a 253 nm, empleando una fase móvil compuesta por metanol, agua destilada y 1-octanosulfonato de sodio a pH 3,0, ajustado con ácido fosfórico y la cuantificación de este frente a una muestra de referencia, compuesto por la mezcla de los 2 principios activos objetos de estudio, con el empleo del método del estándar externo. El método desarrollado resultó lineal, específico, preciso y exacto en el rango de concentraciones estudiadas.
Estudio de estabilidad
El presente estudio se realizó por el método de estabilidad acelerada y de vida de estante. Se emplearon muestras de 3 lotes industriales, identificados como: 7001, 7002 y 7003; envasados en frascos plásticos de polietileno de baja densidad por 5 mL (conformados, dosificados y sellados en la máquina Bottelpack, con tapas perforantes de polipropileno de alta densidad, prefabricadas).
En el estudio de estabilidad acelerada, se almacenaron las muestras de los lotes estudiados a temperatura de 40 ± 2 ºC y 75 ± 5 % de humedad relativa y se analizaron al inicio, al mes, a los 2, 3 y 6 meses de fabricado; se evaluroon en el estudio el comportamiento de las características organolépticas, el pH, la valoración de ambos principios activos, así como los productos de degradación.5
En el estudio de estabilidad por vida de estante, los lotes estudiados se almacenaron a temperatura ambiente: 30 ± 2 ºC y 70 ± 5 % de humedad relativa, protegidos de la luz, y se valoraron al inicio, a los 3, 6, 9 y 12 meses de fabricados; se evaluaron en el estudio el comportamiento de las características organolépticas, el pH, la valoración de ambos principios activos, el contenido de preservo, los productos de degradación y la esterilidad. Se realizó además las pruebas de efectividad de preservo, al inicio y al final de estudio, con el objetivo de demostrar la efectividad del cloruro de benzalconio.
Teniendo en cuenta que el producto terminado se presenta en envases multidosis, se realizó el estudio de estabilidad de frasco en uso, se estudió un lote por 7 días almacenado a temperatura ambiente (30 ºC).
RESULTADOS
Análisis de la materia prima
Las materias primas, fenilefrina clorhidrato y tropicamida, cumplieron con las especificaciones establecidas en la USP 30, 2007; adicionalmente se analizaron también las sustancias auxiliares con que se preparó la formulación teniendo la calidad farmacéutica requerida.
Diseño de las formulaciones
Como parte del diseño se probaron varias preformulaciones, las cuales fueron chequeadas en el tiempo, por espacio de 3 meses. Los resultados aparecen en la tabla 1; se observa que en la formulación 5 era menor la disminución de los porcentajes de ambos principios activos, además de evidenciarse menor variación en los valores de pH.
Control de la calidad del producto terminado
En la tabla 2 se muestran los resultados del control de calidad al producto terminado (ensayo 5). Como se puede apreciar todos los resultados se encuentran dentro de los límites especificados para el producto terminado.
Tabla 2. Resultados iníciales de los lotes en estudio
| Ensayos | Lotes | Límites | ||
| 7001 | 7002 | 7003 | ||
| Características organolépticas | Responde | Responde | Responde | Solución incolora, transparente, sin partículas extrañas |
| Identificación de fenilefrina clorhidrato | Responde | Responde | Responde | El tiempo de retención del pico principal obtenido en el cromatograma de la solución muestra coincide con el tiempo de retención del obtenido en el cromatograma de la solución de referencia. |
| Identificación de tropicamida | Responde | Responde | Responde | El tiempo de retención del pico principal obtenido en el cromatograma de la solución muestra coincide con el tiempo de retención del obtenido en el cromatograma de la solución de referencia. |
| Volumen por frasco (mL) | 5,1 | 5,1 | 5,0 | No menor de 5,0 |
| pH | 4,32 | 4,23 | 4,20 | 4,0-5,8 |
| Valoración de fenilefrina clorhidrato | 102,5 % | 101,8 % | 101,9 % | 95,0–115,0 % |
| Valoración de tropicamida | 100,6 % | 102,7 % | 102,9 % | 95,0–110,0 % |
| Esterilidad | Cumple | Cumple | Cumple | Ausencia de microorganismos viables |
| Productos de degradación | Inapreciables | Inapreciables | Inapreciables | No debe observarse picos adicionales a los de la fenilefrina y la tropicamida, aparecen los productos de degradación |
Estudio de estabilidad
Los resultados del estudio de estabilidad acelerada a 40 ºC y 75 % de humedad relativa (HR), con la formulación seleccionada, se reportan en la tabla 3; se demuestra que el producto terminado no presenta cambios significativos.
Tabla 3. Resultados del estudio de estabilidad acelerada
| Parámetros | Inicial | 1 mes | 2 meses | 3 meses | 6 meses |
| Lote 7001 | |||||
| Características organolépticas | Responde | Responde | Responde | Responde | Responde |
| pH | 4,32 | 4,22 | 4,31 | 4,28 | 4,25 |
| Valoración de fenilefrina clorhidrato | 102,5 % | 101,4 % | 100,5 % | 99,9 % | 98,1 % |
| Valoración de tropicamida | 100,6 % | 99,9 % | 99,0 % | 98,4 % | 97,1 % |
| Productos de degradación | Inapreciables | Inapreciables | Inapreciables | Inapreciables | Inapreciables |
| Lote 7002 | |||||
| Características organolépticas | Responde | Responde | Responde | Responde | Responde |
| pH | 4,23 | 4,22 | 4,11 | 4,14 | 4,21 |
| Valoración de fenilefrina clorhidrato | 101,8 % | 101,0 % | 100,4 % | 99,2 % | 97,4 % |
| Valoración de tropicamida | 102,7 % | 101,9 % | 100,8 % | 99,5 % | 98,1 % |
| Productos de degradación | Inapreciables | Inapreciables | Inapreciables | Inapreciables | Inapreciables |
| Lote 7003 | |||||
| Características organolépticas | Responde | Responde | Responde | Responde | Responde |
| pH | 4,20 | 4,15 | 4,25 | 4,18 | 4,27 |
| Valoración de fenilefrina clorhidrato | 101,9 % | 100,9 % | 100,0 % | 99,0 % | 97,2 % |
| Valoración de tropicamida | 102,9 % | 101,8 % | 100,9 % | 99,5 % | 98,3 % |
| Productos de degradación | Inapreciables | Inapreciables | Inapreciables | Inapreciables | Inapreciables |
Los resultados del estudio de vida de estante, al inicio, 3, 6, 9 y 12 meses, se muestran en la tabla 4; se observa que el producto terminado cumple con las especificaciones de calidad durante el estudio. Se realizó además las pruebas de efectividad de preservo, al inicio y al final de estudio, lo que demuestra que el preservo empleado era idóneo.
Tabla 4. Resultados del estudio de estabilidad por vida de estante
| Parámetros | Inicial | 3 meses | 6 meses | 9 meses | 12 meses |
| Lote 7001 | |||||
| Características organolépticas | Responde | Responde | Responde | Responde | Responde |
| pH | 4,32 | 4,32 | 4,23 | 4,05 | 4,12 |
| Valoración de fenilefrina clorhidrato | 102,5 % | 100,6 % | 100,0 % | 99,6 % | 98,8 % |
| Valoración de tropicamida | 100,6 % | 99,0 % | 98,9 % | 98,5 % | 97,4 % |
| Productos de Degradación | Inapreciables | Inapreciables | Inapreciables | Inapreciables | Inapreciables |
| Contenido de preservo | 99,5 % | - | - | - | 99,1 % |
| Esterilidad | Cumple | - | - | - | Cumple |
| Lote 7002 | |||||
| Características organolépticas | Responde | Responde | Responde | Responde | Responde |
| pH | 4,23 | 4,20 | 4,25 | 4,17 | 4,08 |
| Valoración de fenilefrina clorhidrato | 101,8 % | 99,9 % | 99,5 % | 99,0 % | 98,5 % |
| Valoración de tropicamida | 102,7 % | 99,9 % | 99,5 % | 99,4 % | 98,6 % |
| Productos de degradación | Inapreciables | Inapreciables | Inapreciables | Inapreciables | Inapreciables |
| Contenido de preservo | 99,9 % | - | - | - | 99,4 % |
| Esterilidad | Cumple | - | - | - | Cumple |
| Lote 7003 | |||||
| Características organolépticas | Responde | Responde | Responde | Responde | Responde |
| pH | 4,20 | 4,10 | 4,19 | 4,12 | 4,16 |
| Valoración de fenilefrina clorhidrato | 101,9 % | 99,7 % | 99,3 % | 98,9 % | 98,4 % |
| Valoración de tropicamida | 102,9 % | 100,4 % | 100,1 % | 99,6 % | 99,0 % |
| Productos de degradación | Inapreciables | Inapreciables | Inapreciables | Inapreciables | Inapreciables |
| Contenido de preservo | 99,8 % | - | - | - | 99,2 |
| Esterilidad | Cumple | - | - | - | Cumple |
Los resultados del estudio de frasco en uso, se reportan en la tabla 5; se demuestra que el producto se mantiene estable durante su uso.
DISCUSIÓN
Análisis de la materia prima
Los resultados de los ensayos que se realizaron a las materias primas de fenilefrina clorhidrato y tropicamida, demuestran que se encuentran aprobadas para su uso en la formulación porque todos los resultados de los ensayos realizados se encuentran dentro de los límites establecidos.
Todas las sustancias auxiliares empleadas en la formulación fueron analizadas cumpliendo con la calidad requerida para su uso en formulaciones farmacéuticas, ya que todos los resultados obtenidos se encuentran dentro de los límites establecidos, para cada una de ellas.
Diseño de las formulaciones
Los resultados obtenidos del estudio de preformulación demostraron que el ensayo 5, era el idóneo debido a que resultó el más estable porque tenía muy poca variación en su valoración durante el tiempo de análisis, además presentaba la menor variación en el pH, manteniendo sus características organolépticas en el tiempo de duración del estudio de preformulación.
Control de la calidad del producto terminado
En los 3 lotes del producto terminado evaluados, los resultados obtenidos se encuentran dentro de los límites establecidos en las especificaciones de calidad del colirio de fenilefrina 10 % y tropicamida 1 %, lo que demuestra que los lotes analizados podían emplearse para realizar los estudios de estabilidad correspondientes.
Estudio de estabilidad
Los resultados del estudio de estabilidad acelerada (temperatura controlada 40 ºC y 75 % HR) demuestran que se mantienen las características organolépticas, pH, no se observan productos de degradación y valoración de cada uno de los principios activos dentro de los límites establecidos en las especificaciones de calidad, lo que mantiene estable el producto y demuestra que el tratamiento no alteró su calidad.
Los resultados del estudio de estabilidad por vida de estante, demuestran que en el producto terminado los parámetros evaluados de características organolépticas, el pH y la valoración se encuentran dentro de los límites de las especificaciones de calidad. Además se demostró la estabilidad microbiológica del colirio, analizado al inicio y al final por el método general de esterilidad reportado en la Farmacopea de los Estados Unidos (USP 30, 2007), durante el tiempo de duración del estudio. Así como el contenido de preservo (cloruro de benzalconio) se encuentra dentro de los límites establecidos en las especificaciones de calidad del producto terminado; el estudio de efectividad de preservo realizado al inicio y al finalizar el estudio demostró que el preservo empleado en la formulación es efectivo y evita la contaminación microbiana de la formulación e impide la proliferación microbiana y es capaz de preservar la formulación desarrollada.
Los resultados obtenidos en el estudio de frasco en uso, se encuentran dentro de los límites establecidos para el producto terminado, lo que demuestra que el medicamento se mantiene estable durante el uso del mismo por los pacientes que lo necesitan en su tratamiento, almacenándose a temperatura ambiente.
Se puede concluir que el producto terminado es estable por un período de 12 meses, ya que cumple con las especificaciones de calidad descrita por el fabricante.
REFERENCIAS BIBLIOGRÁFICAS
1. PDR. Physician´s Desk Reference. 57 ed. New York: Inc at Montuale; 2003. p. 332, 2193, 2905, 3270.
2. Goodman A, Gilman A. Las bases farmacológicas de la terapéutica. Tomo II. 3ra ed. La Habana: Editorial Científico Técnica; 1994. p. 1723-5. (Edición Revolucionaria).
3. The Index Merck. An Encyclopedia of Chemicals, Drugs, and Biologicals. 12th ed. New York: Published by Merck; 1996.
4. Farmacopea de los Estados Unidos. USP 30. The United States Pharmacopeial Convention. Estados Unidos de América NF-25. Rockville: Mack Printing; 2007. Versión electrónica en CD.
5. Regulación No. 23-2000: Requerimientos de los estudios de estabilidad para el registro de productos farmacéuticos nuevos y conocidos. La Habana: Centro Estatal para el Control de Medicamentos (CECMED); 2000.
Recibido: 8 de diciembre de 2009.
M. C. Caridad Margarita García Peña. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). Ave. 26 No. 1 605 entre Boyeros y Puentes Grandes. CP 10 600. Plaza de la Revolución, La Habana, Cuba. Correo electrónico: caridadgp@infomed.sld.cu