Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.44 n.4 Ciudad de la Habana oct.-dic. 2010
ARTÍCULOS ORIGINALES
Microencapsulación de tramadol en ácido poliláctico mediante secado por aspersión
Microencapsulation of Tramadol in polyactic acid by aspersion drying
Orestes Darío López HernándezI; Martha Gómez CarrilII; Alejandro Saúl Padrón YaquisIII; Arturo Toledo RiveroIV; Carlos Alfredo Toledo SanchezV; Enma Reyes SanchezVI; Edilso Reguera RuizVII; Julio Duque RodríguezVIII; Bertha López PelaezIX
IIngeniero Químico. Máster en Ingeniería de los Procesos Biotecnológicos. Investigador Agregado. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). La Habana, Cuba.
IIMáster en Tecnología y Control de Medicamentos. Investigadora Auxiliar. CIDEM. La Habana, Cuba.
IIIDoctor en Ciencias Farmacéuticas. Investigador Auxiliar. CIDEM. La Habana, Cuba.
IVDoctor en Ciencias Técnicas. CIDEM. La Habana, Cuba.
VLicenciado en Química. CIDEM. La Habana, Cuba.
VIMáster en Química Analítica. CIDEM. La Habana, Cuba.
VIIDoctor en Ciencias Químicas. Investigador Titular. CIDEM. La Habana, Cuba.
VIIIDoctor en Ciencias Químicas. Investigador Auxiliar. CIDEM. La Habana, Cuba.
IXTécnica en Química. CIDEM. La Habana, Cuba.
RESUMEN
Un tema de gran interés para la industria farmacéutica moderna lo constituye sin duda, la búsqueda de tecnologías para la obtención de formas farmacéuticas para la administración y transporte de citostáticos, antiinflamatorios, péptidos y hormonas, entre otros fármacos, que impliquen una reducción de su toxicidad o una liberación controlada del principio activo para lograr con ello un aumento de su eficacia. En el presente trabajo se estudió la influencia del flujo de líquido de alimentación, del flujo de aire de atomización y de secado, y se evaluaron diferentes características fisicoquímicas y morfológicas (tamaño, forma, porosidad y distribución de tamaño de partículas, eficiencia de encapsulación del principio activo) de microesferas de tramadol. Como resultado se obtuvo que es posible lograr microesferas con un tamaño de 18,93 ± 2,31 µm con forma esférica, una superficie no porosa, y se demostró mediante difractometría de rayos X la encapsulación del tramadol en el polímero.
Palabras clave: Tramadol, secado por aspersión, microencapsulación.
ABSTRACT
An interesting subject for pharmaceutical industry is the search of technologies to achieve pharmaceutical ways for administration and transportation of cytostatics, anti-inflammatories, peptides and hormones among other drugs implicating a reduction of its toxicity or a contolled releasing of active principle to increase its effectiveness. In present paper authors studied the influence of fluid flow in feeding, of atomization air and of driying; different physicochemical and morphological features (size, shape, porosity and distribution in the particles size, and the effectiveness of active principle encapsulation) of Tramadol's microspheres. As result, it was possible to achieve microspheres of 18.93 ± 2.31 µm with an spherical shape, a non-porous surface demostrating it by X-ray difractometry and Tramadol encapsulation in the polymer.
Key words: Tramadol, aspersion driying, microencapsulation.
INTRODUCCIÓN
El tramadol HCl es un agente sintético, análogo a la codeína con una nomenclatura según la Unión Internacional para la Química Pura y Aplicada (IUPAC): rac-(1R, 2R)-2-(dimetilaminometil)-1-(3-metoxifenil)-ciclohexanol, fórmula global C16H25NO2, masa molar 263,4 g/mol, un tiempo de vida media de 5 a 7 h, una biodisponibilidad entre 68 y 72 % y las vías de administración son la oral, intravenosa e intramuscular. El efecto del tramadol tiene una duración de 4 a 6 h, es por esto que si se microencapsula en un polímero de liberación controlada en forma de microesferas, puede hacer más duradero su efecto.1-6
El secado por aspersión ha sido empleado satisfactoriamente en el desarrollo de un gran número de productos. Uno de ellos es la eritropoyetina humana recombinante con la que se ha alcanzado una eficiencia de encapsulación de 97,9 %, un rendimiento de 40,7 %, un tamaño de 8,23 ± 0,05 µm, y una liberación inicial de solo 10 %.7 En un estudio de la encapsulación de toxoide tetánico a diferentes escalas, considerándose de laboratorio (1 g) y de desarrollo (10 g), se alcanzaron rendimientos de 63 y 69 %, respectivamente. Se obtuvo un tamaño de 14,2 y 21 µm y una liberación inicial de 29,8 y 36,5 %.8 En la preparación de microesferas de ácido poliláctico cargadas con tetraciclina HCl, empleando temperaturas de entrada y salida de 46 y 36 °C respectivamente, se alcanzó un rendimiento de 50 %.9 Algunos autores han realizado trabajos con moléculas modelos, con seroalbúmina bovina encapsulada en el polímero Resomer® R-202 se alcanzó un rendimiento entre 50 y 70 %. De un grupo de solventes y mezclas estudiados, con diclorometano se alcanzó la mejor eficiencia de encapsulación de 64,9 % y la menor liberación inicial de 9,2 ± 0,1 % ,y además se demostró la ventaja de utilizar los solventes puros y no en mezclas.10
Algunas consideraciones tecnológicas referidas por varios autores se han tenido en cuenta para este estudio como, por ejemplo, evitar el uso de tensoactivos manteniendo emulsión a una temperatura de 5 °C;11 trabajar con la menor viscosidad de la solución del polímero por su gran impacto en el rendimiento y con flujos de aire de atomización entre 400 y 500 L/h para garantizar tamaños de partículas menores que 10 µm;12 trabajar con ácidos polilácticos y sus copolímeros a una temperatura de entrada menor o igual que 50 °C para evitar la deformación de las microesferas ya que su temperatura de transición vítrea es aproximadamente 58 °C.13
La microencapsulación de tramadol en un polímero de liberación controlada mediante secado por aspersión, posibilitará extender el efecto de este por más de 6 h; por tanto, el objetivo del presente trabajo fue el estudio de la influencia de un grupo de parámetros de operación sobre el proceso de obtención de microesferas de tramadol mediante secado por aspersión así como la caracterización de estas.
MÉTODOS
Se empleó como polímero ácido poliláctico Resomer® R-202 Boehringer Ingelheim y tramadol F-200307001, USP 29. A fin de estudiar diferentes variables y condiciones operacionales de un sistema de liberación controlada de tramadol con el empleo del método de secado por aspersión, se realizó un diseño experimental factorial 22 de forma preliminar, con el objetivo de estudiar la influencia de la temperatura de entrada tomando como valores 25 y 50 °C y la influencia de la concentración del polímero tomando valores de 15 y 25 %. Se mantuvieron constantes el flujo de aire de alimentación y de secado en valores de 600 L/h y 60 m3/h respectivamente. A partir de los resultados, se definieron los niveles para el posterior estudio de influencia de la concentración de polímero, el flujo de líquido de alimentación y el flujo de aire de secado.
Posteriormente se estudiaron 3 concentraciones de polímero, dos en niveles por debajo del mínimo definido en el primer diseño. Estas fueron: 5, 7,5 y 15 %. Se mantuvo constante el flujo de aire de atomización 600 L/h y la temperatura de entrada 50 °C. Seguidamente se estudiaron 2 valores de flujo de aire de atomización 400 y 600 L/h manteniendo constante la temperatura de entrada 50 °C y la concentración de polímero determinada en el estudio anterior (5 %). Además se estudiaron 3 variantes, una disolución, una emulsión 1:10 y una emulsión 1:36, manteniendo constante el flujo de aire de atomización en 600 L/h, la temperatura de entrada en 50 °C y la concentración de polímero en 5 %. Finalmente se estudió el flujo de líquido de alimentación y el flujo de aire de secado empleando un diseño experimental 32 para determinar la influencia sobre el rendimiento y la liberación inicial. Se mantuvo constante la concentración del polímero (5 %), la temperatura de entrada (50 °C) y el flujo de aire de atomización (600 L/h). Se estudió el flujo de líquido de alimentación (4,6; 6,6 y 8,6 mL/min) y del flujo de aire de secado (50, 55 y 60 m3/h). En todos los casos el secado se realizó empleando 50 mL de muestra, en un secador de spray de laboratorio Büchi (Modelo B 191) con flujo de aire de secado y alimentación en paralelo. Los productos obtenidos, se pesaron en balanza técnica Mettler PB 8001 para calcular el rendimiento por la relación entre las masas de producto a la salida y la entrada.
Determinación de la distribución de tamaño de las partículas
La distribución del tamaño de las partículas se determinó mediante difractometría láser, con la utilización de un analizador de partículas Coulter LS 230, en un intervalo entre 0,375 y 2 000 µm. Para ello se dispersaron 20 mg de microesferas en 10 mL de solución al 0,1 % de polisorbato 20. Se colocaron en un baño ultrasónico por 30 s y se adicionaron en la celda de medición. Los datos fueron ajustados a un modelo teniendo en cuenta el índice de refracción de la solución de polisorbato 20, con ayuda del Software Beckman Coulter Versión 3.29 1989-2003. De los resultados se utilizó el diámetro volumétrico.
Determinación cualitativa de la encapsulación por difractometría de rayos X
La determinación se realizó en un difractómetro automático D8 Advance de Broker, con radiación K alfa de Cu, barriendo de 5 a 70 ° a 2 è y una velocidad de 0,05 s. La encapsulación por difractometría de rayos X se comprobó por la desaparición de los máximos de difracción, comparando los polímeros, la sustancia a encapsular, la mezcla física de estos y la sustancia microencapsulada.
Observación de la forma y la superficie de las partículas
La forma de las partículas y la superficie de las microesferas obtenidas fue observada con un aumento de 2 000 y 10 000 veces respectivamente, mediante microscopia de barrido electrónica para lo cual se empleó un microscopio electrónico con alto vacío JSM-6060. Las partículas fueron cubiertas con oro y se observaron con una aceleración de 10 kV.
Determinación de la eficiencia de encapsulación
La determinación de la eficiencia de encapsulación se realizó con el empleo de la cromatografía líquida de alta resolución (HPLC en inglés). Para ello se pesaron 200 mg de microesferas cargadas con tramadol y se disolvieron en una solución de metanol/diclorometano (9:1); se completó a un volumen de 50 mL con la misma solución. Se empleó una solución patrón (200 µg/mL) preparada a partir de 10 mg de tramadol (patrón USP) en 50 mL de solución de metanol/diclorometano (9:1). Se empleó un HPLC Knauer, con flujo de 15 mL/min, detector a una longitud de onda de 271 nm y una columna RP-18 de 240 x 4 mm y 5 mm. Como fase móvil se empleó sodio lauril sulfato 0,01 mol/L y ácido fosfórico 0,02 mol/L:acetonitrilo (50:50); el tiempo de corrida fue de 10 min y el de retención de 6 min.
Determinación de la liberación in vitro inicial y a las 24 h
La liberación se realizó siguiendo la concentración de tramadol por HPLC con las mismas condiciones utilizadas para la determinación de la eficiencia de encapsulación. Para ello se pesaron 200 mg de microesferas y se colocaron cuantitativamente en ampolletas de vidrio transparente de 10 mL de capacidad y se le adicionó un volumen de 5 mL de solución amortigudora tris 67 mmol/L (pH 7,4). Las ampolletas se sellaron herméticamente y se colocaron en una zaranda termostatada a 37 °C y 60 movimientos horizontales por minuto. La inicial se extrajo a los 30 s y la siguiente a las 24 h; se filtró el contenido de la ampolleta a través de una membrana de nitrato de celulosa de 0,2 µm. Se tomaron alícuotas de 2 mL y se llevó a un volumen de 10 mL con el solución amortiguadora para inyectar al HPLC.
El análisis estadístico de los datos se realizó con el Software Statgraphics plus Versión 5.1 1994- 2001, a partir del análisis de varianza, diagrama de Pareto, los gráficos de interacción y de superficie de respuesta.
RESULTADOS
En la figura 1 se muestran los resultados del estudio de la influencia de diferentes parámetros y condiciones de operación sobre el rendimiento, como son la concentración de polímero, el peso molecular del polímero, el flujo de aire de atomización y la relación entre las fases de la emulsión. En esta se aprecia la dependencia inversa entre la concentración del polímero y el rendimiento, encontrándose igual comportamiento para el peso molecular. Sucedió lo contrario cuando se estudió la influencia del flujo de aire de atomización; en cuanto a la influencia de la relación fase acuosa/fase oleosa en la emulsión, se observó una tendencia al incremento del rendimiento y la liberación inicial al disminuir la relación, sin embargo, la eliminación total del agua en la emulsión favoreció la disminución de la liberación inicial pero no del rendimiento.
La figura 2 muestra los resultados del diseño de experimentos, en la cual se ilustra la influencia del flujo de líquido de alimentación y el flujo de aire de secado sobre el rendimiento y la liberación inicial, observándose una mayor influencia del flujo de aire de secado sobre el rendimiento y la liberación inicial, siendo mucho menor la influencia del flujo de aire de atomización.
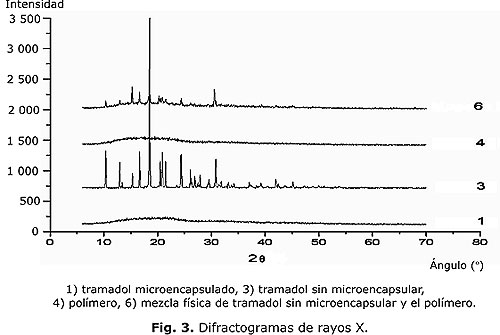
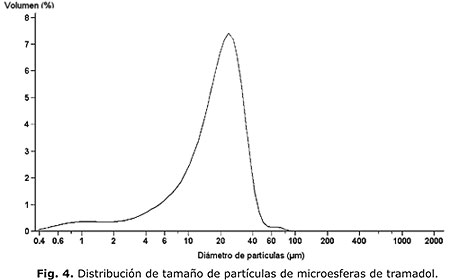
Como parte de la caracterización, se presenta en la figura 3 los difractogramas de rayos X del tramadol microencapsulado, sin microencapsular, el polímero y la mezcla física de tramadol y polímero. Seguidamente se muestra en las figuras 4 y 5 la distribución del tamaño de las micropartículas obtenidas, así como las fotos de microscopia electrónica de la forma y la superficie de estas; se demuestra en los difractogramas la efectividad del proceso de microencapsulación y se confirma en las fotos de la microscopia electrónica la obtención de micropartículas de forma, tamaño y superficie acorde con el procedimiento empleado.
DISCUSIÓN
Como se aprecia en la figura 1, la obtención de micropartículas se ve favorecida primeramente con la mínima concentración de polímero y en segundo lugar con la mayor temperatura de entrada del aire. Para un intervalo de concentraciones entre 5 y 15 %, hay una marcada tendencia a incrementarse el rendimiento a medida que la concentración disminuye, lo que está estrechamente relacionado con la viscosidad y coincide con lo referido por otros autores.13 El incremento del peso molecular de los polímeros influye negativamente sobre el rendimiento, lo que está dado por el incremento de viscosidad a causa del incremento del peso molecular; durante el experimento se observa la formación de hilos por la no fragmentación de los chorros de producto con elevada viscosidad. Con el uso de polímeros de alto peso molecular, aun con la concentración más baja (5 %) no se alcanzó un rendimiento adecuado; se demostró para este caso que solo con una concentración del 1 % se alcanza un rendimiento superior a 50 %, aspecto que se debe tener en cuenta al trabajar con polímeros de alto peso molecular. El incremento de 400 a 600 L/h del flujo de aire de atomización, influye positivamente sobre el rendimiento, lo cual coincide con lo referido por otros autores.13 Al incrementar la relación entre la fase acuosa y oleosa disminuyó tanto el rendimiento como la liberación inicial. La disminución del rendimiento no es favorable y por el contrario es un conveniente en un producto de liberación controlada que la liberación inicial sea baja. Esta última se logró minimizar más en ausencia de agua, lo que se explica por la solubilidad en agua del fármaco, que tiende a separarse en pequeñas gotículas que quedan en la su perficie durante el proceso de secado de la emulsión, lo que no ocurre cuando se disuelven el polímero y el fármaco en el mismo solvente sin presencia de agua, pero en este caso el rendimiento es bajo, por lo que fue necesario estudiar la influencia de otros factores que afecten al mismo para lograr incrementarlo, como son el flujo de líquido de alimentación y de aire de secado.
Después de analizar los resultados del diseño donde se estudió la influencia del flujo de líquido de alimentación y de aire de secado (fig. 2), según la optimización para maximizar el rendimiento (Rend) y minimizar la liberación inicial (lib q) , con el nivel medio de flujo de aire de secado (55 m3/h) y el máximo de flujo de líquido (8,6 mL/min), se obtuvo el mayor rendimiento, que fue de 62,6 %; de manera coincidente con estos niveles se observó la menor adhesión en la cámara y el ciclón, y se alcanzó la menor liberación inicial. Por lo que se fijaron los niveles de los parámetros que influyen sobre las variables de respuesta estudiadas. Teniendo en cuenta los valores de los parámetros estudiados con que se obtuvieron los mejores resultados, se preparó una corrida del producto con vistas a su caracterización fisico-química y morfológica, alcanzándose una eficiencia de encapsulación de 95,64 %, que se corresponde con los valores reportados para este método de obtención de microesferas.7 En cuanto a la liberación, en un inicio fue de 13,68 y un 58,57 % a las 24 h, lo que resultó adecuado si se tiene en cuenta que el tramadol es fácilmente soluble en medio acuoso.
Al observar los difractogramas de rayos X se distingue la ausencia de máximos de difracción (picos) en la sustancia microencapsulada (fig. 3, 1), lo que indica el enmascaramiento de la sustancia, comportándose como si fuera solamente el polímero (fig. 3, 4). Esto no ocurrió cuando la sustancia está sin microencapsular (fig. 3, 3) o cuando se mezcla simplemente con el polímero (fig. 3, 6), que aunque disminuye la intensidad de los máximos de difracción, no desaparecen como en el producto microencapsulado, lo que demuestra la eficiencia del proceso de microencapsulación.
En la curva de distribución de tamaño de partículas (fig. 4), se observa un comportamiento unimodal y de poca dispersión donde más del 50 % de las microesferas tienen un tamaño de partícula de 18,93 ± 2,31 ìm.
En la figura 5 se muestran las fotos tomadas al microscopio electrónico de barrido, con diferentes aumentos, de 2 000 veces para observar la forma y 10 000 veces para la superficie de las partículas. Se puede apreciar que la muestra tiene una distribución de tamaños, lo que corrobora el resultado del análisis de tamaño de partículas y lo reportado en diferentes artículos recientes para este método,7 con una forma esférica, la cual brinda una mayor superficie de contacto y fluidez. Las microesferas obtenidas presentan una superficie lisa y no porosa lo que indica que no hubo degradación de esta durante su formación, lo cual garantiza la integridad de las micropartículas.
Mediante la difractometría de rayos X se demostró que el tramadol fue encapsulado adecuadamente. La microscopia electrónica y el análisis de tamaño de partículas reveló que las micropartículas obtenidas son esféricas y presentan una superficie lisa y no porosa, con un diámetro medio de 18,93 ± 2,31 µm. Lo que demuestra que el método de secado por aspersión es adecuado para la obtención de microesferas de ácido poliláctico cargadas con tramadol.
REFERENCIAS BIBLIOGRÁFICAS
1. Herrera Silva T. Tratamiento del dolor osteoarticular con opiáceos débiles. IV Reunión científica de la sociedad española del dolor. [en línea] 2007 [fecha de acceso en noviembre de 2007]. Disponible en: http://revista.sedolor.es
2. Resumen de las características del producto. [en línea] 2006 [fecha de acceso en febrero de 2007]. Disponible en: http://www.seom.org
3. Master Farma. Información sobre principio activo tramadol HCl. [en línea] 2007 [fecha de acceso en marzo de 2007]. Disponible en: http://www.masterfarma.com/producto_tramadol.html
4. Wikipedia. Tramadol. [en línea] 2007 [fecha de acceso en febrero de 2007]. Disponible en: http://en.wikipedia.org
5. Brown R, Thomas S, Wimmer W, Hahn U, Antoinette S, Smith K, et al. Controlled release tramadol. 2001. US 625488.
6. Deboeck A, Vanderbist F, Sereno A. Extended release composition containing tramadol. 2003. US 20030143270.
7. Bittner B, Morlock M, Koll H, Winter G, Kissel T. Recombinant human erythropoietin (rhEPO) loaded poly(lactide-co-glycolide) microspheres: influence of the encapsulation technique and polymer purity on microsphere characteristics. Eur J Pharm Biopharm. 1998;45:295-305.
8. Raffin R, Jornada D, Re M, Pohlmann A, Guterres S. Sodium pantoprazole-loaded enteric microparticles prepared by spray drying: Effect of the scale of production and process validation. Int J Pharm. 2006;324:10-8.
9. Müller CR, Schaffazick S, Pohlmann A, Freitas L, Pesce N, Tavares T, et al. Spray-dried diclofenac-loaded poly(e-caprolactone) nanocapsules and nanospheres. Preparation and physicochemical characterization. Pharmazie. 2001;11:864-7.
10. Fonseca L, Silveira R, Marc A, Valmir E, Costa T, Guterres S, et al. Nanocapsule@xerogel microparticles containing sodium diclofenac: A new strategy to control the release of drugs. Int J Pharm. 2008. In press.
11. Chang HC, Li LC. Sustained-Release Butorphanol Microparticles. Drug Dev Ind Pharm. 2000;26(8):829-35.
12. Tsung M, Burgess D. Preparation and Characterization of Gelatin Surface Modified PLGA Microspheres. AAPS Pharm Sci. 2001;3(1).
13. Patterson J, James M, Forster A, Lancaster W, Butler J, Rades T. Preparation of glass solutions of three poorly water soluble drugs by spray drying, melt extrusion and ball milling. Int J Pharm. 2007;336:22-34.
Recibido: 8 de junio de 2010.
Aprobado: 17 de julio de 2010.
Ing. Orestes Darío López Hernández. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). Ave. 26 No. 1 605 entre Boyeros y Puentes Grandes. CP 10 600. Plaza de la Revolución, La Habana, Cuba. Correo electrónico: oresteslh@infomed.sld.cu