Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.44 n.4 Ciudad de la Habana oct.-dic. 2010
PRODUCTOS NATURALES
Inducción de la actividad de lacasa en Ganoderma sp. y actividad antioxidante de su biomasa
Induction of lacasa activity in Ganoderma sp and the antioxidant activity of its biomass
Carolina Arboleda EchavarríaI; Amanda Inés Mejia GallónII
IPh.D. en Ciencias Químicas. Investigadora Asociada. Universidad de Antioquia. Facultad de Química Farmacéutica. Medellín, Antioquia, Colombia.
IIPh.D. en Ingeniería de Alimentos. Profesora Titular. Universidad de Antioquia. Facultad de Química Farmacéutica. Medellín, Antioquia, Colombia.
RESUMEN
Los basidiomicetes poseen un gran potencial para la producción de enzimas de amplia aplicación en la industria farmacéutica, alimentaria y en la recuperación de aguas y suelos. En Colombia se han recolectado varios géneros de hongos basidiomicetes, entre ellos el Ganoderma sp., que adicionalmente es reconocido a nivel mundial por su usos medicinales. En este trabajo se evaluó la influencia del pH del medio y de los inductores: cobre y aserrín de guadua (Angustifolia kunth), en la producción de la enzima lacasa y en la actividad antioxidante medida en los extractos metanólicos de la biomasa recuperada del Ganoderma sp. determinada por el contenido de compuestos fenólicos totales y la actividad captadora de los radicales DPPH y ABTS.+. Las variables analizadas a 3 niveles por el Software Design Expert 6, mostraron que la mejor combinación de variables para una máxima expresión enzimática fue obtenida con 0,75 % de aserrín de guadua, 250 mM de cobre y pH 5; el mayor porcentaje de inhibición del radical ABTS (86 %) se observó a pH 4, sin adición de cobre y con un porcentaje de aserrín de 1,50, y el mayor porcentaje de inhibición del radical DPPH (57 %) se observó a pH 6, sin adición de cobre ni aserrín de guadua.
Palabras clave: Ganoderma sp., lacasa, actividad antioxidante.
ABSTRACT
The Basidiomycetes have a great potential for the production of wide application enzymes in the pharmaceutical, alimentary, food industry and the water and soils recovery. In Colombia come types of Basidiomycetes fungi including the Ganoderma.sp that is additionally worldwide recognized by its medicinal effects. In present paper authors assessed the influence of invironment pH and of the inducers: copper and Angustifolia, kunth sawdust in the production of lacase enzyme and also in the antioxidant activity of DPPH and ABTS.+ radicals. The variables analyzed at three levels by Design Expert 6 software demonstrated that the better combination of variables for a maximal enzyme expression was obtained using the 0.75 % Angustifolia kunth sawdust, 250 mM of copper and pH 5; the great percentage of the ABTS radical inhibition (86 %) was observed at a pH 4 without copper addition and with a percentage of sawdust of 1.50 and the greater percentae of DPPH radical inhibition (57 %) was observed at a pH 6 without sawdust and copper addition.
Key words: Ganoderma, lacase, antioxidant activity.
INTRODUCCIÓN
Entre los microorganismos que degradan eficientemente la lignina se encuentran los hongos de la descomposición blanca de la madera, conocidos como WRF (White Rot Fungi) que bajo condiciones naturales colonizan troncos de madera vivos o muertos.1 La degradación de la lignina mediante estos hongos ocurre principalmente durante el metabolismo secundario por medio de enzimas extracelulares oxidativas ligninolíticas,2 metabolitos de bajo peso molecular y especies reactivas de oxígeno, con el objetivo de mineralizar la lignina para tener acceso a la molécula de celulosa que utilizan como fuente de carbono. Las principales enzimas ligninolíticas son oxidasas (lacasa) y peroxidasas lignino peroxidasa [LiP] y manganeso peroxidasa [MnP]). Estas enzimas son capaces de transformar una gran variedad de compuestos. Las peroxidasas con un grupo hemo, requieren la presencia de peróxido de hidrógeno para oxidar la lignina, por el contrario la lacasa es una fenol oxidasa que oxida fenoles y aminas aromáticas, utilizando oxígeno molecular como oxidante.2
El género Ganoderma ha sido ampliamente estudiado debido a que algunas de sus especies poseen propiedades medicinales3-6 y gran potencial ligninolítico.7 Adicionalmente se ha encontrado efectos terapéuticos acompañados de una alta capacidad antioxidante en los géneros Ganoderma lucidum and Ganoderma tsugae.8-10 El Ganoderma sp. fue aislado de un bosque tropical colombiano; en estudios recientes ha demostrado un gran potencial como productor enzimático.11 El objetivo del presente trabajo fue evaluar la influencia de los inductores cobre,12 aserrín de guadua (Angustifolia kunth), y el pH del medio, en la producción de la enzima lacasa de Ganoderma stipitatum en un medio sumergido, y evaluar la capacidad antioxidante de la biomasa producida en dicho cultivo.
MÉTODOS
Siembra y obtención del micelio de Ganoderma stipitatum
La siembra y mantenimiento se realizó en medio ligninolítico13 que contenía cualitativamente agar, glucosa, peptona, extracto de levadura, KH2PO4, MgSO4 × 7H2O. Se incubaron las placas a 30 °C durante 8 días. Pasado este tiempo se almacenaron a 4 °C.
Condiciones de cultivo sumergido
En frascos de Erlenmeyer de 250 mL se adicionaron 85 mL de medio basal,14,15 cuya composición fue la siguiente (g/L): glucosa 35; peptona 5; extracto de levadura 2,5; KH2PO4 × H2O 1, MgSO4 × 7H2O 0,5; vitamina B1 0,05. Al medio basal se le adicionaron inductores y se le ajustó el pH de acuerdo con el diseño experimental.16 Cada frasco de Erlenmeyer se inoculó con 5 cuadros de agar de 1 cm2 con micelio activo de Ganoderma sp. aproximadamente 0,5 cm2. Se sometió a agitación orbital a 150 rev·min-1 30 ºC, por un periodo de 30 días.
Inductores enzimáticos
Como inductores enzimáticos se utilizó Cu12 adicionado como sulfato de cobre (sigma Aldrih) y aserrín de guadua Angustifolia Kunth recolectada en Quindío Armenia, cuyas concentraciones se describen en el diseño experimental.
Determinación de lacasa
En condiciones estériles se tomaron de cada frasco de Erlenmeyer 300 µL de líquido extracelular, los días 2, 7, 9 y 12 de fermentación. Para la determinación se siguió el método planteado por Paszczynski en el que una unidad correspondió a la cantidad de enzima que produce 1 mmol min-1 de ABTS oxidado a pH 3 a 30 ºC.17 La reacción se siguió espectrofotométricamente (Cary UV) a 420 nm (l530= 35 000 M-1 cm-1).17 La actividad enzimática fue determinada cada 2 días.
Extracción metanólica de la biomasa
Se tomo 1 g de biomasa seca y pulverizada de cada muestra, y se sometió a agitación continua con 10 mL de metanol durante 24 h a 25°C y 3 000 rev·min-1. Se pasó el extracto por filtro Whatman No. 4. El residuo se extrajo con 2 porciones adicionales de 10 mL de metanol con el procedimiento anterior.10 Las porciones de extracto resultante se mezclaron y se llevaron a sequedad a presión reducida en un rotavaporador a 40 ºC, obteniéndose el material de análisis.
Contenido de fenoles totales
La concentración de fenoles totales en los extractos fue determinada siguiendo el método de Folin-Cicalteau (Waterman, 1994); la concentración de polifenoles fue detecta mediante la formación de sales de tungsteno y molibdeno por espectrofotometría a 760 nm.18,19 En tubos de ensayo de 5 mL se adicionaron 200 µL de cada extracto, se llevaron hasta 500 µL con agua destilada, se adicionaron 1,250 mL de solución acuosa de carbonato de sodio al 20 % y finalmente se adicionaron 250 µL del reactivo de folin preparado minutos antes. Luego de 40 min las muestras se leyeron en un espectrofotometría 760 nm y se compararon con una curva de calibración usando estándar de ácido gálico. El contenido de fenoles totales se determinó como equivalentes de ácido gálico (mg ácido gálico/mg de extracto). La ecuación obtenida con la regresión fue: y= 0,08504x - 0,14076, donde y es la absorbancia y x la concentración de fenoles.
Actividad inhibidora del radical 1,1-difenil-2-picril-hidrazilo (DPPH)
La actividad inhibidora del radical 1,1-difenil-2-picril-hidracilo (DPPH) de los extractos fue determinada siguiendo el método de Cavin y otros, 1998.20 Se adicionó 20 µL de cada extracto a una concentración de 100 mg/mL en un tubo de ensayo, y 1,98 mL de una solución de DPPH (40 mg/L). Las soluciones se agitaron vigorosamente y se dejaron en incubación por un periodo de 30 min. La absorbancia se midió a 517 nm. Se determinó la actividad inhibidora utilizando la ecuación %I= [(A0 - A30)/A0] x 100.
Actividad inhibidora del radical ácido 2.2'azino-bis 3etilbenzotiasol 6 sinfónico ABTS
El método ABTS consiste en formar un radical catiónico ABTS.+ (cromóforo verde) basado en la acción oxidativa de peroxidasas u oxidasas sobre ABTS. El radical ABTS se produjo utilizando una mezcla de reacción que contenía ABTS (7 mM) y persulfato de potasio (2,45 mM) en solución amortigiadora fosfato pH 7,0. La mezcla de reacción se preparó 12 h antes de su uso y se mantuvo a temperatura ambiente y en ausencia de luz. Se ajustó la absorbancia de la dilución ABTS a 0,7 a 732 nm con solución amortiguadora fosfato pH 7,4. La actividad antioxidante (AA) se evaluó midiendo el cambio de absorbancia a 732 nm de la solución de ABTS.+ cuando se alcanzó el estado estacionario.21 La curva de calibración se realizó con un derivado de la vitamina E (trolox) en un intervalo de concentración de 0 a 15 µmol/mL. A partir de las absorbancias obtenidas se determino la actividad inhibidora utilizando la ecuación %I= [(A0 - A30)/A0] x 100.
Diseño experimental
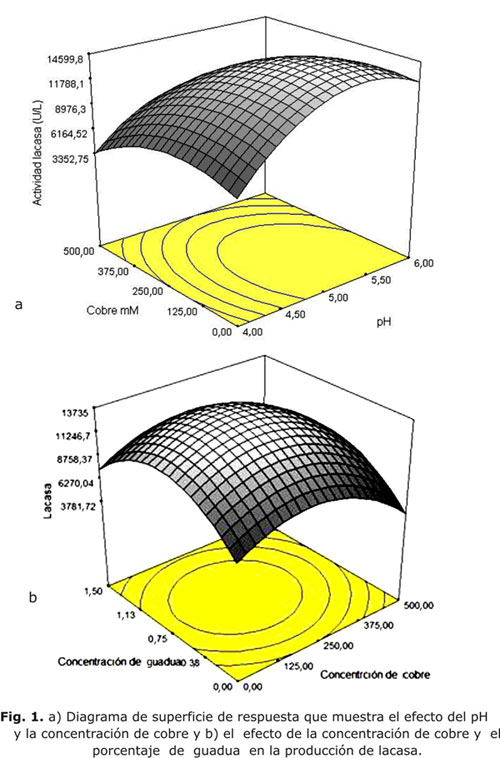
Se usó un Software Design Expert 6 utilizando la metodología de superficie de respuesta por medio de un diseño Box Behnken. Los valores codificados de las 3 variables (% aserrín de guadua, concentración de cobre y pH) son mostrados en la tabla 1. Los niveles de cada una de las variables fueron seleccionados de experiencias anteriores en nuestro laboratorio.11 Los valores sin codificar y el diseño mostrado por el Software Design Expert se muestra en la tabla 2.
Tabla 2. Diseño Box Behnken mostrado por el Software Design Expert 6
| Ensayo | Cu (Mm) | % Aserrín | pH |
| 1 | 0 | 0 | 5 |
| 2 | 500 | 0 | 5 |
| 3 | 0 | 1,5 | 5 |
| 4 | 500 | 1,5 | 5 |
| 5 | 0 | 0,75 | 4 |
| 6 | 500 | 0,75 | 4 |
| 7 | 0 | 0,75 | 6 |
| 8 | 500 | 0,75 | 6 |
| 9 | 250 | 0 | 4 |
| 10 | 250 | 1,5 | 4 |
| 11 | 250 | 0 | 6 |
| 12 | 250 | 1,5 | 6 |
| 13 | 250 | 0,75 | 5 |
| 14 | 250 | 0,75 | 5 |
| 15 | 250 | 0,75 | 5 |
| 16 | 250 | 0,75 | 5 |
| 17 | 250 | 0,75 | 5 |
RESULTADOS
Actividad enzimática de lacasa
La lacasa fue seguida durante 12 días y se observó que los valores centrales de cobre, pH y porcentaje de aserrín: 250 mM, 5 y 0,75 % respectivamente, permitieron obtener una mayor actividad. La actividad fue determinada cada 2 días y se observó que hasta el último día aún permanecía en ascenso. Los valores alcanzados al día 12 alcanzan las 16 000 U/L. Estos resultados se observan en la figura 1.
Actividad antioxidante por ABTS
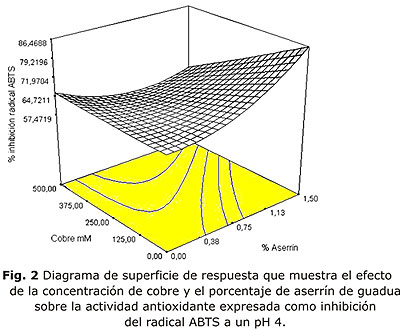
La mejor combinación de variables mostrada por el diseño Box Behnken, para el mayor porcentaje de inhibición de ABTS, se observó a pH 4, sin adición de cobre y con el mayor porcentaje de aserrín 1,50 %, obteniendo una inhibición del 86 % en 1 min (fig. 2). Y una concentración de 8,447 mM equivalentes a trolox por mg de extracto que fue determinada en la curva de calibración realizada por espectrofotometría de ultravioleta que mostró la siguiente ecuación:
y= -0,04399x + 0,59129, donde y representa la absorbancia y x la concentración. La tabla 2 muestra el análisis de varianza para la prueba de actividad antioxidante por el método de ABTS. Los datos obtenidos en el análisis de regresión mostrados por el diseño fueron para la desviación estándar 3,87 y coeficiente de correlación r2 de 0,917. La falta de ajuste fue no significativa.
Actividad inhibidora del radical DPPH
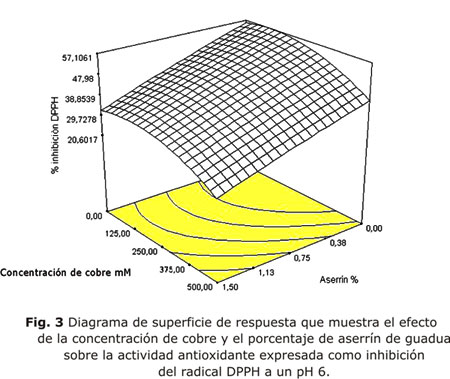
La mejor combinación de variables mostrada por el diseño para el mayor % de inhibición de DPPH se observó a pH 6, a una concentración de cobre de 250 mM y sin adición de aserrín de guadua, obteniendo una inhibición del 57 % a los 30 min (tabla 3, fig. 3) . Los datos obtenidos en el análisis de regresión mostrados por el diseño fueron para la desviación estándar 4,96 y coeficiente de correlación r2 de 0,9115. La falta de ajuste fue no significativa.
| Ensayo | Biomasa | Folin mgAG/mL | ABTS % Inhibición | DPPH % inhibición | Lacasa U/mL |
| 1 | 1 ,647 ± 0,075 | 0,33 ± 0,03 | 67,7 ± 0,43 | 50 ,63 ± 0,33 | 6,81 ± 0,63 |
| 2 | 1 ,390 ± 0,029 | 0,25 ± 0,01 | 44,81 ± 0,51 | 35 ,22 ± 0,29 | 4,50 ± 0,24 |
| 3 | 2 ,981 ± 0,062 | 0,27 ± 0,01 | *87,98 ± 0,62 | 33 ,43 ± 0,26 | 6,50 ± 0,53 |
| 4 | 2 ,199 ± 0,024 | 0,25 ± 0,02 | 64,98 ± 0,45 | 33 ,8 ± 0,15 | 5,09 ± 0,41 |
| 5 | 2 ,621 ± 0,033 | 0,28 ± 0,01 | *83,5 ± 0,58 | 50,11 ± 0,43 | 4,47 ± 0,32 |
| 6 | 0 ,487 ± 0,074 | 0,24 ± 0,03 | 59,85 ± 0,35 | 26,58 ±0,31 | 3,81 ± 0,14 |
| 7 | 2 ,931 ± 0,053 | 0,22 ± 0,01 | *70,34 ± 0,51 | 45,69 ± 0,53 | 11,51 ± 0,8 |
| 8 | 1 ,214 ± 0,022 | 0,24 ± 0,04 | 44,29 ± 0,46 | 28,96 ± 0,21 | 7,04 ± 0,21 |
| 9 | 1 ,028 ± 0,027 | 0,27 ± 0,01 | 53,15 ± 0,53 | 48,64 ± 0,39 | 2,88 ± 0,13 |
| 10 | 1 ,785 ± 0,036 | 0,2 ± 0,02 | 68,59 ± 0,74 | 36,69 ± 0,24 | 4,71 ± 0,54 |
| 11 | 2 ,695 ± 0,054 | 0,37 ± 0,02 | 56,47 ± 0,43 | 56,32 ± 0,33 | 7,04 ± 0,75 |
| 12 | 2 ,751 ± 0,048 | 0,22 ± 0,01 | 61,98 ± 0,37 | 32,64 ± 0,25 | 9,86 ± 0,72 |
| 13 | 2 ,612 ± 0,079 | 0,22 ± 0,01 | 60,2 ± 0,45 | 38,06 ± 0,35 | *16,74 ± 1,2 |
| 14 | 2 ,955 ± 0,064 | 0,27 ± 0,03 | 61,98 ± 0,44 | 42,05 ± 0,44 | *16,10 ± 1,4 |
| 15 | 2 ,856 ± 0,067 | 0,23 ± 0,02 | 60,97 ± 0,47 | 41,42 ± 0,31 | *16,56 ± 0,9 |
| 16 | 2 ,903 ± 0,027 | 0,24 ± 0,01 | 60,18 ± 0,38 | 48,78 ± 0,59 | *14,21 ± 0,8 |
| 17 | 2 ,657 ± 0,025 | 0,23 ± 0,02 | 60,35 ± 0,39 | 25,76 ± 0,20 | *13,58 ± 0,88 |
descrito en la tabla 2.
Contenido de fenoles totales
El Software Design Expert 6 mostró 17 ensayos (tabla 2) donde se observan los niveles de las variables: concentración de cobre, porcentaje de aserrín y pH para cada ensayo del 1 al 17. En la tabla 3 se presentan las medias de los resultados mostrados por los ensayos 1 al 17 respecto a la actividad antioxidante, representada por la actividad antirradicalaria de DPPH, ABTS y fenoles totales, realizados cada uno por triplicado. Igualmente se presentan los datos de actividad enzimática de lacasa y la cantidad de biomasa generada en cada ensayo. Se observa en la tabla 3 que existe una relación entre los valores más altos obtenidos para la producción de biomasa con la actividad enzimática y el porcentaje de inhibición de ABTS; por otro lado, se observa una relación entre los valores más altos para fenoles totales y el porcentaje de inhibición de DPPH.
DISCUSIÓN
Varios autores han reportado que tanto el cobre como residuos ligninocelulósicos, como el aserrín de guadua, presentan un efecto inductor sobre la producción extracelular de enzimas y compuestos con actividad antioxidante, que se encuentran en la biomasa de varias especies de Ganoderma o que surgen de la degradación de la lignina, que es además el sustrato natural de los hongos basidiomicetes.1,2,22-24 La utilización de metales pesados como el cobre, es ampliamente adoptado para la producción e inducción de ligninasas; en este estudio se demostró que la variación de la concentración de cobre produce un incremento significativo en la actividad enzimática y se ha reportado en otras investigaciones que contribuye a la estabilidad de la enzima y al aumento de la actividad catalítica.21 Sin embargo, la concentración de este es un factor limitante y específico de cada microorganismo, ya que a altas concentraciones tanto de cobre como de residuos ligninocelulósicos pueden afectar la cantidad de biomasa fúngica y el crecimiento miceliar del hongo con la concomitante disminución en la producción de sus metabolitos.25
Otros factores como el pH afectan la producción de enzimas y metabolitos. En el presente estudio si bien no existe se muestra una influencia clara del pH en la actividad secuestradora de los radicales ABTS y DPPH, se evidencia un efecto marcado sobre la producción extracelular de la lacasa obteniendo una mayor concentración a pH 5. Varios autores reportan que en los pH bajos cercanos a 3 se presenta una mayor actividad de esta enzima;26,27 sin embargo muchos otros reconocen que en pH cercanos a 5 se presenta una mayor estabilidad.28-30
La relación entre la producción de biomasa con la producción enzimática es reconocida en hongos basidiomicetos ya que una mayor cantidad de biomasa agota más rápidamente los nutrientes presentes en el medio basal y es conocido que en condiciones limitadas de nutrientes se dispara el metabolismo secundario donde las enzimas se expresan.31 La relación entre los mayores valores de inhibición del radical ABTS con la mayor producción de biomasa puede deberse a que la mayoría de las especies de Ganoderma producen ácidos ganodericos y ergosteroles que pueden contribuir a la actividad inhibitoria del radical ABTS.14,15,23,32
Es importante continuar estudios que optimicen la producción de biomasa de Ganoderma encaminados en la obtención de metabolitos con actividad antioxidante y la producción de enzimas. Ambos son de amplia aplicación farmacéutica, alimentaria, medio ambiental y principalmente los compuestos con actividad antioxidante pueden ser potenciales en el cuidado del organismo contra el daño oxidativo.32-35 Varias publicaciones han reportado compuestos tipo esteroles contenidos en la biomasa de diferentes especies de Ganoderma, estos pueden contribuir enormemente a la actividad antioxidante, en esta investigación se obtuvo actividades equivalentes en trolox, que es un potente antioxidante derivado de la vitamina E, comparable e incluso mayor a otras especies de Ganoderma.35,36
REFERENCIAS BIBLIOGRÁFICAS
1. Eriksson KE, Blanchette RA, Ander P. Microbial and enzymatic degradation of wood and wood components. Berlin, Heidelberg, New York: Springer Verlag; 1990. 397 p.
2. Martinez AT, Camarero S, Guillen F, Gutierrez A, Munoz C, Varela E. Progress in biopulping of non-woody materials: chemical, enzymatic and ultrastructural aspects of wheat straw delignification whit ligninolytic fungi from de genus Pleurotus. Fems Microbiol Rev. 1994;13:265-73.
3. Russell R, Paterson M. Ganoderma-A terapeutical fungal biofactory. Phytochemistry. 2006;67:1985-2001.
4. Fujita R, Liu J, Shimizu K, Konishi F, Noda K, Kumamoto, et al. Anti-androgenic activities of Ganoderma lucidum. J Ethnopharmacol. 2005;102:107-12.
5. Horng-Huey Ko, Hung C. Antiinflammatory triterpenoids and steroids from Ganoderma lucidum and G. tsugae. Phytochemistry. 2008; 69:234-9.
6. Seong-Kug Eo, Young-So Kim. Antiviral activities of various water and methanol soluble substances isolated from Ganoderma lucidum. J Ethnopharmacol. 1999;68:129-36.
7. Maganhotto CM, Soares DM, Oliveira PR. Ligninolytic enzyme production by Ganoderma spp. Enzyme Microbial Technol. 2005;37:324-9.
8. Mau JL, Lin HC, Chin-Chu-Chen. Antioxidant properties of several medicinal mushrooms. J Agric Food Chem. 2002;50(21):6072-7.
9. Mau JL, Lin HC, Chin-Chu-Chen. Antioxidant properties of several specialty mushrooms. Food Res Intern. 2002;35:519-26.
10. Mau JL, Tsai SY, Tseng Y, Huang S. Antioxidant properties of methanolic extracts from Ganoderma tsugae. Food Chemistry. 2005;93:641-9.
11. Arboleda C, Mejia AI, Franco AE, Jimez GA, Penninckx MJ. Autochthonous white rot fungi from the tropical forest of Colombia for dye decolourisation and ligninolytic enzymes production. Sydowia. 2008;60(2):165-80.
12. Murugesan K, Kim YM, Jeon JR, Yoon-Seok Chang YS. Effect of metal ions on reactive dye decolorization by laccase from Ganoderma lucidum. J Hazardous Materials. 2009;168(1):523-9.
13. Mester T, Peña M, Field JA. Nutrient regulation of extracellular peroxidases in the white-rot fungus Bjerkandera sp. BOS55. Appl Microbiol Biotechnol. 1995;44:778-84.
14. Fang QH, Zhong JJ. Submerged fermentation oh higher fungus Ganoderma lucidum for production of valuable bioactive metabolites-Ganoderic acid and polysaccharide. Biochemical Engineering J. 2002;10:61-5.
15. Tang YJ, Zhong JJ. Fed-batch fermentation of Ganoderma lucidum for hyperproduction of polysaccharide and ganoderic acid. Enzyme Microbial Technol. 2002;31:20-8
16. Hinkelmann K, Jo J. Linear trend-free Box-Behnken designs. J Statical Planning Interference. 1998;72(1-2):347-54.
17. Paszczynski A, Huynh VB, Crawford R. Comparison of ligninase-1 and peroxidase-m2 fron de white-rot fungus Phanerocheate chrysosporium. Arch Biochemistry Biophysics. 1986;244(2):750-65.
18. Waterman PG, Mole S. Analysis of phenolic plant metabolites. Oxford: Blackwell Scientific Publications; 1994.
19. Singleton VL, Rossi JA. Colorimetry of Total Phenolics with Phosphomolybdic-Phosphotungstic Acid Reagents. Am J Enol Vitic 1965;16(3):144-58.
20. Cavin A, Hostettmann K, Dyatmyko W, Potterat O. Antioxidant and Lipophilic Constituents of Tinospora crispa. Planta Med. 1998;64:393-6.
21. Re R, Pellegrini R, Proteggente A, Pannala A, Yang M, Rice-Evans C. Antioxidant applying an improved ABTS radical catión decolorization assay. Free Radical Biology & Medicine. 1999;26(9-10):1231-7.
22. Baldrian P. Interaction of heavy metals with White-Rot fungis. Enzyme Microbiol Technol. 2003;32:78-91.
23. Tang YJ, Zhang W, Zhu LW. Hyperproduction of Ganoderma polysaccharides and ganoderic acid during fermentation of medicinal mushroom Ganoderma lucidum by multi-stage control and induced culture. J Bioscience Bioengineering. 2009;108:S114-S34.
24. Bjørsvik HR. Fine Chemicals from Lignosulfonates. Synthesis of Vanillin by Oxidation of Lignosulfonates Organic Process. Res & Develop. 1999;3:330-40.
25. Rothschild N, levkowitz A, hadar Y, dosoretz C. Manganese deficiency can replace high oxigen levels needed for lignin peroxidase formation by phanerochaete chrysosporium. Appl Environ Microbiol. 1999;65(2):483-8.
26. Garzillo AMV, Colao MC, Caruso C, Caporale C, Celletti D. And Buonocore, V. Laccase from the white-rot fungus Trametes trogii. Appl Microbiol Biotechnol. 1998;49:545-51.
27. Hoffmann P, Esser K. The phenol oxidases of the Ascomycete Podospora anserina. Arch Microbiol. 1977;112:111-4.
28. Jönsson LJ, Saloheimo M. Penttilä M. Laccase from the white-rot fungus Trametes versicolor: cDNA cloning of lcc1 and expression in Pichia pastoris. Curr Genet. 1977;32:425-30.
29. Larsson S, Cassland P, Jönsson LJ. Development of a Saccharomyces cerevisiae strain with enhanced resistance to phenolic fermentation inhibitors in lignocellulose hydrolysates by heterologous expression of laccase. Appl Environ Microbiol. 2001;67:1163-70.
30. Soden D, Dobson ADW. Differential regulation of laccase gene expression in Pleurotus sajor-caju. Microbiology. 2001;147:1755-63.
31. Eggert C, Temp U, Eriksson KE. The ligninolytic system of the white rot fungus Pycnoporus cinnabarinus: purification and characterization of the laccase. Appl Environ Microbiol. 1996; 62:1151-8.
32. Wen Tang W, Liu JW, Zhao WMB, Wei DZ, Zhong JJ. Ganoderic acid T from Ganoderma lucidum mycelia induces mitocondria mediated apoptosis in lung cancer cells. Life Sci. 2006;80:205-11.
33. Chen YG, Shen ZJ, Chen XP. Modulatory effect of Ganoderma lucidum polysaccharides on serum antioxidant enzymes activities in ovarian cancer rats. Carbohydrate Polymers. 2009;78:258-62
34. Chen XP, Chen Y, Li SB, Chen YG, Lan JY, Liu LP. Free radical scavenging of Ganoderma lucidum polysaccharides and its effect on antioxidant enzymes and immunity activities in cervical carcinoma rats. Carbohydrate Polymers. 2009;77:389-93.
35. Lakshmi B, Ajith TA, Janardhanan KK. Antimutagenic activity of methanolic extract of Ganoderma lucidum and its effect on hepatic damage caused by benzo[a]pyrene. J Ethnopharmacol. 2006;107:297-303.
36. Saltarelli R, Ceccaroli P, Lotti M, Zambonelli A, Buffalini M, Casadei L, et al. Biochemical characterisation and antioxidant activity of mycelium of Ganoderma lucidum from Central Italy. Food Chemistry. 2009;116:143-51.
Recibido: 8 de junio de 2010.
Aprobado: 17 de julio de 2010.
Ph.D. Carolina Arboleda Echavarría. Facultad de Química Farmacéutica. Universidad de Antioquia. Calle 50A No. 63-85, Medellín, Colombia. Correo electrónico: echavarria.carolina@gmail.com