Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515
Rev Cubana Farm vol.45 no.3 Ciudad de la Habana jul.-set. 2011
ARTÍCULO ORIGINAL
Encapsulación de un filtro solar (avobenzona) en liposomas
Encapsulation of a sunscreen (avobenzone) in liposomes
Juan Fernando Pinillos MadridI, Cecilia Gallardo CabreraII
I Químico Farmacéutico. Especialista en Estadística. Profesor de Cátedra. Facultad de Química Farmacéutica. Universidad de Antioquia. Medellín, Colombia.
II Doctora en Ciencias Químicas. Química Farmacéutica. Profesor Asistente. Facultad de Química Farmacéutica. Universidad de Antioquia. Medellín, Colombia.
RESUMEN
El objetivo de este trabajo fue comprobar la optimización de la encapsulación de avobenzona en liposomas, y evaluar si constituye una barrera física de protección contra la fotodegradación de avobenzona en presencia de octilmetoxicinnamato. Se aplicó un diseño experimental para optimizar los procesos de encapsulación. Los resultados obtenidos mostraron un aumento significativo en la eficiencia de encapsulación al encontrar una relación óptima del agente encapsulante con el agente a encapsular y las interacciones apropiadas entre los factores evaluados. Los valores obtenidos en la eficiencia de encapsulación están alrededor de un 90,00 % y el tamaño logrado fue de 9,156 mm. La fotoestabilidad de la avobenzona en presencia del filtro solar UVB, octilmetoxicinnamato, mejoró al estar encapsulado en liposomas con un porcentaje de degradación del 22,07 % contra un 32,96 % de la avobenzona sin encapsular, y la estabilización coloidal de la dispersión de liposomas mejoró con la utilización de carbopol 940 al 1,00 %. En conclusión, la encapsulación de avobenzona en liposomas al usar isolecitina se logra con alta eficiencia, y se comproba que la degradación de la avobenzona promovida por la luz disminuye al estar encapsulada, aun en presencia de octilmetoxicinnamato.
Palabras clave: liposomas, diseños experimentales, estabilidad coloidal, eficiencia de encapsulación, avobenzona, filtro solar.
ABSTRACT
This study was aimed at confirming the optimization of Avobenzone encapsulation in liposomes, and at evaluating whether this is a physical barrier to protect AVO from photodegradation in presence of octylmetoxycinnamate or not. An experimental design served to optimize the processes of encapsulation. The results showed a significant increase in the encapsulation efficiency since optimal relationship between the encapsulating agent and the agent to be encapsulated, as well as adequate interactions among the studied factors were found. The values of encapsulation efficiency were roughly 90.00 % and the particle size obtained was 9.156 mm. The Avobenzone photostability in presence of UVB filter octylmetoxycinnamate improved when being encapsulated in liposomes, with a degradation percentage of 22.07 % against 32.96 % of the non-encapsulated, and the colloidal stabilization of liposomal dispersion improved with the use of 1.00 % Carbopol 940. It can be concluded that the encapsulation of avobenzone in liposomes using isolecitine is highly efficient, and it is confirmed that Avobenzone photodegradation decreases when it is encapsulated, regardless of octylmetoxycinnamate.
Key words: liposomes, experimental designs, colloidal stability, encapsulation efficiency, Avobenzone, sunscreen.
INTRODUCCIÓN
La luz UVA y UVB están asociadas con el proceso de pigmentación, cáncer de la piel, fotoenvejecimiento, daño acumulativo a largo plazo y con el proceso de bronceado.1,2
La mayoría de los ingredientes activos usados como protectores solares son compuestos orgánicos que absorben la luz UV y de este modo reducen la cantidad de radiación solar que recibe la piel.3,4 La avobenzona (AVO) (butilmetoxidibenzoilmetano) es un filtro solar que absorbe la luz en el rango UVA con un máximo de absorbancia a 358 nm, es uno de los fotoprotectores de mayor uso a nivel mundial; desafortunadamente varios estudios han demostrado que su capacidad fotoprotectora se reduce del 50 al 60 % después de 1 h de exposición a la luz solar en formulaciones cosméticas5 y que esta disminución de la fotoprotección se incrementa cuando es combinada con el filtro UVB octilmetoxicinnamato (OMC).6-11
El objetivo de este estudio fue comprobar la optimización de la encapsulación de AVO en liposomas, y evaluar si constituyen una barrera física de protección contra la fotodegradación de AVO en presencia de OMC.
METODOS
Materiales
La isolecitina de soya fue adquirida de FlukaAnalytical; la AVO y OMC fueron adquiridos de DSM Nutritional Products AG. El cloroformo y metanol son Merck grado analítico. El fosfato de potasio monobásico J. T. Baker, los agentes modificadores de viscosidad carbopol (carbómero 940), celulosa microcristalina (celulosa microcristalina PH 101), goma xantan y polisorbato 60 (tween 60) fueron adquiridos de un distribuidor local DIVER Ltda.
Preparación de liposomas
El procedimiento a utilizar es el planteado por Bangham y otros,12 el método consiste en la formación de una capa delgada de fosfolípidos en el fondo de un balón de 100 mL que contienen perlas de vidrio para aumentar el área superficial y así disminuir el grosor de la capa de fosfolípidos; la disolución de isolecitina (fosfolípidos), AVO y vitamina E se hizo en cloroformo:metanol (2:1)13 y la posterior evaporación de la mezcla de solventes se realizó por rota-evaporación (RotaevaporadorHeidpolphLaborata 4000 efficient).
La hidratación de la capa de fosfolípidos más AVO y vitamina E se realizó con solución amortiguadora de fosfato a pH 7,4; la adición de esta fue constante a través de todo el tiempo de agitación; la formación de los liposomas se hizo usando un agitador orbital (Heidpolph UNIMAX 2010) a una velocidad de 150 rev/min. La concentración final de AVO en los 50 mL de solución amortiguadora usados fue de 7,5 mg (0,15 mg/mL).
Optimización de la eficiencia de encapsulación
Se aplicó para la selección de las variables que afectan la encapsulación un diseño factorial NK (22) y se adicionaron 3 réplicas en el centro para aumentar la precisión en el proceso de predicción para un total de 11 experimentos, donde los factores y niveles se describen en la tabla.
Los resultados se analizaron por superficie de respuesta, el modelo estadístico está representado por la ecuación 1:
Para todas las ecuaciones e es un componente del error aleatorio que tiene distribución normal con media cero y varianza ó2. El software estadístico utilizado fue Design-Expert® versión 7.0.0 (Stat-Ease, Inc).
Cuantificación de la avobenzona encapsulada
Se dejaron en reposo los liposomas por 1 h después de formados, se tomó una alícuota de 1 mL con pipeta volumétrica, se adicionó metanol para liberar la AVO encapsulado hasta completar 10 mL en balón volumétrico y se filtró; los miligramos de AVO encapsulados se midieron por espectrofotometría UV a 358 nm (espectrofotómetro CARY 50 Bio de Variant).
Se preparó un blanco de corrección, a 50 mL de solución amortiguadora se adicionó AVO (7,5 mg) y se agitó por 24 h y se dejó en reposo por 1 h, se tomó 1 mL y se realizó la lectura por espectrofotometría UV a 358 nm (espectrofotómetro CARY 50 Bio de Variant) para determinar la cantidad de AVO que se solubiliza en el buffer.
Se hizó una curva de calibración en el rango 3,0 × 10-4 - 8,3 × 10-3 mg mL-1. Para obtener los miligramos de AVO encapsulados al resultado de la muestra se le redujo el resultado del blanco. La eficiencia de encapsulación (EE) se determinó de acuerdo a la ecuación 2.
Estabilización de la dispersión de liposomas
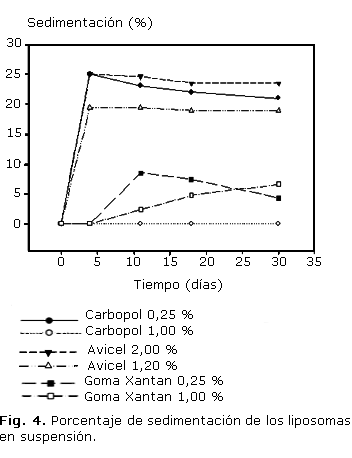
Se evaluaron 3 excipientes modificadores de la viscosidad: carbopol al 0,25 y 1,00 %, celulosa microcristalina al 1,20 y 2,00 % y goma xantan al 0,25 y 1,00 %; 25 mL, con los cuales se prepararon dispersiones de liposomas que fueron colocados en tubos de 50 mL graduados que se dejaron en reposo durante 30 días. Se midió la altura del volumen de sedimentación y los resultados se expresaron como porcentaje de sedimentación con respecto a la altura inicial de la dispersión.
Distribución del tamaño de partícula
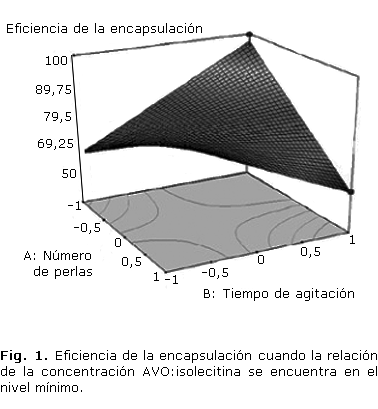
A los liposomas obtenidos bajo las condiciones del experimento 3 del arreglo experimental (tabla) se les evaluó la distribución de tamaño después de 12 h de preparados; el equipo utilizado fue un Mastersizer 2000 con aditamento Hydro 2000S (Malvern Instruments Ltd), la lectura de la muestra se realizó por triplicado.
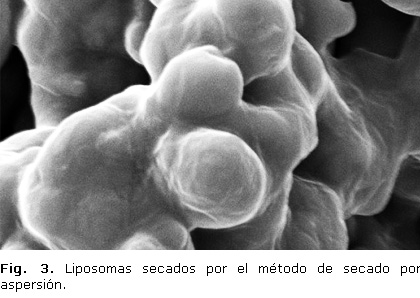
Caracterización morfológica de la superficie de los liposomas
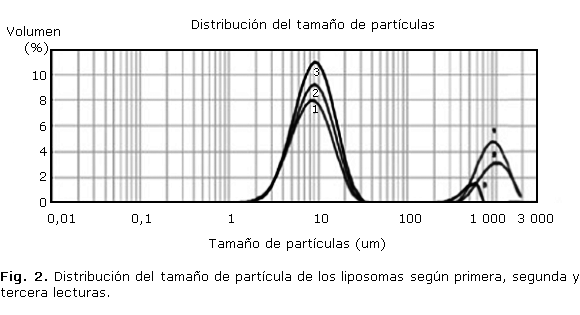
La caracterización morfológica se realizó por microscopia de barrido electrónica, usando un microscopio JOEL 5900 (Oxford Link). La observación se realizó a los liposomas obtenidos bajo las condiciones del experimento 3 (tabla), los cuales fueron previamente secados por el método de secado por aspersión, usando un secador de spray de laboratorio Büchi B-290, con las siguientes condiciones: temperatura de entrada 168 °C, temperatura de salida 110 °C, velocidad de la bomba 1 mL/min, flujo del spray del gas 6 bares y el diámetro de la aguja de 0,5 mm.
Estudio de fotoestabilidad de la AVO en liposomas
Se evaluó la estabilidad de la AVO en liposomas junto con el filtro OMC en una dispersión acuosa utilizando como agente dispersante polisorbato 60; la concentración de AVO se mantuvo en 7,5 mg/mL y la concentración de OMC fue de 37,5 mg/mL, y se comparó con una dispersión de AVO-OMC en las mismas condiciones pero sin encapsular la AVO. Ambos se sometieron a irradiación en una cámara de simulación solar Solarbox 1500e (Erichzsen) a una potencia de 1 000 Wm-2 durante una hora. Luego se tomó una alícuota de 1 mL y se llevó a balón volumétrico de 10 mL con metanol, se filtró y se midió la absorbancia a 358 nm en el espectrofotómetro ya mencionado, para calcular el porcentaje degradado de ambos filtros utilizando la curva de calibración descrita.
RESULTADOS
Optimización de la eficiencia de la encapsulación
En ensayos preliminares se encontró que la relación de AVO: isolecitina, la extensión de la superficie de la película inicial en este caso modulada por el número de perlas de vidrio adicionadas y el tiempo de agitación, eran factores críticos en la EE; en estos ensayos previos también se evaluó otros métodos de agitación como ultrasonido y vortex, en donde se encontró baja la EE. Los resultados de los experimentos según el diseño experimental (tabla) muestran que la EE se encuentra entre un 60,02 y 97,46 %, que sugieren que la metodología de preparación de liposomas es adecuada. El análisis de varianza (ANOVA), muestra que el modelo es significativo (valor p< 0,0001). En el ANOVA también se encontraron significativas las interacciones X1 X2 (valor p< 0,0001), X1 X3 (valor p 0,0124), X2 X3 (valor p 0.0477) y X1 X2 X3 (valor p< 0,0001).
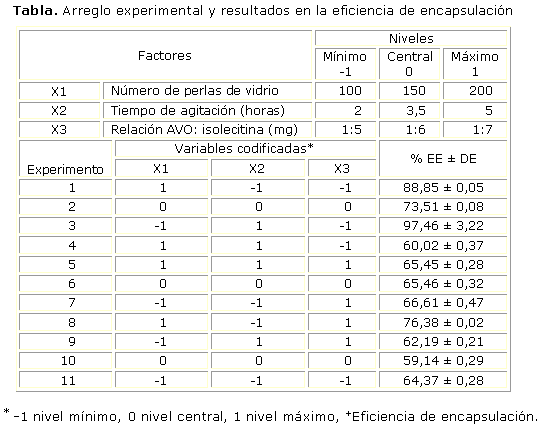
De acuerdo con los resultados experimentales las condiciones para optimizar la EE se logra cuando el factor X1 es mínimo, X2 es máximo y X3 es mínimo.
La figura 1 muestra la superficie de respuesta para la relación de concentración AVO: isolecitina en un nivel mínimo, que se ajusta al modelo expresado en la ecuación 3, con un R2 de 0,9098, un R2-ajustado de 0,8612 y un R2-predicho de 0,8718, lo que indica que el modelo es un buen predictor para optimizar la eficiencia de la encapsulación.
Caracterización morfológica y de tamaño de partícula
La distribución de tamaño de partícula para los liposomas mostró que estos tienen un valor promedio en superficie D[3,2] de 9,156 µm y diámetro promedio en volumen D[4,3] de 181,396 µm (figura 2), también se observa que los liposomas forman agregados (tamaño de ~1000 mm) que se disgregan a medida que el sistema es sometido a agitación.
Las microfotografías de barrido electrónico tomadas después de someter los liposomas a secado por aspersión (figura 3), sugieren que los liposomas tienen una morfología aproximadamente esférica, según las formas que presentan en la superficie; se observa que poseen un diámetro promedio de 5 µm, esto debido a que la humedad de la muestra debe estar por debajo del 2,0 % para garantizar un proceso adecuado durante la toma de la microfotografía, donde los liposomas perdieron gran cantidad de solución amortiguadora que quedó dentro de las vesículas pero que a su vez no se perdió integridad en la capa formada por los fosfolípidos.
Estabilización de la suspensión de liposomas
La rápida formación de agregados y precipitación hace indispensable la estabilización de la dispersión de liposomas mediante la adición de un excipiente modificador de viscosidad; la figura 4 muestra que el carbopol al 1,00 % no presentó sedimentación durante los 30 días del ensayo, al 0,25 % se mantuvo homogéneo solo los dos primeros días y al cuarto día ya había alcanzado el máximo porcentaje de sedimentación; celulosa microcristalina al 2,00 y 1,25 % mostraron la formación de precipitado desde el primer día, y un porcentaje promedio de sedimentación del 23,00 y 18,00 % respectivamente al cuarto día, la goma Xantan al 0,25 y 1,00 % mostraron un proceso de sedimentación paulatino con un máximo cercano al 10,00 % en promedio a los 11 días para la concentración de 0,25 % y 30 días para 1,00 %.
Estudio de fotoestabilidad de la AVO en liposomas
El estudio de fotoestabilidad mostró que existe una protección del filtro solar, AVO, encapsulado en liposomas. El porcentaje de degradación de la AVO encapsulada es de 22,07 %, mientras que el porcentaje de degradación de la AVO sin encapsular es de 32,96 %, con un valor p de 0,0118, lo que indica que existen diferencias estadísticamente significativas entre estas dos.
DISCUSIÓN
Las interacciones entre los 3 factores evaluados son más significativas que cada factor por separado según el ANOVA, a excepción de la relación de concentraciones que indica que es significativa para el proceso de encapsulación; la alta EE encontrada puede ser explicada por el carácter lipofílico de la AVO, luego las interacciones de AVO con las cadenas carbonadas de los fosfolípidos serían mayores en una baja relación AVO-isolecitina.
Por la importancia de las interacciones entre los factores, la aplicación de un diseño factorial es la metodología apropiada para optimizar el proceso de encapsulación en liposomas.
El tamaño de partícula es un parámetro importante desde el punto de vista funcional cosmético, debido a que está comprobado que partículas con un tamaño superior a 1 µm no penetran la piel,2 lo que evita que el filtro solar avobenzona sea absorbido por la piel y se presenten efectos indeseables,14 además los liposomas se convierten en un vehículo biocompatible y sus componentes como la fosfatidilcolina protegen contra la acción de surfactantes no iónicos que pueden afectar el equilibrio de la piel15 y mejoran el grado de humectación en formulaciones cosméticas.16
El proceso de estabilización mediante la utilización de agentes modificadores de viscosidad mostró que la correcta selección del excipiente puede mejorar la estabilidad coloidal de los liposomas al evitar la floculación, la coalescencia y posterior sedimentación. Se encontró que el agente que presentó mejores resultados para este propósito fue el carbopol al 1,00 %.
En este estudio se planteó la utilización de liposomas como agentes estabilizantes porque se espera que sean barreras físicas a la luz o barreras que impidan la interacción de AVO y OMC, en los cuales se ha reportado incompatibilidad,10 y también porque en estudios anteriores se encontró que la fotoquímica de la AVO es sensible al medio9,17 y los liposomas ofrecen 2 ambientes, se esperaría que de acuerdo con la ubicación de la AVO se puede favorecer o no la fotodegradación. El resultado encontrado indica que los liposomas no actúan como barrera física a la luz, ya que al ser así el porcentaje degradado de AVO debería ser menor, y el ambiente químico de la AVO dentro del liposoma aparentemente favorece la degradación de la AVO, sin embargo, la diferencia entre el sistema encapsulado y no encapsulado sugiere que la incompatibilidad entre la AVO y el OMC sí se evitó. Estos resultados son comparables a los encontrados cuando la AVO se encapsuló en lipoesferas, donde se observó una reducción del 28 al 15 %18 de degradación; pero son una alternativa mejor cuando se les compara con los resultados obtenidos en crema donde la AVO en presencia del OMC puede alcanzar una degradación de hasta el 60,00 %,19 lo cual indica que los procesos de encapsulación en liposomas son una manera efectiva de evitar la degradación favoreciendo la entrega de manera segura de activos en matrices cosméticas.
En conclusión, la encapsulación de AVO en liposomas usando isolecitina se logró con alta eficiencia, y se comprobó que la degradación de la AVO promovida por la luz disminuye al estar encapsulada, aún en presencia de octilmetoxicinnamato.
AGRADECIMIENTOS
Los autores agradecen a Sofía Lopez Puentes, estudiante de Química Farmacéutica de Facultad de Química Farmacéutica, Universidad de Antioquia, Medellín, Colombia, su colaboración en la realización de esta investigación.
REFERENCIAS BIBLIOGRÁFICAS
1. Walters HA, Roberts MS. Dermatologic, Cosmeceutic, and Cosmetic Development. Therapeutic and Novel Approaches. Nueva York: Informa Healthcare; 2008.
2. Barel AO, Paye M, Maibach H. Handbook of Cosmetic Science and Technology. 3a ed. Nueva York: Informa Healthcare; 2009.
3. Gonzales S, Fernandez-Lorent EM, Gilaberte-Calzada Y. The Latest on Skin Protection. Clin Dermatol. 2008;26:614-26.
4. Jacobs A, Brown P, Wilkin J. FDA considerations for sunscreens: New UV filters. Photochem Photobiol. 1999;69:53S-58S.
5. Bouillon C. Recent advances in sun protection. J DermatolSci. 2000;23 (Suppl): S57-61.
6. Chatelain E, Gabard B. Photostabilization of butyl methoxydibenzoylmethane (Avobenzone) and ethylhexylmethoxycinnamate by bis-ethylhexyloxyphenolmethoxyphenyltriazine (Tinosorb S), a new UV broadband filter. Photochem Photobiol. 2001;74:401-6.
7. Pathak MA. Sunscreens: progress and perspectives on photoprotection of human skin against UVB and UVA radiation. J Dermatol. 1996;23:783-800.
8. Schwack W, Rudolph T. Photochemistry of dibenzoyl methane UVA filters. I. J PhotochPhotobio B, 1995;28(3):229-34.
9. Mturi GJ, Martincigh BS. Photostability of the sunscreening agent 4-tert-butyl-4'-methoxydibenzoylmethane (avobenzone) in solvents of different polarity and proticity. J PhotochPhotobio A. 2008;200(2-3):410-20.
10. Dondi D, Albini AA, Serpone N. Interactions between different solar UVB/UVA filters contained in commercial suncreams and consequent loss of UV protection. PhotochPhotobioSci, 2006;(5):835-43.
11. Roscher NM, Lindemann MK, Kong SB, Cho CG, Jiang P. Photodescomposition of several compounds commonly used as sunscreens agents. J PhotochPhotobio A. 1994;80:417-421.
12. Bangham AD, Standish MM, Watkins JC. Diffusion of univalent ions across the lamellae of swollen phospholipids. J Mol Biol. 1965;13:238-52.
13. Vargha-Butler EI, Hurst EL. Study of liposomal drug delivery systems 1. Surface characterization of steroids loaded MLV liposomes. Colloid Surface B. 1995;3(2):287-95.
14. Marrot L, Belaidi JP, Lejeune F, Meunier JR, Asselineau D, et al. Photostability of sunscreen products influences the efficiency of protection with regard to UV-induced genotoxic or photoageingrelated endpoints, Br J Dermatol. 2004;151:1234-44.
15. López O, Cócera M, Walther P, Wehrli E, Coderch L, Parra JL, et al. Liposomes as protective agents of stratum corneum against octylglucoside: a study based on high-resolution, low-temperature scanning electron microscopy. Micron. 2001;32(2):201-5.
16. Betz G, Aeppli A, Menshutina N, Leueunberger H. In vivo comparison of various liposome formulations for cosmetic application. Int J Pharm. 2005;296:44-54.
17. Vallejo JJ, Mesa M. Gallardo C. Evaluation of the avobenzone photostability in solvents used in cosmetic formulations, Vitae. 2011;18(1):63-71.
18. Scalia S, Tursilli R, Sala N, Iannuccelli V. Encapsulation in lipospheres of the complex between butyl methoxydibenzoylmethane and hydroxypropyl-[beta]-cyclodextrin. Int J Pharm, 2006;320(1-2):79-85.
19. Gaspar LR, Maia Campos PMBG. Evaluation of the photostability of different UV filter combinations in a sunscreen. Int J Pharm, 2006;307(2):123-8.
Recibido: 17 de febrero de 2011.
Aprobado: 19 de abril de 2011.
Juan Fernando Pinillos Madrid. Facultad de Química Farmacéutica. Universidad de Antioquia, Calle 67 No. 53-108, Medellín, Colombia.