Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515
Rev Cubana Farm vol.46 no.2 Ciudad de la Habana abr.-jun. 2012
PRODUCTO NATURAL
Estabilidad en estante de tabletas de las hojas de Tamarindus indica L
Storage condition stability of Tamarindus indica L. leaf tablets
MSc. Jesús Rafael Rodríguez Amado,I MSc. Ariadna Lafourcade Prada,I Dr. C. Julio César Escalona Arranz,I Dr. C. Antonio Iraizoz Colarte,II Dr. C. Gustavo Sierra GonzálezIII
I Universidad de Oriente. Santiago de Cuba. Cuba.
II Instituto de Farmacia y Alimentos. La Habana, Cuba.
III Instituto Finlay. La Habana, Cuba.
RESUMEN
Objetivo: evaluar la estabilidad física, química y microbiológica, en estante, de tabletas de hojas de Tamarindus indica L.
Métodos: se evaluaron las propiedades físico-mecánicas, la concentración de polifenoles, los perfiles de disolución y la calidad microbiológica durante dos años, manteniendo las tabletas envasadas en frascos de cloruro de polivinilo de alta densidad, con tapa inviolable y almacenadas en lugar seco y fresco. Se realizaron determinaciones de cada una de las propiedades cada tres meses.
Resultados: Durante el estudio, las tabletas mantuvieron el color marrón claro que las caracteriza, el mismo olor fresco a fruta madura y la misma apariencia física. Las propiedades físicas se mantuvieron intactas durante dos años: dureza mayor que 5 kg/f (Monsanto), friabilidad menor que 1 %, masa y la altura dentro de la variabilidad permitida. El tiempo de desintegración fue menor que 10 min. La cantidad de polifenoles liberada en 30 min estuvo por encima del 87 % durante el estudio.
Conclusiones: se demostró que las tabletas de tamarindo 120 mg, mantienen las propiedades físico-mecánicas, la concentración de polifenoles y la calidad microbiológica y biofarmacéutica durante dos años. Para asegurar la estabilidad química de las tabletas con mayor precisión, en este momento se desarrollan estudios por cromatografía de capa delgada.
Palabras clave: tabletas, tamarindo, estabilidad, calidad microbiológica.
ABSTRACT
Objective: to evaluate the physical stability, chemical and microbiological stability of the Tamarindus indica L tablets on shelf.
Methods: the physical and mechanical properties, the polyphenol concentrations, the dissolution profiles and the microbiological quality were evaluated for two years. Tablets were packed in high density PVP flasks and were stored in a dry and fresh place. Each of the properties was determined every three months.
Results: throughout the study, the tablets kept their characteristic light brown color, the same odour resembling ripe fruit and the same physical appearance. The physical properties remained unchanged during two years: hardness was higher than 5 kg/f (Monsanto), friability lower than 1 %, mass and height were within the allowable variability. Disintegration time was less than 10min. The released percentage of polyphenols in 30 min was over 87% in the course of study.
Conclusions: it was demonstrated that 120mg Tamarind tablets can keep their physical-mechanical properties, the polyphenol concentrations and the microbiological and biopharmaceutical quality for 2 years. Thin layer chromatographic studies are currently conducted to assure more precisely the chemical stability of the tablets.
Key words: stability, tamarind, tablets, microbiological quality.
INTRODUCCIÓN
El tamarindo (Tamarindus indica L) es una de las especies más utilizadas por la población cubana para el tratamiento de los trastornos hepáticos. Sus hojas son ricas en proteínas, ácidos grasos, carbohidratos, polifenoles, flavonoides, aceites esenciales y elementos minerales como manganeso, cobre, cinc y selenio. Los flavonoides más abundantes en este órgano de la planta son la orientina, isoorientina, vitexina y la isovitexina. Las hojas contienen además otras sustancias como apigenina, ácido ferúlico y ácido cafeico que le confieren una buena capacidad antioxidante.1,2
Las hojas son la parte de esta planta que más utiliza la población para el tratamiento de las hepatopatías. Se ha comprobado que tienen actividad hepatoprotectora,3 antioxidante4 y antimicrobiana,5 asociada a la presencia de compuestos polihidroxilados, la mayoría de ellos polifenoles y flavonoides y aceites esenciales.
El principal problema para el uso y preparación de las formas farmacéuticas con extractos líquidos obtenidos a partir de plantas medicinales, es la estabilidad. Los extractos de las plantas tienen una composición muy compleja y son generalmente sensibles a los cambios de temperatura, sufren reacciones fotolíticas y se oxidan con facilidad. Las preparaciones medicamentosas sólidas son las formas farmacéuticas más estables. En ellas se minimiza la posibilidad de ocurrencia de procesos degradativos y ofrecen mayores ventajas por su bajo costo, facilidad de almacenamiento y una alta concentración de principio activo.6,7
En este trabajo se realiza un estudio de la estabilidad físico-mecánica, química y microbiológica de un nuevo comprimido obtenido a partir de extractos de las hojas de la especie Tamarindus indica L. durante dos años, con el objetivo de evaluar su estabilidad en condiciones ambientales normales de almacenamiento y conservación.
MÉTODOS
Preparación de las tabletas
Se prepararon las tabletas utilizando el método de granulación húmeda, modificado por Rodríguez yotros.8 Se empleó como principio activo el extracto blando estandarizado de las hojas de la especie Tamarindus indica L. Contienen además excipientes tecnológicos aprobados por la FDA, que están presentes en un gran número de formulaciones sólidas.9
Estudio de estabilidad en estante
Se evaluó la estabilidad físico-mecánica, química y biofarmacéutica y microbiológica en estante, durante 18 meses. Se envasaron las tabletas en frascos de cloruro de polivinilo de alta densidad, con tapa inviolable y se almacenaron en lugar seco y fresco, con ciclo de iluminación normal. Estas condiciones fueron seleccionadas en estudios de estabilidad acelerada.10 Se evaluaron cada tres meses las propiedades organolépticas, dureza, friabilidad, tiempo de desintegración, masa promedio, altura, humedad residual y fenoles totales. Se realizó el perfil de disolución de las tabletas cada tres meses.
- Propiedades organolépticas: se evaluó la uniformidad de color, el olor, y la apariencia de las tabletas por simple inspección visual.11
- Dureza: se determinó la resistencia a la compresión diametral, utilizando un durómetro de Monsanto. Se tomaron 10 tabletas y se determinó la dureza a cada una de ellas. Se reportó la media y la desviación estándar de este parámetro.11,12
- Friabilidad: se realizó por el método clásico informado en la literatura11,12 utilizando un friabilómetro Roche. Se ensayaron 20 tabletas cada vez, realizando por triplicado el ensayo. Se informa el porcentaje de friabilidad y la desviación estándar.
- Tiempo de desintegración: se realizó el ensayo por el método informado en la literatura.12 Se utilizó como medio de desintegración 900 mL de agua destilada a 37 ºC, en un equipo desintegrador (Erweka TM 600, Offenbach, Alemania). Se informa la media y desviación estándar de seis determinaciones.
- Masa promedio: se tomaron 20 tabletas y se pesaron con precisión centesimal. Se determinó la masa promedio dividiendo la masa total de las tabletas pesadas entre el número total de tabletas. El experimento se realizó por triplicado y se informa valor medio con la desviación estándar. La masa promedio no debía apartarse del 5 % del valor nominal de las tabletas.11
- Altura de la tableta: se tomaron 10 tabletas y se les determinó la altura con un micrómetro (MK 0-25; Rusia), se promedió y se informó la media más menos la desviación estándar. La altura de una tableta no debe apartarse más de un 5 % de su altura óptima.11
Perfil de disolución
Se realizó el perfil de disolución cada tres meses, utilizando el método espectrofotométrico de Folin Ciocalteau.13 Este método se validó para los estudios de estabilidad y para la determinación del contenido de polifenoles en los perfiles de disolución.14 Se utilizó un equipo desintegrador de cesta, marca Eureka (DT 6 RE de 6 plazas, Alemania) empleando como medio de disolución 900 mL de agua destilada, velocidad de agitación 100 rev/min, a una temperatura de 37 ± 1 ºC. Las muestras de disolución fueron tomadas a tiempos de 5, 10, 15, 20, 25 y 30 min.
Estabilidad microbiológica
Se evaluó la estabilidad microbiológica por el método propuesto en la Farmacopea Británica.13 El análisis se realiza anualmente (tiempo 0, 1 año y 2 años).
Procesamiento de los datos
Se calculó la media y la desviación estándar en todas las propiedades evaluadas, utilizando el software StatGraphics Plus (V5.1, StatEase Co. MA. USA). Se realizó una prueba t para evaluar la diferencia entre las medias de la concentración de polifenoles a tiempo 0 y 2 años, con un nivel de significación de 0,05, y una prueba de Kolmogorov-Smirnov para comparar la normalidad de la distribución de datos a ambos tiempos.
RESULTADOS
Evaluación de las propiedades de las tabletas
Se observó a lo largo de dos años de estudio que las tabletas mantienen el color marrón claro que las caracteriza, el mismo olor fresco a fruta madura y la misma apariencia física.
Los resultados de la determinación de las propiedades de las tabletas de tamarindo se presentan en la tabla 1.
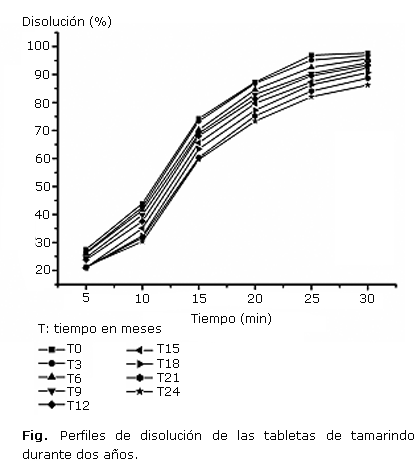
Los perfiles de disolución de las tabletas de tamarindo a lo largo de los dos años de estudio se presentan en la figura.
Los resultados del estudio de estabilidad microbiológica de las tabletas de tamarindo realizados a tiempo 0, 1 y 2 años se presentan en la tabla 2.
DISCUSIÓN
Propiedades organolépticas
En las condiciones de envasado y conservación, seleccionadas en los ensayos acelerados,10 las tabletas mantuvieron las propiedades organolépticas a lo largo de los dos años de estudio. Se mantuvo el aroma a la pulpa de la fruta madura y no cambió la apariencia de las tabletas, que mantuvieron una coloración marrón claro todo el tiempo de estudio. Estos resultados evidencian que la estabilidad de estas propiedades en las tabletas de tamarindo se mantuvieron a los largo de los dos años de estudio.
Propiedades físico-mecánicas
Las propiedades físico-mecánicas de las tabletas se mantienen de manera consistente (tabla 1). La desviación estándar de la dureza de las tabletas a los dos años de estudio, incluye el valor de dureza a tiempo 0, por lo que no existe diferencia estadística entre ambos valores con un 95 % de confiabilidad. Esta propiedad se mantuvo por encima de 5 kg/f Monsanto, durante los dos años de estudio, valor adecuado para tabletas sin cubiertas según la literatura especializada.15
La friabilidad de las tabletas de tamarindo se mantuvo por debajo del 1 % durante todo el tiempo de estudio.12 Se observó un pequeño incremento que podría justificarse por la ligera disminución de la dureza y el aumento de la humedad residual de las tabletas.
La masa y la altura promedio se mantienen dentro de la variabilidad permitida en la literatura,12,16 a lo largo de los dos años de estudio y su aumento debe estar relacionado con el aumento de la humedad residual de las tabletas.
El tiempo de desintegración se mantuvo por debajo de 10 min a lo largo del estudio. Este valor es adecuado para tabletas sin cubierta, cuyo límite según las farmacopeas, se establece en 15 min.12,13 Normalmente este parámetro aumenta con el tiempo, ya que los comprimidos se consolidan y forman redes muy rígidas que aumentan la dureza y consecuentemente el tiempo de desintegración. Sin embargo, en este estudio las tabletas de tamarindo muestran un tiempo de desintegración que disminuye en el tiempo. Esto ocurrió probablemente, por el aumento de la humedad residual ocurrido, lo que facilitó el paso del líquido al seno del compacto, permitiendo que la croscarmelosa sódica (desintegrante que actúa por hinchamiento)9 se hinchara con mayor facilidad y que las tabletas desintegraran más rápido.
La cantidad de fenoles totales en la formulación a lo largo de los dos años, se mantuvo entre 3,01 y 3,37 %. No se encontró diferencia estadística significativa entre los valores de concentración de polifenoles a tiempo 0 y 2 años, con valor del estadístico t de -1,81748 y una probabilidad de 0,14329. La prueba Kolmogorov-Smirnov mostró un valor de 0,81649, con una probabilidad de 0,53201, demostrándose la normalidad y homogeneidad de los datos en los dos tiempos evaluados.
Los perfiles de disolución permitieron cuantificar la cantidad de polifenoles liberados en 30 min por las tabletas de tamarindo a lo largo de los dos años de estudio (tabla 1, Fig.). A los dos años de estudio, la cantidad de polifenoles liberada se encuentra por encima del 87 %, elemento que indica una buena biodisponibilidad del principio activo (polifenoles) en estas tabletas, considerando que los polifenoles son quizás, los metabolitos más importantes en la actividad antioxidante y hepatoprotectora de las tabletas de tamarindo ensayadas en esta investigación.16-19
Estabilidad microbiológica
La calidad microbiológica de las tabletas de tamarindo se mantuvo inalterable a lo largo de los dos años de estudio (tabla 2). Los conteos de bacterias y de hongos se mantienen muy por debajo de los límites que indica la farmacopea.13 Se encontraron referencias en la literatura sobre las buenas propiedades antimicrobianas de los extractos de las hojas de tamarindo.5,20 Este estudio mostró que la calidad microbiológica de las tabletas de tamarindo, con un 20 % de sólidos totales (120 mg) del extracto blando de las hojas de esta especie, se mantiene estable durante 2 años.
En conclusión, se demostró que las tabletas de tamarindo 120 mg mantienen las propiedades físico-mecánicas, la concentración de polifenoles y la calidad microbiológica y biofarmacéutica durante dos años. Para asegurar la estabilidad química de las tabletas con mayor precisión, en este momento se desarrollan estudios por cromatografía de capa delgada.
REFERENCIAS BIBLIOGRÁFICAS
1. Dehesa MA, Jáuregui O, Cañigueral S. Estudio por HPLC-MS/MS de compuestos fenólicos presentes en las hojas de Tamarindus indica L. Rev de Fitoterapia 2006;6. [citado 3 Nov. 2008]. Disponible en: http://www.fitoterapia.net
2. Escalona AJC, Pérez RR, Licea JI, Rodríguez AJR, Argota-Coello H, Cañizares-Lay J, et al. Chemical constituents of Tamarindus indica L. leaves. Rev Cubana Quím. 2010;23(3);65-71.
3. Escalona AJC, Dahesa MA, Boizzan ML. Evaluación preclínica del efecto hepatoprotector de extractos flavonólicos de las hojas de Tamarindus indica L. Etnomedicine. 1995;1:147-56.
4. Jouyex M, Mortimer F, Fleurentin J. Screening of antiradical, antilipoperoxidant and hepatoprotective effects of nine plants extracts used in Caribbean folk medicine. Phytotherapy Res. 1995;9:228-30.
5. Escalona AJC, Peres RR, Urdaneta I, Camacho M, Rodriguez AJR, Licea JI. Evaluation of the antimicrobial activity of extracts from Tamarindus indica L. leaves. Pharmacognosy Magazine. 2010:6(23):242-7.
6. Souza CRF. Comparative Study of the Production of Dried Extract of Bauhinia forficata Link by the Spray Dryer and the Spouted Bed Processes (Disertación), USP. Brazil. 2003. p. 180. Available from: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0104-66322005000200011
7. Souza CRF, Oliveira WP. Spouted Bed Drying of Bauhinia forficata Link Extract: The Effects of Feed Atomizer Position and Operating Conditions on Equipment Performance and Product Properties. Braz J Chem Eng. 2005;22(2):239.
8. Rodríguez AJR, Lafourcade PA, Escalona AJC. Formulación de comprimidos de tamarindo por el método de granulación húmeda. Rev Cubana Farm [Internet]. 2011 Sep [citado 18 Dic 2011]; 45(3):414-422. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75152011000300010&lng=es
9. Rowe RC, Sheskey PJ, Owen SC. Handbook of Pharmaceutical Excipient. New York: Pharmaceutical Press & American Pharmacists Association; 2009
10. Rodríguez AJR, Lafourcade PA, Escalona AJ. Estudio de la estabilidad química acelerada de las tabletas de Tamarindus indica L. Rev Cubana Quím. 2011;23(1):9-16.
11. Iraizoz A, Bilbao RO, Barrios MA. Conferencias de Tecnología Farmacéutica II. La Habana: IFAL. Universidad de La Habana, ENPES; 1992.
12. United States Pharmacopeia. The official compendia of standards. Version 1.0. For Windows. New York: Pharm Convention Inc.; 2007.
13. British Pharmacopoeia (BP). London: Stationary Office; 2010.
14. Rodríguez AJR, Escalona AJC, Lafourcade PA, Rodríguez RR, Batista RA. Validación del método de cuantificación de polifenoles en el extracto fluido de Tamarindus indica L. Rev Cubana Quím. 2011;23(1):42-50.
15. Lachman L, Lieberman H. Pharmaceutical Dosage Forms, Tablets. New Cork: Marcel Dekker; 1981.
16. Martinelo F, Soares FM, Franco JJ, Santos AC, Sugohara A, García SB, et al. Hypolipemic and antioxidant activities from Tamarindus indica L. pulp fruit extract in hypercholesterolemic hamsters. Food Chem Toxicol. 2006;44:810-8.
17. Gupta, AK, Chitme H, Dass DK, Misra N. Antioxidant activity of Chamomile recutita capitula methanolic extracts against CCl4-induced liver injury in rats. J Pharmacol Toxicol. 2006b;1:101-7.
18. Troncoso L, Guija E. Efecto antioxidante y hepatoprotector del Petroselinum sativum (perejil) en ratas, con intoxicación hepática inducida por paracetamol. An Fac Med (Lima). 2007;68(4):333-43.
19. Heba E, Youssif AA, Khedr Z, Mohamed ZM. Hepatoprotective and antioxidant effects of Zizyphus spina-christi fruits on carbon tetrachloride induced hepatotoxicity in rats. Nature Sci. 2011;9(2):1-7.
20. Doughary JH. Antimicrobial activity of Tamarindus indica Linn. Trop J Pharm Res. 2006;5;597-603.
Recibido: 24 de noviembre de 2011.
Aprobado: 29 de diciembre de 2011.
Jesús Rafael Rodríguez Amado. Universidad de Oriente. Ave. Patricio Lumumba s/n Santiago de Cuba, Cuba. Correo electrónico: jimmy@cnt.uo.edu.cu