Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515
Rev Cubana Farm vol.47 no.2 Ciudad de la Habana abr.-jun. 2013
ARTÍCULO ORIGINAL
Síntesis, caracterización fisicoquímica y del estado sólido de asparaginatos de cobre, magnesio, manganeso y zinc
Synthesis, physiochemical and solid state characterization of copper, magnesium, manganese and zinc asparaginates
Dra. Julie Fernanda Benavides Arévalo, Dra. Gloria Elena Tobón Zapata
Universidad de Antioquia. Facultad de Química Farmacéutica. Medellín, Colombia.
RESUMEN
Introducción: la deficiencia de minerales en la población está asociada a enfermedades metabólicas, hormonales e inmunológicas. Usualmente, los minerales son suplementados en el organismo en forma de sales inorgánicas, las cuales pueden causar molestias gástricas y baja absorción en dependencia del tipo de sal empleado. Estudios previos muestran una adecuada absorción y ausencia de efectos gástricos cuando los minerales están asociados a ligandos orgánicos como enzimas, proteínas y particularmente aminoácidos.
Objetivo: determinar mediante un estudio de preformulación la viabilidad de utilizar asparaginatos de cobre, magnesio, manganeso y zinc en suplementos nutricionales.
Métodos: se realizó la síntesis y la verificación de formación de los complejos por espectroscopia infrarroja por transformada de Fourier y difracción de rayos X de polvos. Se evaluó la solubilidad, la constante de disociación, la eficiencia de la disolución y las propiedades físicas del estado sólido (morfología, distribución y tamaño de partícula, índice de Haussner, porosidad y compresibilidad) de los complejos. Se determinó la compatibilidad de los complejos con excipientes.
Resultados: en los espectros infrarrojos se observó la participación del grupo carboxilo de la asparagina en la formación del enlace de coordinación de los complejos. En los difractogramas de rayos X se mostró la ausencia de los materiales de partida y la cristalinidad en los complejos. La solubilidad, la constante de disociación y la eficiencia de la disolución de los complejos, establecieron su carácter anfótero.
Conclusiones: los resultados en las propiedades físicas del estado sólido, la humedad y la compatibilidad con excipientes, establecen que las formulaciones de los aparaginatos de cobre, magnesio, manganeso y zinc tienen propiedades reológicas adecuadas para propósitos farmacéuticos.
Palabras clave: minerales, aminoácidos, complejos, solubilidad, eficiencia de la disolución, porosidad, compresibilidad, compatibilidad.
ABSTRACT
Introduction: the mineral deficiency in the human population has been associated with metabolic, hormonal and immunological disorders. These minerals are generally supplemented with inorganic salts in the body, but they might cause gastric distress and low absorption problems depending on the type of salt used. Previous studies demonstrated adequate absorption and absence of gastric effects when minerals were associated with organic ligands such as enzymes, proteins and particularly amino acids.
Objective: to determine the viability of copper, magnesium, manganese and zinc asparaginates as nutritional supplements in a preformulation study.
Methods: the synthesis and verification of the formation of complexes were carried out by Fourier transformed infrared spectroscopy and X-ray diffraction of powders. The solubility, the dissociation constant, the dissolution efficiency and the physical solid state properties (morphology, particle distribution and size, Haussner´s index, porosity and compressibility) of these complexes were evaluated. The compatibility of the complex with excipients was determined.
Results: the involvement of the asparagine carboxyl group in the formation of the coordination bond of the complex was observed in the infrared spectra. the absence of starting materials and the crystallinity in the complexes were evidenced in the X-ray diffraction of powders. The solubility, the dissociation constant and the dissolution efficiency of the complexes established their amphoteric character.
Conclusions: the results achieved in the physical solid state properties, the level of moisture and the compatibility with the formulation excipients indicate that copper, magnesium, manganese and zinc asparaginates have suitable rheological properties for pharmaceutical purposes.
Key words: minerals, amino acids, complex, solubility, dissolution efficiency, porosity, compressibility and compatibility.
INTRODUCCIÓN
Los minerales son elementos químicos simples, imprescindibles para la actividad celular, el control del metabolismo, la regulación de las funciones hormonales y el transporte a través de las membranas. Por su importancia a nivel biológico se asocia la deficiencia de minerales con el desarrollo o la adquisición de enfermedades.1 Los alimentos constituyen la principal fuente de minerales, sin embargo, no son siempre suficientes en calidad y cantidad para satisfacer todas las necesidades del organismo; al recurrir a los suplementos dietarios, se encuentra que su gran mayoría, asocian el mineral a sales inorgánicas (carbonatos, cloruros, óxidos, sulfatos, etc.) que son agresivas a nivel gástrico y que no tienen afinidad con las células mucosas del intestino delgado, lo cual dificulta por tanto, su absorción en el organismo.2
Diversas investigaciones señalan que los minerales ligados a moléculas orgánicas, son una alternativa a la difícil incorporación de metales en el organismo; al utilizar las vías metabólicas de trasporte de las moléculas orgánicas, los metales se conducirían hasta el intestino donde pueden ser fácilmente absorbidos, lo cual evita a su vez, los molestos efectos gástricos propios de las sales inorgánicas de los metales.3,4
Para determinar la viabilidad de utilizar complejos organometálicos en la suplementación nutricional, en este trabajo se presenta un estudio de preformulación de los complejos formados con el aminoácido L-asparagina (Asn) y los cationes: cobre (Cu), magnesio (Mg), manganeso (Mn) y zinc (Zn).
Previo al desarrollo de formas de dosificación orales, es necesario realizar una caracterización fisicoquímica y del estado sólido que incluya además de técnicas instrumentales de análisis, un estudio de la morfología, el tamaño de partícula, las propiedades reológicas (índice de Haussner, porosidad y compresibilidad), la humedad y la compatibilidad con excipientes.5-7
MÉTODOS
Síntesis de los complejos
Se utilizó para la síntesis de los complejos, L-asparagina monohidrato, acetato de cobre, carbonato de magnesio, sulfato de manganeso y óxido de zinc (Merck), en una relación molar de metal:aminoácido de 1:2. En la síntesis, soluciones acuosas de los materiales se mezclaron durante 1 h a 70 °C, y se utilizó etanol como agente precipitante. Los cristales obtenidos fueron removidos por filtración con papel filtro de tamaño de poro de 125 mm y secados a 25 ± 2 °C por 72 h.4,8
Caracterización fisicoquímica
Espectroscopia infrarroja. Los espectros infrarrojos entre 500 cm-1 y 4 000 cm-1 fueron obtenidos con un espectrofotómetro por transformada de Fourier, FT-IR Spectrum BX marca Perkin Elmer y realizando pellets de los complejos con KBr.
Análisis de difracción de rayos-X. Los difractogramas de rayos X fueron realizados en un difractómetro de rayos X para polvos marca Rigaku, operado a 40 kV y 30 mA, provisto de una fuente de Cu (l= 1,5418 Å), realizando un barrido 2 theta de 3 ° a 50 ° a una velocidad de barrido de 2 °/min.
Mediciones de solubilidad. La solubilidad de los complejos en solución acuosa fue determinada utilizando suspensiones saturadas en equilibrio (10 mL) a diferentes valores de pH (2, 3, 4, 5, 6, 7, 8, 9 y 10). Las soluciones se elaboraron siguiendo la metodología para la preparación de soluciones de prueba de la USP 32 NF 27 y realizando las mediciones de pH en un pHmetro CG 820 marca Schott Gerate. Las muestras por triplicado, se sometieron a agitación mecánica a 50 rpm a 37 °C por 72 h, luego se filtraron con cánulas de filtro de tamaño de poro de 0,5 µm, y los filtrados se analizaron por absorción atómica para obtener los valores de solubilidad, considerando los factores de dilución. Para el complejo de Cu la determinación se efectuó por espectroscopia UV-VIS y realizando la lectura a 636 nm.4,7,9,10
Determinación de la constante de disociación (pKa). El pKa1 y pKa2 de los complejos se determinó por el método propuesto por Albert y Serjeant mediante de la siguiente ecuación:
donde:
Cs: solubilidad intrínseca.
Co: solubilidad de saturación.
En los complejos el valor de Co se obtiene a pH 6; para el cálculo de pKa1, Cs se determina a pH de 2 y el cálculo de pKa2, Cs se determina a pH de 10.4,7
Eficiencia de la disolución. La eficiencia de disolución es un parámetro obtenido de la relación en términos de porcentaje de las áreas bajo la curva del proceso de disolución experimental y de un proceso en el que se asume un porcentaje de disolución en el tiempo igual al 100 %.4 Los complejos inicialmente se tamizaron con tamices Tyler® ASTM E11 No.140 (106 µm), No.120 (125 µm) y No. 80 (180 µm) para luego realizar con cada una de las fracciones perfiles de disolución en un equipo disolutor tipo II (paletas), según el método de la USP 32 NF 27, a 75 rpm a 37 °C, utilizando una dosis equivalente al requerimiento diario nutricional de cada metal (2 mg de Cu, 6 mg de Mg, 2 mg de Mn y 10 mg de Zn) en 900 mL de agua desionizada.9,11 Se determinó por absorción atómica, el porcentaje disuelto de metal cada 10 min y durante 60 min, utilizando una curva de calibración con estándares de Mg, Mn y Zn (Merck).9 La determinación de Cu se realizó por espectroscopia UV-VIS por formación de un complejo coloreado que absorbe a 636 nm.4,10
Propiedades físicas del estado sólido
Morfología, distribución y tamaño de partícula. Las características morfológicas de las partículas de los complejos se observaron por medio de microfotografías ópticas, utilizando un microscopio BM-180 Boeco, con un objetivo de 10X, adaptado a una cámara digital con software Opticam y a una resolución de 320 x 240 pixeles. Adicionalmente se obtuvieron microfotografías electrónicas de las partículas de los complejos en un microscopio JSM 840 marca Jeol con aumentos de 100 X a 10 000 X.
La distribución del tamaño de partícula se obtuvo por el método de tamices, utilizando tamices Tyler® ASTM E11 No.140 (106 µm), No.120 (125 µm) y No. 80 (180 µm), y determinando en cada tamiz la cantidad de material retenido.6
La determinación del tamaño de partícula promedio para cada fracción se obtuvo mediante análisis de imagen de las microfotografías ópticas por Image y el empleo de un software de desarrollo propio y validado; la medida informada para todos los complejos corresponde al diámetro de volumen de superficie.4,12
Densidad aparente, asentada y verdadera. Se colocó 10 g de cada complejo en una probeta graduada y se midió el volumen ocupado por el sólido. La densidad aparente fue calculada a partir de la relación de masa y de volumen. La densidad asentada corresponde al volumen ocupado por el sólido luego de ser sometido a 12 00 vaivenes en un Autotap AT-2 Quantachrome instruments. Para obtener la densidad verdadera, el volumen ocupado por 3,5 g de cada complejo se midió en un picnómetro de helio 11134 Accupyc. La densidad verdadera se determinó por el cociente de la masa de la muestra y el volumen real dado por el equipo.4,6
Determinación del índice de Haussner, compresibilidad y porosidad. A partir de las densidades aparente, asentada y verdadera del polvo se determinaron el índice de Haussner (HI), la compresibilidad (% C) y la porosidad (% P) de los complejos por medio de las siguientes ecuaciones.4,6
![]()
![]()
![]()
Humedad. La humedad en equilibrio de los complejos, se obtuvo en una balanza MB200 Ohaus, utilizando 5 g de muestra, a una temperatura de 85 °C durante 15 min, condiciones establecidas para compuestos similares en la USP 32 NF 27.6,9
Compatibilidad con excipientes. Se realizó una formulación con la fracción obtenida por el tamiz No. 140 de cada complejo, utilizando una cantidad equivalente al requerimiento diario nutricional y como excipientes: glicolato de almidón sódico (explosol®, Blanver) al 3 %, como desintegrante, talco (Protokimica) al 3 %, como lubricante, dióxido de silicio (Aerosyl®, JSC) al 1 %, como modificador de flujo y avicel® PH 101 (FMC Biopolymer Corp) en cantidad suficiente, como diluyente y aglutinante. Con estos materiales se realizó una mezcla de polvos en un mezclador horizontal 380026 Riddhi, acoplado a mezclador en V de capacidad de 10 mg operado a 15 rpm por 30 min.6,11,13 Se verificó por calorimetría diferencial de barrido y espectroscopia infrarroja la compatibilidad de los complejos con los excipientes.7,14 Adicionalmente, a las formulaciones de cada complejo se les evaluó el índice de Haussner, la porosidad y la compresibilidad, con fines comparativos a los resultados obtenidos para los complejos sin formular.4,6
RESULTADOS Y DISCUSIÓN
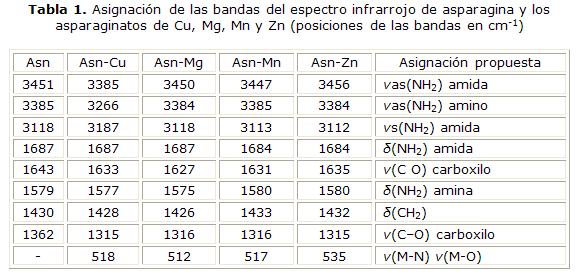
En la tabla 1, se presenta la asignación propuesta de los espectros infrarrojos de la asparagina libre y de los complejos. En los espectros infrarrojo se evidencia la participación del carboxilo en la coordinación, debido a que las vibraciones asimétricas y antisimétricas de este grupo en la asparagina aparecen en aproximadamente 1 643 cm-1 y 1 362 cm-1 y en los complejos están desplazadas a aproximadamente 1 627 cm-1 y 1 315 cm-1, lo anterior está de acuerdo con informes previos de complejos de aminoácidos con metales que involucran el mismo grupo en la formación del enlace metal-ligando.15,16 En los difractogramas de rayos X de los complejos (Fig. 1), se evidencia la cristalinidad de los asparaginatos y la ausencia de rastros de los materiales de partida.
La solubilidad acuosa de los complejos es mayor a valores bajos y altos de pH (Fig. 2), debido a que se genera un incremento en la concentración de especies ionizadas en el medio, comportamiento explicado por las propiedades ácido-base de los complejos, los cuales en medio ácido o básico forman sales.4,5 A valores de pH comprendidos entre 5 y 6 se presenta la menor solubilidad de los complejos, este resultado es atribuido a la presencia de formas no ionizadas de los complejos y a que en este rango se encuentra el punto isoeléctrico del ligando.4,5 Los resultados de pKa1= 2 y pKa2= 10 obtenidos en todos los complejos corroboran el carácter anfotérico mostrado en los ensayos de solubilidad, el comportamiento fue similar en todos ellos debido a que tienen el mismo ligando.4,5
En la tabla 2 se presentan los resultados de tamaño de partícula, eficiencia de la disolución y propiedades reológicas para cada fracción de los asparaginatos de Cu, Mg, Mn y Zn. El promedio de diámetro de volumen de cada fracción de los complejos está en el rango de 77 µm a 177 µm. La eficiencia de la disolución para cada fracción de los complejos presenta la mayor tendencia ascendente a los 40 min y como es esperado fue mayor para la fracción con el menor tamaño de partícula, la cual a su vez fue la fracción predominante en el ensayo de distribución de tamaño de partícula; por estas razones esta fracción fue la escogida para la elaboración de la formulación.5,6
La eficiencia en la disolución en todos los asparaginatos parece estar favorecida por las formas irregulares de sus partículas, lo cual se muestra en las microfotografías ópticas y electrónicas de la figura 3.4,5
Con respecto a los parámetros reológicos determinados para los complejos, estos mostraron ser aceptables. El índice de Haussner tomó valores entre 1,24 y 1,50, entre menor sea el valor que tome este parámetro mejor será su flujo; la compresibilidad estuvo en el rango de 19 % a 33 %, lo cual representa una moderada capacidad de empaquetamiento bajo la acción de una fuerza externa; la alta porosidad, entre 78 % y 89 %, es atribuida posiblemente a la forma irregular de las partículas de los complejos.4,6 La adición de los excipientes a los complejos, permitió la obtención de mejores resultados reológicos.4,6 En las formulaciones el índice de Haussner presentó un valor máximo de 1,17; la porosidad estuvo en el rango de 72 % a 78 % y la compresibilidad entre 11 % y 19 %.6 Por otro lado, la humedad en los complejos y en las formulaciones fue menor al 5 %, lo cual indica que no se presentarán inconvenientes en procesos industriales farmacéuticos, al menos los atribuidos a esta propiedad, y que pueden ser almacenados fácilmente.7
Los espectros infrarrojos y difractogramas de rayos X de polvos verificaron la formación de los complejos. La determinación de la constante de disociación y los perfiles de solubilidad dependientes del pH en los complejos, evidenciaron su carácter anfótero y los resultados de eficiencia de la disolución mostraron su apropiado comportamiento en agua. La humedad, las propiedades físicas del estado sólido y las propiedades reológicas resultaron ser aceptables en todos los complejos, sin embargo se presentaron mejores resultados reológicos cuando los complejos son formulados con excipientes; los cuales a su vez, según los estudios de compatibilidad, no mostraron interaccionar con los complejos.
A modo de conclusión: los resultados de este estudio demuestran propiedades fisicoquímicas y reológicas adecuadas para el desarrollo de formas de dosificación orales con los asparaginatos de Cu, Mg, Mn y Zn.
REFERENCIAS BIBLIOGRÁFICAS
1. Hanikenne M, Merchant S, Hamel P. Transition metal nutrition: a balance between deficiency and toxicity. The Chlamydomonas: organellar and metabolic processes. 2nd ed. Ottawa: David Stern; 2009. p. 333-99.
2. Benavides J, Tobón G. Evaluación de la dimensión fractal reactiva de los glicinatos de magnesio, manganeso y zinc. Rev Cubana Farm [Internet]. 2012 [citada 7 Nov 2012];46(1). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75152012000100003&lng=es
3. Violante A, Ricciardella M, Pigna M, Capasso R. Effects of organic ligands on the adsorption of trace elements onto metal oxides and organo-mineral complexes. Biogeochemistry of trace elements in the rhizosphere. Amsterdam: Elsiver; 2005. p. 157-82.
4. Benavides J. Evaluación de complejos organometálicos para la suplementación oral [tesis]. Medellín: Universidad de Antioquia; 2012.
5. Wells J. Pharmaceutical preformulation. 2nd ed. London: Horwood; 1993. p. 193-208.
6. Tobón G, Benavides J, Flórez O. Copper glycinate: an approach to its solubility. Rev Cubana Farm [Internet]. 2009 [citada 7 Oct 2012];43(1). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75152009000100005&lng=es&nrm=iso&tlng=es
7. Barman T, Mukherjee G. Coordination equilibria of mixed ligand complex of CuII with glycylglycine and biguanide. Indian J Chem. 2009;48A:38-44.
8. United States Pharmacopeial Convention. USP 32/NF 27. physical Test and Determinations. The official compendia of standards. Rovkville: Marck Printing; 2000. p. 11, 711, 776, 786, 1181, 2040, 1057-1315.
9. Valores de referencia diarios y nivel de ingesta máximo tolerable de vitaminas, minerales y oligoelementos para suplementos dietarios. Santa Fé de Bogotá, República de Colombia, Ministerio de la Protección Social. Decreto 3249 (2006).
10. Swarbrick J, Boylan J. Encyclopedia of pharmaceutical Technology. Vol. XII Tomo 6. New York: Marcel Dekker; 1997. p. 165.
11. Tobón G, Flórez O, Baena J. Validación de la técnica deaAnálisis del tamaño de partículas por medio de un microscopio de luz óptica asistido por un computador personal. Vitae. 2006;13:85-95.
12. Rowe R, Sheskey P, Owen S. Handbook of pharmaceutical excipients. 5th ed. London: Butler & Tanner; 2006. p. 132, 701, 767.
13. Segment Marketing LAB. AG Laboratory & Weighing Technologies. Artículos técnicos. FarmaNews 5. Greifensee: Ed. Mettler-Toledo; 2007.
14. Baran E, Viera I, Torre M. Vibrational spectra of the Cu (II) complexes of L-asparagine and L-glutamine. Spectrochim Acta A. 2007;66:114-7.
15. Wagner C, Baran E. Vibrational spectra of Zn(II) complex of the amino acids with hydrophobic residues. Spectrochim Acta Part A. 2009;72:936-40.
16. Huang L, Tong W. Impact of solid state properties on develop ability assessment of drug candidates. Adv. Drug Delivery Rev. 2004;56:321-34.
Recibido: 30 de noviembre de 2012.
Aprobado: 5 de enero de 2013.
Julie Fernanda Benavides Arévalo. Universidad de Antioquia. Ciudad Universitaria. Oficina 5-108. Medellín, Colombia. Correo electrónico: getobon@farmacia.udea.edu.co