Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515
Rev Cubana Farm vol.48 no.2 Ciudad de la Habana abr.-jun. 2014
ARTÍCULO ORIGINAL
Validación del método por espectrofotometría ultravioleta para control de calidad de clorhidrato de ciprofloxacina en tabletas Ciprecu
Validation of the ultraviolet spectrophotometry method for the quality control of ciprofloxacin chlorhydrate in Ciprecu tablets
MSc. Maikel Pérez Navarro,I MSc. Yaslenis Rodríguez Hernández,II DraC. Yania Suárez PérezIII
I Laboratorios Dr. A. Bjarner C.A, Guayaquil, Ecuador.
II Laboratorios GM. Guayaquil, Ecuador.
III Instituto de Farmacia y Alimentos. Universidad de La Habana, Cuba.
RESUMEN
Introduccción: las quinolonas son un grupo de agentes antimicrobianos de gran importancia en la clínica. El clorhidrato de ciprofloxacina monohidrato es una fluoroquinolona antibacterial de segunda generación que se indica en el tratamiento de diversas infecciones y se comercializa en forma de colirio, inyectable, cápsulas y tabletas.
Objetivo: desarrollar y validar un método analítico por espectrofotometría ultravioleta, con vistas a su aplicación al control de calidad del clorhidrato de ciprofloxacina en tabletas Ciprecu recién elaboradas.
Métodos: se desarrolló el método en el laboratorio y se realizó una validación exhaustiva atendiendo a los parámetros de la categoría I. El método se seleccionó teniendo en cuenta la presencia de grupos cromóforos en la estructura del compuesto analizado. Se determinó la longitud de onda de máxima absorción a 273 nm de 5 µg/mL en ácido clorhídrico 0,1 mol/L.
Resultados: a partir del proceso de validación realizado, se demostró la adecuada especificidad frente a los componentes de la matriz en estudio, así como su linealidad, exactitud y precisión en el rango de 2,5 a 7,5 µg/mL. Los resultados de la aplicación de este método fueron similares a los obtenidos por el método oficial propuesto con iguales propósitos en USP 33, 2010.
Conclusiones: el método fue válido con el objetivo propuesto, lo cual constituye una nueva alternativa simple, rápida y económica para el control de calidad de clorhidrato de ciprofloxacina en tabletas Ciprecu.
Palabras clave: clorhidrato de ciprofloxacina monohidrato, espectrofotometría ultravioleta, validación, control de calidad, tabletas.
ABSTRACT
Introduction: quinolones are a group of antimicrobials of high clinical significance. Ciprofloxacin hydrochloride monohydrate is a second-generation antibacterial fluoroquinolone for treatment of several infections and is marketed as eye drops, injections, capsule and tablets.
Objective: to develop and to validate an ultraviolet spectrophotometric analytical method to be used in the quality control of ciprofloxacin hydrochloride monohydrate in newly manufactured Ciprecu tablets.
Methods: this method was devised at the laboratory and thoroughly validated pursuant to the category I parameters. The method was selected on account of the existence of chromophore groups in the structure of the analyzed compound. The maximum absorption wavelength was set at 273 nm of 5 µg/mL in 0.1 mol/L hydrochloric acid.
Results: based on the validation process, it was demonstrated that this method has adequate specificity against the study matrix components, as well as its linearity, accuracy and precision in the range of 2.5 to 7.5 µg/mL. The results of the application of this method were similar to those of the official procedure suggested for the same purposes in USP 33, 2010.
Conclusions: The analytical method was valid for the suggested purposes, so it is a new simple, rapid and economic alternative for the quality control of Ciprofloxacin hydrochloride in Ciprecu tablets.
Key words: ciprofloxacin hydrochloride monohydrate, ultraviolet spectrophotometry, validation, quality control, tablets.
INTRODUCCIÓN
Las quinolonas son un grupo de agentes antimicrobianos sintéticos que tienen amplio uso en medicina humana y veterinaria, debido a su seguridad, buena tolerancia y amplio espectro antimicrobiano.1 Su importancia en la clínica se debe a su efecto sobre bacterias gramnegativas, aunque las nuevas quinolonas fluoradas son más activas frente a las grampositivas.2
El clorhidrato de ciprofloxacina monohidrato es una fluoroquinolona antibacterial de segunda generación3,4 que se indica en infecciones del tracto respiratorio, del tracto urinario, intraabdominales y del tracto biliar, gastrointestinales u otras infecciones sistémicas severas.2 Se formula como tabletas,4,5 colirio al 0,3 % e inyectable.2
En las monografías oficiales se proponen métodos por cromatografía líquida de alta resolución (CLAR) que utilizan detector UV a 278 nm para el análisis de la materia prima y las tabletas. Se proponen mezclas de acetonitrilo:solución de ácido fosfórico previamente ajustada pH= 3 con trietilamina como fase móvil.4,5
Se han discutido los principales puntos críticos del análisis por CLAR, empleando columnas C18, en el cual pueden aparecer dos picos cromatográficos al usar detector UV con arreglo de diodos y espectrometría de masa. Se analiza la influencia en primer lugar del disolvente, demostrando que la ciprofloxacina disuelta en metanol en medio ácido, causa la esterificación del grupo carboxilo. Este es un fenómeno reversible después de eluir con solución acuosa ácida/acetonitrilo como fase móvil, siendo el control del pH un factor clave para lograr la detección por espectrometría de masa. Además se evalúa la composición de la fase móvil y el tipo de fase estacionaria.6
Los métodos espectrofotométricos se han utilizado con diversos propósitos. Tal es el caso de un método de bajo costo desarrollado y validado para determinar ciprofloxacina después de su extracción en fase sólida. Se midió directamente la absorbancia a 277 y 380 nm, usando volúmenes de muestra de 10 mL y Sephadex SP C-25 como resina intercambiadora. El método se aplicó con éxito al control de calidad de varias formas farmacéuticas: colirio, tabletas y cápsulas.7 También se ha utilizado para investigar el equilibro de protonación y la lipofilidad de este analito y compararlo con grepafloxacina, otra quinolona antibacteriana.8 La intensificación de los efectos farmacológicos de la ciprofloxacina inducido ultrasónicamente, fue investigado por el análisis de su espectro UV, para lo cual se empleó suero de albúmina bovina como modelo proteico.9
Otros autores refieren el empleo de la electroforesis capilar de zona (CZE) para resolver mezclas de quinolonas, empleando adicionalmente procedimientos de calibración multivariada para resolver el solapamiento entre los espectros de ciprofloxacina y sarafloxacina. En este método se emplea detector con arreglo de diodos.1
Cuando se desea liberar el producto farmacéutico recién elaborado, se pueden utilizar métodos analíticos simples y rápidos que garanticen la cuantificación del analito sin interferencias de los componentes de la matriz, lo cual requiere un análisis caso a caso.10 Los métodos por espectrofotometría ultravioleta (UV) directa son una opción disponible en cualquier laboratorio, siendo una alternativa simple y rápida, que no requiere de amplios recursos, lo cual no siempre ocurre con los cromatógrafos líquidos de alta resolución.
Por esta razón, en el presente trabajo se propone como objetivo desarrollar y validar un método por espectrofotometría UV directa para el análisis de clorhidrato de ciprofloxacina en tabletas Ciprecu.
MÉTODOS
DESARROLLO DEL MÉTODO PARA CONTROL DE CALIDAD DE CLORHIDRATO DE CIPROFLOXACINA MONOHIDRATO. ESPECTROFOTOMETRÍA UV
- Preparación de la sustancia de referencia (SR)
Se preparó una solución de concentración 5 µg/mL de clorhidrato de ciprofloxacina monohidrato, estándar de referencia USP (No. de identificación: 1134335, lote: J0H307) en ácido clorhídrico 0,1 mol/L como disolvente.
- Determinación de la longitud de onda de máxima absorción del clorhidrato de ciprofloxacina monohidrato en solución
Se determinó la longitud de onda (l) de máxima absorción a partir del espectro UV obtenido en el rango de 200 a 400 nm, de la SR (5 µg/mL en ácido clorhídrico 0,1 mol/L).
- Descripción del método para la cuantificación de ciprofloxacina base
1. Pesar con exactitud una muestra de ensayo equivalente a 10 mg de ciprofloxacina base y trasvasar a un matraz volumétrico de 10 mL.
2. Añadir 5 mL de HCl 0,1 mol/L.
3. Agitar durante 40 min en agitador magnético (THERMOLYNE. SP18425) a 600 rpm.
4. Completar a volumen con HCl 0,1 mol/L y mezclar por inversión.
5. Filtrar a través de papel de filtro MN 615 • Ø 125 mm desechando los primeros 3 mL.
6. Tomar 5 mL y trasvasar a un matraz volumétrico de 100 mL y mezclar por inversión.
7. Tomar 1 mL y trasvasar a un matraz volumétrico de 10 mL y mezclar por inversión.
8. Realizar la lectura de absorbancia a una longitud de onda de 273 nm frente a un blanco de HCl 0,1 mol/L.
El contenido de analito se calculó por la expresión siguiente:
![]()
donde:
Cm: concentración de la muestra expresada en %.
Cp: concentración de la SR expresada en %.
Absm: valor de absorbancia obtenida para la muestra.
Absp: valor de absorbancia obtenida para el patrón.
- Preparación de la muestra de tabletas para el análisis cuantitativo
Teniendo en cuenta que el método se diseñó para el control de calidad de Ciprecu tabletas, fue necesario aplicar la metodología establecida para tomar la muestra requerida de la forma terminada para aplicar el procedimiento descrito con anterioridad. Para ello se procedió a:
1. Tomar una muestra representativa del lote.´
2. Pesar las tabletas individualmente (balanza analítica SARTORIUS. CP224S. Alemania) y calcular el peso promedio.
3. Triturar con mortero y pistilo las tabletas hasta obtener un polvo homogéneo y finamente dividido.
4. Pesar la cantidad de polvo (X) equivalente a 10 mg de ciprofloxacina base, teniendo en cuenta la siguiente expresión:
![]()
donde:
Pp: peso promedio de las tabletas.
VALIDACIÓN DEL MÉTODO PARA CONTROL DE CALIDAD
El método espectrofotométrico se validó según los parámetros exigidos para la categoría I5,10 que incluye las técnicas destinadas a determinar % de pureza en materias primas y cuantificar principios activos en las formas terminadas. Los parámetros analizados fueron:
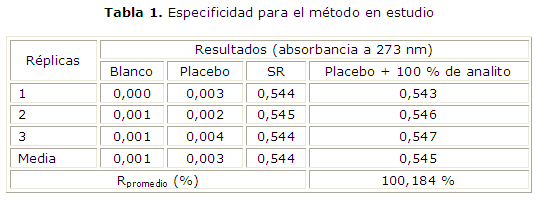
Especificidad: se evaluaron por triplicado placebos del producto, SR y blanco. Se procesaron por triplicado placebos del producto mediante el método propuesto y se compararon los resultados obtenidos con los resultantes del análisis de placebos cargados con clorhidrato de ciprofloxacina en cantidades equivalentes al 100 %. La respuesta obtenida fue la absorbancia (Abs) a 273 nm y el espectro de absorción UV de 200-400 nm.
Se determinó la posible interferencia de los componentes de la matriz a través de la comparación entre la respuesta obtenida por triplicado para el placebo, el blanco y la SR de clorhidrato de ciprofloxacina a la concentración equivalente al 100 % respectivamente. Se calculó la respuesta media para cada matriz y el recobrado medio total.
Criterio de aceptación: Ninguno de los componentes de la formulación debe dar respuesta cuantificable como interferencia en el método en estudio. El método debe ser específico frente a los excipientes, es decir, no deben aparecer señales analíticas para el placebo a la longitud de onda (273 nm) de interés analítico para el clorhidrato de ciprofloxacina.
Linealidad del sistema: se analizaron cinco concentraciones de clorhidrato de ciprofloxacina monohidrato por triplicado, en un rango de concentración de 80-120 % de la cantidad teórica declarada como 100 %.
Linealidad del método: se analizaron cinco concentraciones de clorhidrato de ciprofloxacina monohidrato por triplicado, en un rango de 50-150 % de la cantidad teórica declarada como 100 %. Se prepararon placebos de cada producto, los cuales se cargaron con las alícuotas correspondientes de dicha sustancia.
En ambos casos se construyó una curva de calibración de respuesta analítica (Y) vs. concentración teórica expresada en % (X). Los resultados se procesaron estadísticamente a través del programa STATGRAPHICS versión 5.1 (opción regresión lineal múltiple) y se determinó: r (coeficiente de correlación lineal), r2 (coeficiente de determinación), a (intercepto) y b (pendiente), para el 99 % de confianza. Además se calcularon los factores de respuesta (ƒ), el valor medio y el coeficiente de variación de los factores respuesta (CVf).
Criterios de aceptación:
- Ecuación de la recta: y= bx + a
- r³ 0,99
- r2³ 0,98
- Prueba de proporcionalidad del método analítico o hipótesis nula de la ordenada en el origen a= 0.
- Se empleó la prueba estadística t de Student para n-2 grados de libertad, siendo n el número total de valores donde: texp< ttab
- Prueba de la hipótesis nula de la pendiente: b= 0. Se determinó a partir de una prueba ANOVA de la regresión, o mejor, la probabilidad asociada al valor de la pendiente, es decir, si la p<< 0,05; el valor de "b" difiere significativamente de cero.
- El coeficiente de variación de los factores de respuesta (CVf) debe ser menor que 5 %.
Exactitud: se construyeron las curvas de recuperación de % recuperado (Y) vs. % teórico (X) de los puntos equivalentes al 50, 100 y 150 % analizando por triplicado placebos cargados por el método propuesto. Los resultados fueron procesados estadísticamente de igual forma que la curva de calibración de la linealidad del método y del sistema. Además se calcularon los % de recobro (R), el recobrado medio (![]() ) y el coeficiente de variación total (CVtotal).
) y el coeficiente de variación total (CVtotal).
Criterios de aceptación:
: 97-103 %.
CV£ 3,0 %.
Además, se realizó la prueba de Cochran, para determinar si el factor concentración tuvo alguna influencia en los resultados. El valor de G exp se comparó con el de Gtab (a= 0,05; k= 3; n= 3).
donde:
k: grupos experimentales
n: determinaciones por grupo
Si Gexp< Gtab las varianzas de las tres concentraciones son equivalentes, o lo que es igual, el factor concentración no influye en la variabilidad de los resultados.
Por último se aplicó la prueba t de Student para demostrar que no existen diferencias significativas entre el valor medio de recobro obtenido y el 100 %.
Precisión: incluyó la evaluación de la repetibilidad, la precisión intermedia
- Repetibilidad: Para la repetibilidad se evaluaron por triplicado placebos cargados con la concentración equivalente al 100 % y un valor bajo y otro alto comprendido dentro del rango de la linealidad del método. Se calculó el CV en estos tres niveles de concentración y se comparó con el criterio establecido. Las determinaciones las realizó el mismo analista con las mismas condiciones de trabajo.
Criterio de aceptación: CV£ 3,0 %.
- Precisión intermedia: participaron dos analistas, en dos días diferentes, en el mismo laboratorio. Se analizaron por triplicado en cada caso muestras equivalentes al 100 % del analito. Se calculó el CV total.
Criterio de aceptación: CV< 3,0 %.
Adicionalmente se realizaron otras pruebas para evaluar la influencia del analista y el día en los resultados analíticos, las cuales fueron:
- Prueba F de Snedecor: Se utilizó para determinar si existían diferencias significativas entre los resultados de los analistas que emplearon el mismo método y entre los días en que se realizaron los análisis. Se calculó el valor de Fexp y se comparó con Ftab para a= 0,05; F1= n-1 grados de libertad del numerador y F2= n-1 grados de libertad del denominador. Si Fexp< Ftab no existen diferencias significativas entre la precisión alcanzada por los analistas, en dos días de trabajo.
- Prueba t de Student: Se utilizó para comprobar si los valores obtenidos entre los analistas, que emplearon igual método y los dos días en que realizaron los análisis eran homogéneos, para el nivel de significación a= 0,05 y los grados de libertad seleccionados ƒ= (n1 + n2) - 2.
El valor de texp se comparó con el valor de la ttab para a= 0,05 y ƒ= (n1 + n2) - 2.
Rango: se estableció el intervalo en que se cumplieron satisfactoriamente los criterios de linealidad, exactitud y precisión.
APLICACIÓN DEL MÉTODO AL CONTROL DE CALIDAD DEL CLORHIDRATO DE CIPROFLOXACINA EN TABLETAS CIPRECU. COMPARACIÓN CON EL MÉTODO OFICIAL (USP 33, 2010)
Una vez culminada la validación del método se procedió a su aplicación al control de calidad de muestras representativas de un lote de tabletas Ciprecu. Los análisis se realizaron por triplicado y los resultados se compararon con los obtenidos al aplicar el método informado para el análisis de tabletas en la USP 33, 2010.5 Este último estudio se realizó a una muestra representativa del mismo lote de tabletas Ciprecu en el laboratorio GM, Guayaquil, Ecuador. Se realizó la comparación por análisis de varianza de clasificación doble, empleando el programa ANOVA del software STATGRAPHICS Plus 5.1, para un 95 % de confianza.
RESULTADOS
La concentración prefijada en el procedimiento propuesto como 100 % fue de 5 mg/mL en correspondencia con la adecuada proporción ingrediente farmacéutico activo (IFA)-excipiente en la formulación de tabletas que contiene clorhidrato de ciprofloxacina monohidrato y la respuesta medida. En esta concentración de analito los valores de absorbancia estuvieron próximos a 0,5.
El espectro UV del clorhidrato de ciprofloxacina monohidrato SR, en ácido clorhídrico 0,1 mol/L, se muestra en la figura 1. Se obtuvo solo un máximo de absorción, a la lmáxima= 273 nm, por lo que se seleccionó este valor de l para la cuantificación.
Una vez seleccionada la l de máxima absorción con la concentración de fármaco cuya absorbancia fue adecuada (concentración de 5 µg/mL con valores de absorbancia alrededor de 0,544), se procedió a establecer una metodología analítica muy sencilla que permitiera obtener una solución transparente a partir de la forma terminada.
RESULTADOS DE LA VALIDACIÓN DEL MÉTODO PARA CONTROL DE CALIDAD
El primer parámetro analizado durante la etapa de validación fue la especificidad. En la figura 1 se muestra el espectro UV del placebo tratado por el método propuesto. Como se observa, el placebo no absorbió a 273 nm, valor seleccionado como la l de máxima absorción para la cuantificación del clorhidrato de ciprofloxacina monohidrato. Además se observó total correspondencia entre el espectro UV de la SR y la respuesta del placebo cargado con 100 % de analito (Fig. 1).
Se obtuvieron resultados similares para blancos y placebos (tabla 1), lo cual significó que no existieron interferencias en la respuesta analítica debido a la presencia de los componentes de la matriz que se empleó en la formulación de tableta. Estos resultados demuestran la especificidad del método frente a los restantes componentes de la formulación.
Los resultados de la linealidad del método y del sistema, se muestran en la figura 2 (A y B). La linealidad en ambos casos fue satisfactoria, ya que se logró el cumplimiento de todos los criterios estadísticos establecidos para la regresión lineal aplicada (tabla 2).
Al realizar el procesamiento estadístico de los resultados de la exactitud, se comprobó el cumplimiento de todos los criterios de aceptación exigidos, tal como aparece en la tabla 2. La curva de recuperación correspondiente aparece en la figura 2 (C). El método fue exacto y no se afectó por errores sistemáticos de forma significativa.
Para la repetibilidad se estimó el CV para tres niveles de concentración: bajo, medio y alto. Se reportaron CV bajos, inferiores al 3,0 % establecido como límite (tabla 2).
La precisión intermedia también fue evaluada y dio resultados satisfactorios. Se obtuvieron CV acordes con el criterio de aceptación (CV£ 3,0 %). Se cumplieron satisfactoriamente las restantes pruebas aplicadas (tabla 2), por lo que los errores aleatorios no repercutieron en el método desarrollado.
El conjunto de resultados obtenidos permitió establecer como rango una concentración entre 2,5 y 7,5 µg/mL.
Los resultados de la aplicación del método espectrofotométrico evaluado y del oficial por CLAR,5 se muestran en la tabla 3. Los resultados fueron similares entre las muestras analizadas, sin dar diferencias significativas ni entre métodos, ni entre réplicas.
DISCUSIÓN
Se desarrolló un método espectrofotométrico directo, muy rápido y sencillo para el control de calidad del clorhidrato de ciprofloxacina en tabletas, ya que se contaba con el equipamiento necesario. Su aplicación se fundamenta por la presencia de grupos cromóforos en la estructura de este compuesto.
Se decidió aplicar un procedimiento directo, debido a que por la composición de la formulación de tabletas analizada (Ciprecu), no existen riesgos de interferencias por la presencia de otros componentes capaces de afectar los resultados analíticos (no presentan grupos cromóforos), siendo este el procedimiento más sencillo.
La concentración prefijada en el procedimiento propuesto como 100 % fue de 5 µg/mL, permitió obtener valores adecuados de absorbancia a 273 nm (absorbancia= 0,544), muy próximos al valor ideal para la cuantificación: 0,5. Además en esta lmáxima, no muestra absorción el disolvente empleado.
Para el tratamiento de la muestra previo al análisis se consideraron las características de la matriz en estudio, por lo que se propuso el procedimiento habitual correspondiente a las tabletas.4
El procesamiento estadístico de los datos de la linealidad del sistema y del método (tabla 2), presentó resultados satisfactorios, ya que las ecuaciones de regresión en los dos casos, tuvieron elevados coeficientes de correlación lineal y de determinación, el intercepto no fue diferente de cero y los CVf< 5 %. Estos resultados avalan la proporcionalidad existente entre la respuesta analítica y la concentración del analito en el rango analizado.10
Los coeficientes de recobrado medio quedaron dentro del límite permitido (97-103 %) y el CV total, fue inferior al 3,0 % establecido. Adicionalmente se evaluó la influencia de la concentración de analito en la varianza (S) de los resultados a través de la prueba de G de Cochran (tabla 2). Como la Gexp< Gtab, las varianzas de los tres niveles de concentración evaluados, fueron equivalentes. Es decir, no influyó el factor concentración en la exactitud del método. Por su parte, la prueba t de Student corroboró la exactitud, ya que no existieron diferencias estadísticamente significativas entre el recobrado medio y el 100 %.
En el estudio de la precisión, el análisis se complementó con las pruebas de F de Snedecor y t de Student. En ambos análisis la F exp< Ftab en el método estudiado, por lo que no existieron diferencias significativas entre las precisiones de los analistas, independientemente del día en que se efectuó el ensayo. Los valores de las texp resultaron menores que las ttab en cada caso, por lo que no existieron diferencias significativas entre los valores medios obtenidos por los analistas. El conjunto de los resultados permitió asegurar que estos fueran homogéneos y ratificaran la precisión del método en estudio.
En los intervalos utilizados se garantizó adecuada exactitud y precisión, pues los puntos extremos (50 y 150 %) fueron los seleccionados como niveles bajo y alto para las determinaciones realizadas en el caso de las tabletas.10
La aplicación de este método al control de calidad del clorhidrato de ciprofloxacina en las tabletas Ciprecu, fueron satisfactorios ya que se obtuvo una correcta dosificación y los contenidos de analito fueron similares a los obtenidos por el método oficial informado en la USP 33, 2010.5 No se obtuvieron diferencias estadísticamente significativas ni entre los métodos ni entre las réplicas (Fcal< F tab= 5,05), por lo que estos resultados reafirman y apoyan la validez del método por espectrofotometría UV para el objetivo propuesto en este trabajo.
El cumplimiento de las exigencias establecidas para la validación de la técnicas analítica propuesta, garantizó que el método fuera suficientemente específico, lineal, preciso y exacto para la cuantificación del clorhidrato de ciprofloxacina, por lo que se recomienda su aplicación solo para llevar a cabo el control de calidad de las tabletas recién elaboradas en el rango de 2,5 y 7,5 µg/mL, no siendo posible su aplicación a estudios de estabilidad química.
REFERENCIAS BIBLIOGRÁFICAS
1. Beltrán JL, Jiménez-Lozano E, Barrón D, Barbosa J. Determination of quinolone antimicrobial agents in strongly overlapped peaks from capillary electrophoresis using multivariate calibration methods. Analyt Chim Acta. 2004;501:137-41.
2. Ministerio de Salud Pública. Centro para el Desarrollo de la Farmacoepidemiología. Formulario Nacional de Medicamentos. Quinolonas, antisépticos y antiinfecciosos. La Habana: Ed. Ciencias Médicas; 2006. p. 135-6.
3. Mediavilla A, Flórez J. Enfermedades infecciosas. Farmacología humana. 3ra ed. Barcelona: Masson SA; 1997. p 1145, 1151.
4. British Pharmacopoeia. Medicinal and Pharmaceutical Substances. London: The Stationery Office; 2009.
5. The United Stated Pharmacopoeia 33 and National Formulary 28 (USP33-NF28). Washington: The United States Pharmacopeial Convention, Inc; 2010.
6. De Witte B, Dewulf J, Demeestere K, De Ruyck M, Van Langenhove H. Critical points in the analysis of ciprofloxacin by high-performance liquid chromatography. J Chromatogr A. 2007;1140:126-30.
7. Adhoum N, Monser L, Toumi M, Boujlel K, Pascual MI, Pérez G, et al. Solid-phase UV spectrophotometric method for determination of ciprofloxacin. Microchem J. 2004;77:79-84.
8. Suna J, Sakaia S, Tauchia Y, Deguchia Y, Chenb J, Zhangb R, et al. Determination of lipophilicity of two quinolone antibacterials, ciprofloxacin and grepafloxacin, in the protonation equilibrium. Eur J Pharmaceut Biopharmaceut. 2002;54:51-8.
9. Liua B, Wang DJ, Wang X, Liu BM, Kong YM, Hea LL, et al. Spectroscopic investigation on protein damage by ciprofloxacin under ultrasonic irradiation. Spectrochimica Acta. 78;2011:712-7.
10. Regulación 41. Validación de métodos analíticos. Centro para el Control Estatal de la Calidad de los Medicamentos (CECMED). Ministerio de Salud Pública. La Habana, Cuba. 2007.
Recibido: 4 de noviembre de 2013.
Aprobado: 20 de diciembre de 2013.
Yania Suárez Pérez. Instituto de Farmacia y Alimentos (IFAL). Ave 23 No. 21425 e/ 214 y 222, La Coronela, La Lisa. La Habana, Cuba. Correo electrónico: yaniasp@ifal.uh.cu