Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm vol.49 no.2 Ciudad de la Habana abr.-jun. 2015
ARTÍCULO ORIGINAL
Evaluación del efecto antitumoral del nimotuzumab combinado con radioquimioterapia en tumores de esófago
Evaluation of the antitumor effect of nimotuzumab combined with radiochemotherapy in treatment of esophageal tumors
MSc. Lilia Saborido Martín,I Dr. C. Jorge Luis Soriano García,II MSc. Sandra Álvarez Guerra,I MSc. Zoe González Hernández,I MSc. Ibis Riquelme AbreuI
I Centro Nacional Coordinador de Ensayos Clínicos. La Habana, Cuba.
II Hospital Hermanos Ameijeiras. La Habana, Cuba.
RESUMEN
Introducción: el cáncer de esófago en Cuba es una de las cinco primeras causas de muerte por tumores. El tratamiento incluye quimioterapia, radioterapia y cirugía, así como el descubrimiento de nuevos blancos potenciales para la inmunoterapia, entre los que se encuentra el receptor del Factor de Crecimiento Epidérmico. El anticuerpo monoclonal cubano AcM HR3 (nimotuzumab) se estudia actualmente a nivel mundial.
Objetivo: evaluar la eficacia y seguridad del nimotuzumab combinado con radioquimioterapia en tumores de esófago inoperable en comparación con el tratamiento habitual en los pacientes atendidos por esta enfermedad en el Hospital Hermanos Ameijeiras, durante los meses de diciembre de 2005 a junio 2010.
Método: se diseñó un estudio clínico controlado, aleatorizado, abierto con dos grupos de tratamiento, uno con Radioquimioterapia más Bioterapia y otro con Radioquimioterapia. La variable principal fue la respuesta clínica, con que clasifica la reducción del tumor, de acuerdo al criterio RECIST, en: remisión completa, remisión parcial, estabilización de la enfermedad y progresión. La toxicidad evaluó los eventos adversos que presentaron los pacientes en cada uno de los grupos de tratamiento.
Resultados: en relación a la respuesta objetiva se obtuvo una mayor proporción en el grupo de nimotuzumab (88,9 %) contra el grupo control (22,2 %), con una diferencia estadísticamente significativa entre ambos grupos de 66,7 %. Fueron frecuentes los eventos tos, insomnio, síntomas gastrointestinales y dolor retroesternal en el grupo tratado, mientras que en el grupo control las molestias gastrointestinales y la astenia fueron las de mayor aparición.
Conclusiones: los pacientes tratados con nimotuzumab presentaron un mejor índice de respuesta objetiva y de control de la enfermedad y su administración fue segura al combinarse con la terapia establecida para el tratamiento del cáncer de esófago inoperable según las normas terapéuticas cubanas.
Palabras clave: nimotuzumab, anticuerpo monoclonal HR3, receptor del factor de crecimiento epidérmico, cáncer de esófago inoperable.
ABSTRACT
Introduction: esophageal cancer in Cuba is one of the first five causes of death from tumors. The treatment includes chemotherapy, radiotherapy and surgery as well as the discovery of new potential targets for immunotherapy such as the epidermal growth factor receptor. The Cuban monoclonal antibody AcM HR3 (nimotuzumab) is studied at present internationally.
Objective: to evaluate the efficacy and safety of nimotuzumab combined with radiochemotherapy in inoperable esophageal tumors and to compare it with the ordinary treatment given to patients seen at "Hermanos Ameijeiras" hospital from December 2005 to June 2010.
Method: open, controlled, randomized clinical study was designed for two groups of patients, one with radiochemotherapy plus biotherapy and the other one with radiochemotherapy. The main variable was the clinical response with which the tumor reduction is classified in accordance with the RECIST criteria: complete remission, partial remission, disease stabilization and progression. Toxicity tests evaluated the adverse events that occurred in patients of each of the groups.
Results: regarding the objective response, a higher proportion was reached in the group with nimotuzumab (88,9 %) against the control group (22,2 %), with statistically significant difference between both groups of patients equal to 66,7 %. Cough, insomnia, gastrointestinal problems and retrosternal pain were frequent in the treatment group whereas the control group suffered gastrointestinal disturbances and asthenia more frequently.
Conclusions: the patients treated with nimotuzumab presented better index of objective response and of disease control and its administration was safe when combined with the set therapy for treatment of inoperable esophageal cancer in line with the Cuban therapeutic standards.
Keywords: nimotuzumab, monoclonal antibody HR3, epidermal growth factor receptor, inoperable esophageal cancer.
INTRODUCCIÓN
El cáncer es en la actualidad un problema grave de salud, la Organización Mundial de la Salud (OMS), plantea que su incidencia podría aumentar en un 50 % para el año 2020, en el que se pronostican 15 millones de casos nuevos. La neoplasia de esófago es una de las más agresivas debido a que en la mayoría de los casos los pacientes concurren a la consulta en un estadío avanzado de la enfermedad.1 Es el noveno tipo de cáncer más frecuente en el mundo y el quinto en los países desarrollados; su incidencia se ha incrementado, junto con los cambios en el tipo y la localización del tumor primario.2 En el momento del diagnóstico, en dos de cada tres pacientes se detecta un tumor inoperable debido a comorbilidades o a la extensión del tumor.3,4
Esta localización posee una elevada mortalidad entre los pacientes con tumores sólidos. En los Estados Unidos en el año 2005, cerca de 14 520 casos fueron diagnosticados y 13 570 muertes fueron atribuidas a esta enfermedad, 10 530 de ellas reportadas en hombres, representado el 4 % del total de muertes relacionadas con cáncer en la población masculina.5 En 2011 se reportaron 16 980 nuevos casos y 14 700 defunciones.6
El Anuario Estadístico cubano, en 2013 reportó una mortalidad por cáncer de esófago de 614 muertes correspondientes al sexo masculino, para una tasa de 11 × 100 000 hombres y de 144 muertes del sexo femenino, para una tasa de 2,6 × por 100 000 mujeres; siendo la razón de tasas por sexo de 4,3.7
Los factores asociados al cáncer de esófago varian entre los países, los más importantes son el alcohol, el tabaquismo, el déficit nutricional de vitaminas C, A y hierro, la obesidad, la depresión inmunitaria, las afecciones esofágicas (acalasia), el llamado esófago de Barret, la estenosis benigna, el divertículo, la ingestión de cáusticos, los defectos congénitos (tilosis) y otros malos hábitos como la ingestión de bebidas muy calientes o muy frías.8,9 Según reportes de Lagergren J y cols, existen indicios de que el reflujo gastroesofágico sintomático es un factor de riesgo para el adenocarcinoma, así como la frecuencia y severidad de los síntomas.10
El esófago se caracteriza por poseer una rica red de capilares linfáticos que recorre todo el órgano, en sentido longitudinal, muy conectados con los de la mucosa faríngea y gástrica. Las distintas regiones del mismo se relacionan unas con otras por estas vías y esto explica el por qué los tumores se pueden diseminar a cualquier otra región o metastizar a la red ganglionar, incluyendo los ganglios supraclaviculares o los cervicales. En su diseminación a distancia, metastiza al hígado, los pulmones, la pleura, el estómago, las suprarrenales, el cerebro y los huesos.1
Con el transcurso de los años, las estrategias de tratamiento han sido más agresivas e incluyen la quimioterapia (QT), la radioterapia (RT) y la cirugía, siendo la resección quirúrgica posible en solo el 15-20 % de los pacientes. La supervivencia de los pacientes a los 5 años es menor del 20.9,10 Reportes en la literatura de algunos autores señalan una supervivencia a 5 años de 34-50 % de los pacientes tratados solo con cirugía.11-13 Teniendo en cuenta el estadio de la enfermedad, se reportan en el estadío I (T1N0) un 84 %, en el IIA (T2-T3N0) un 49 %, en el IIB (T1-T2N1) un 27 % y en el III (T3-T4N1) un 17 %.14,15
La combinación de la QT y RT neoadyuvantes reporta ventajas ya que la QT es sistémica y puede alcanzar metástasis que queden fuera del campo de radiación y la eficacia local de la RT puede ser incrementada por un efecto de radiosensibilización. El beneficio de la QT concomitante, se traduce en reducción del tamaño tumoral, por lo que se afirma que esta combinación puede aumentar el control de la enfermedad local o diseminada.16
El desarrollo que alcanza el conocimiento de la biología celular y molecular del cáncer posibilita el descubrimiento de blancos potenciales para la inmunoterapia de numerosos tumores entre los que se encuentra el receptor del Factor de Crecimiento Epidérmico (EGFR por sus siglas en inglés). El anticuerpo monoclonal (AcM) nimotuzumab es uno de los cuatro anticuerpos antagonistas del EGFR que se evalúan, a nivel mundial, en ensayos clínicos,17,18 es un anticuerpo humanizado bloqueador del receptor del Factor de Crecimiento Epidérmico, producido en el Centro de Inmunología Molecular (CIM) en Cuba. Hasta la fecha se ha evaluado en ensayos clínicos terapéuticos para pacientes con cáncer avanzado de cabeza y cuello,19-21 gliomas de alto grado de malignidad,22-24 cáncer de esófago,25 cáncer de páncreas,26 cáncer cérvicouterino y cáncer de pulmón.27
Este estudio se ejecuta en el servicio de Oncología Clínica del Hospital Hermanos Ameijeiras (HHA) con el objetivo de evaluar la eficacia y la seguridad del anticuerpo monoclonal humanizado nimotuzumab, en combinación con radioquimioterapia en pacientes portadores de tumores malignos de esófago de origen epitelial (adenocarcinomas y carcinomas epidermoides) no operables, respecto a la respuesta obtenida en pacientes con similares condiciones clínicas que solo reciben radioquimioterapia denominándolos grupo control.
Se diseñó un estudio clínico controlado, aleatorizado, abierto con dos grupos de tratamiento, uno con Radioquimioterapia más Bioterapia (nimotuzumab/Grupo I) y otro con Radioquimioterapia (control/Grupo II) durante los meses de diciembre de 2005 a junio de 2010 en el HHA.
En ambos grupos la quimioterapia indicada fue: Cisplatino (CDDP)= 75 mg/m² y 5 fluoruaracilo (5FU)= 750 mg/m² durante cuatro ciclos, en ambos casos. En el Grupo I o de estudio se incorporó a esta terapia nimotuzumab= 200 mg semanales por 6 semanas.
El universo de estudio lo constituyen todos los pacientes, de ambos sexos, con diagnóstico citohistológico de cáncer de esófago inoperable evaluados en el servicio de Oncología Clínica del Hospital Hermanos Ameijeiras. La muestra se conformó por 18 pacientes (9 tratados con el nimotuzumab y 9 controles).
Se permitió el uso de cualquier tipo de tratamiento de soporte que se requirió para el bienestar de las pacientes.
La aleatorización de los pacientes se realizó de forma centralizada en el Centro Nacional Coordinador de Ensayos Clínicos mediante una lista simple de números aleatorios, generada en un ordenador. No se utilizaron estratos.
EXÁMENES Y EVALUACIONES
El examen físico de los pacientes fue realizado por el especalista a cargo del estudio dentro de los siete días previos al inicio de la terapia establecida, los análisis de laboratorio se realizaron 14 días previos a la inclusión del paciente en la investigación, mientras que las evaluaciones imagenológicas se realizaron dentro de las cuatro semanas previas al inicio del tratamiento. Los requerimientos para las evaluaciones y el informe de las valoraciones radiológicas se realizarán según el método de Criterios para la Evaluación de la Respuesta en Tumores Sólidos (RECIST, por sus siglas en inglés).
ANÁLISIS Y PRUEBAS ESTADÍSTICAS A REALIZAR
Las variables generales relacionadas con las características particulares del paciente que se valoran fueron: sexo, color de la piel, edad, estado funcional según el Grupo Coperativo de Oncología del Este (ECOG, por sus siglas en inglés), estadio y tipo histológico. A estas se les realizó distribución y gráfico de frecuencias absolutas y relativas (Pie), Chi-Cuadrado y estadígrafos descriptivos (media, desviación estándar, mínimo o máximo) por grupo, gráficos boxplots y t-test.
La respuesta antitumoral fue evaluada según el criterio principal de respuesta de Respuesta Objetiva. Se estimaron las proporciones de pacientes con respuesta objetiva (respuesta total + parcial) en cada grupo de tratamiento y la diferencia entre los grupos. Se calculó el intervalo de confianza al 95 % para la diferencia. Se compararon las proporciones mediante la prueba binomial o la prueba exacta de Fisher y el criterio secundario de evaluación de la respuesta considerado fue Control de la Enfermedad. En este caso se incluyó la estabilización de la enfermedad en el criterio de éxito y se realiza análisis igual al descrito.
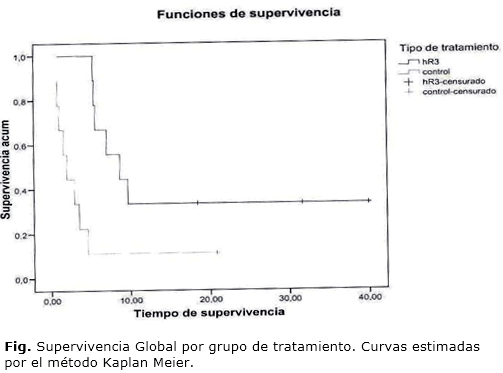
Se calculó la Supervivencia Global como variable secundaria relacionada con la respuesta clínica para ello se calcularon los tiempos de sobrevida en cada grupo de tratamiento. Las curvas de supervivencia global fueron estimadas por el método de Kaplan Meier. Se estimó la mediana y las medias por grupo de tratamiento y se aplicó el test de Log-Rank para la comparación de las curvas de supervivencia global.
ANÁLISIS DE LOS EVENTOS ADVERSOS
Para el análisis de la toxicidad se evaluaron los eventos adversos que presentaron los pacientes en cada uno de los grupos de tratamiento y en cada una de las administraciones del AcM nimotuzumab.
Los eventos adversos se registraron por paciente y se calcularon las razones de riesgo de desarrollar eventos adversos en un grupo de tratamiento con respecto a otro. Además se tomaron los tiempos de inicio de los eventos adversos para su comparación. La intensidad fue reportada según los Criterios de Terminología Común para Eventos Adversos, versión 4.0 (CTCAE, por sus siglas en inglés).28
Desde el punto de vista ético, la investigación se diseñó y se ejecutó según los principios éticos para la investigación médica con sujetos humanos, establecidos en la actualización de la Declaración de Helsinki en la WMA General Assembly, Edimburgo, Escocia, octubre 2000.
Se obtuvo el consentimiento informado por escrito de todos los pacientes previo a su inclusión en la investigación, así como la aprobación del Centro de Inmunología Molecular (centro promotor) y el Comité de ética de la Institución donde se realizó el estudio.
Por ser este estudio parte de un ensayo clínico multicentrico se añade la fecha de introducción y actualización en el Registro Público de Ensayos Clínicos (RPEC) cubano; el Código es RPCEC00000014, inscripto el 21 de diciembre de 2007 y actualizado el 27 de octubre de 2010.
RESULTADOS
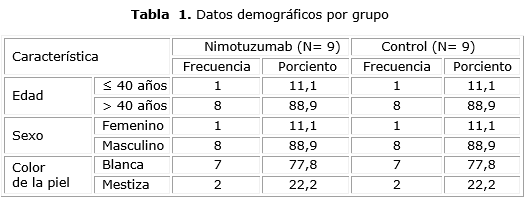
Se aprecia que existe similitud en las variables demográficas entre los que recibieron nimotuzumab y el grupo control en cuanto a sexo y color de la piel, predominando los pacientes del sexo masculino, y el color blanco de la piel (8 y 7 respectivamente), así como los mayores de 40 años, con 8 en cada grupo (tabla 1).
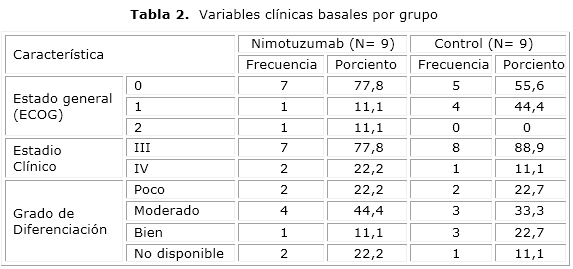
En cuanto a la distribución de pacientes según las variables clínicas iniciales no se describieron diferencias entre los grupos aunque hubo un predominio del estado funcional general entre 0 y 1 en los dos casos. El mayor número de pacientes (15 pacientes) tanto para el nimotuzumab como para el control fue diagnosticado en el estadio clínico III. En la tabla 2 se relaciona el grado de diferenciación, se observa homogeneidad entre los dos grupos, excepto en los tumores bien diferenciados que se presentó una mayor proporción en el grupo control con 3 pacientes contra un paciente en el grupo tratado con el fármaco en estudio.
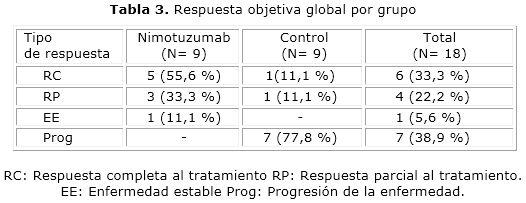
Cuando se analiza la respuesta al tratamiento obtuvimos un porciento de respuesta completa superior en el brazo del nimotuzumab en comparación con el grupo control (55,6 % vs 11,1 %). La progresión de la enfermedad en el brazo control fue superior donde hubo un 77,8 % de progresores. En relación a la respuesta objetiva alcanzada por los pacientes se obtuvo una mayor proporción en el grupo de nimotuzumab (88,9 %) contra el grupo control (22,2 %), obteniéndose una diferencia estadísticamente significativa entre ambos grupos, en los niveles de respuesta objetiva de 66,7 %. De acuerdo al análisis del control de la enfermedad que consiste en la suma de la Respuesta completa, la Respuesta parcial y la Estabilización de la enfermedad (RC+RP+EE) se obtuvo que en el grupo de tratamiento con nimotuzumab en todos los pacientes se observó control de la enfermedad 9/9 (100 %), mientras se mantuvo la misma proporción en el grupo control 2/9 (22,2 %), donde progresaron 7 pacientes lo que hizo que aumentara la diferencia observada entre los tratamientos a 77, 8 % siendo estadísticamente significativa, por tanto se obtiene que la respuesta es en al menos 30,2 % superior cuando reciben nimotuzumab que cuando reciben el tratamiento estándar (tabla 3).
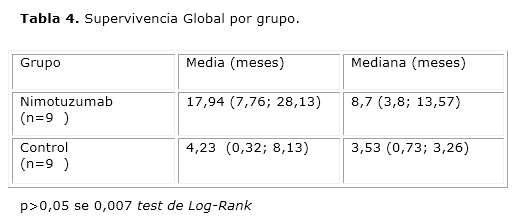
Al analizar la supervivencia alcanzada para los dos grupos de tratamiento (tabla 4), se observa que los pacientes tratados con nimotuzumab obtienen una mediana de sobrevida de 8,7 meses mientras que en el grupo control solo alcanzan 3,5 meses (p≤ 0,007), lo que se muestra en la figura.
Las toxicidades aparecen en la tabla 5 donde los eventos adversos mas descritos fueron tos, insomnio, síntomas gastrointestinales y dolor retroesternal en el grupo de nimotuzumab, mientras que en el grupo control hubo un predominio de molestias gastrointeinales y de astenia.
Tabla 5. Eventos adversos más frecuentes por grupo
| Toxicidades más frecuentes | Nimotuzumab | Control | Total |
| Tos | 5 (11,1) | 1 (2,1) | 6 (6,4) |
| Insomnio | 4 (8,9) | 0 | 4 (4,3) |
| Náuseas | 4 (8,9) | 7 (14,6) | 11 (11,8) |
| Diarrea | 4 (8,9) | 3 (6,3) | 7 (7,5) |
| Dolor retroesternal | 4 (8,9) | 0 | 4 (4,3) |
| Vómitos | 2 (4,4) | 4 (8,3) | 6 (6,4) |
| Fiebre | 2 (4,4) | 2 (4,2) | 4 (4,3) |
| Hipotensión | 2 (4,4) | 1 (2,1) | 3 (3,2) |
| Fístula traqueoesofágica | 2 (4,4) | 0 | 2 (2,1) |
| Dolor articular generalizado | 2 (4,4) | 0 | 2 (2,1) |
| Acidez gástrica | 2 (4,4) | 0 | 2 (2,1) |
| Astenia | 1 (2,2) | 5 (10,4) | 6 (6,4) |
| Dolor abdominal | 1 (2,2) | 2 (4,2) | 3 (3,2) |
| Ictus isquémico | 1 (2,2) | 1 (2,1) | 2 (2,1) |
| Ansiedad | 1 (2,2) | 1 (2,1) | 2 (2,1) |
| Sepsis | 1 (2,2) | 1 (2,1) | 2 (2,1) |
| Leucopenia | 1 (2,2) | 1 (2,1) | 2 (2,1) |
| Diabetes Mellitus | 1 (2,2) | 0 | 1 (1,1) |
| Fallo multiorgánico | 1 (2,2) | 0 | 1 (1,1) |
| Mucosa bucal seca | 1 (2,2) | 0 | 1 (1,1) |
| Pérdida de peso | 1 (2,2) | 0 | 1 (1,1) |
| Sequedad bucal | 1 (2,2) | 0 | 1 (1,1) |
| Infarto Miocardio | 1 (2,2) | 0 | 1 (1,1) |
| Muerte | 0 | 3 (6,3) | 4 (4,3) |
| Anorexia | 0 | 3 (6,3) | 3 (3,2) |
| Radiodermitis | 0 | 1 (2,1) | 1 (1,1) |
| Mareos | 0 | 1 (2,1) | 1 (1,1) |
| Absceso de la herida (sepsis) | 0 | 1 (2,1) | 1 (1,1) |
| Dolor y ardor | 0 | 1 (2,1) | 1 (1,1) |
| Calambres en MI | 0 | 1 (2,1) | 1 (1,1) |
| Expectoración | 0 | 1 (2,1) | 1 (1,1) |
| Constipación | 0 | 1 (2,1) | 1 (1,1) |
| Dolor hombro izquierdo | 0 | 1 (2,1) | 1 (1,1) |
| Peritonitis fibrinopurulenta | 0 | 1 (2,1) | 1 (1,1) |
| Retención urinaria | 0 | 1 (2,1) | 1 (1,1) |
| Deshidratación | 0 | 1 (2,1) | 1 (1,1) |
| Dolor torácico | 0 | 1 (2,1) | 1 (1,1) |
| Mucositis | 0 | 1 (2,1) | 1 (1,1) |
| Total | 45 (48,4) | 48 (51,6) | 93 (100) |
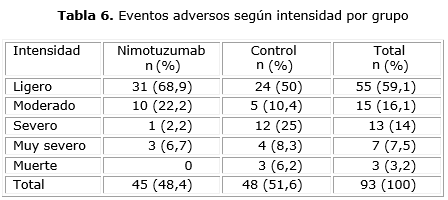
Los eventos adversos en el grupo tratado con nimotuzumab fueron clasificados según intensidad: 31 como ligeros, 10 como moderados, uno severo (fístula traqueoesofágica) y 4 como muy severos, infarto agudo de miocardio (IMA), fallo multiorgánico, que conllevó a la muerte y dolor retroesternal, mientras que en el grupo control se comportaron como ligeros 24, moderados 5, severos 12 (mucositis, diarrea, calambres en miembros inferiores, astenia en dos pacientes, anorexia en dos pacientes, dolor abdominal, constipación, retención urinaria, hipotensión y peritonitis fibrinopurulenta) y siete como muy severos (leucopenia, sepsis, deshidratación, ictus isquémico y tres muertes) (tabla 6).
Al analizar por su seriedad el total de eventos adversos presentados en los pacientes del grupo nimotuzumab, cuatro fueron clasificados como serios, un infarto agudo del miocardio presentado en un paciente, que estuvo relacionado con la radioterapia y fue reversible, una sepsis que conllevó a fallo multiorgánico y la muerte relacionada con el evento adverso para ese paciente, y un ictus isquémico en otro paciente. En el grupo control se clasificaron de esta forma cuatro eventos adversos, radiodermitis relacionada con la radioterapia en un paciente y tres muertes de las cuales no se pudo constatar la causa directa del fallecimiento ya que se refiere en las historias clínicas de los pacientes por los médicos que fueron debidas a la enfermedad oncológica que padecían.
Cabe señalar que la muerte que ocurrió en el grupo nimotuzumab a pesar de constituir un evento adverso serio no estuvo relacionada con el anticuerpo pues se debió a una sepsis presentada por el paciente que deterioró su condición y conllevó al fallecimiento lo que quedó constatado en la necropsia realizada y reflejado en la historia clínica.
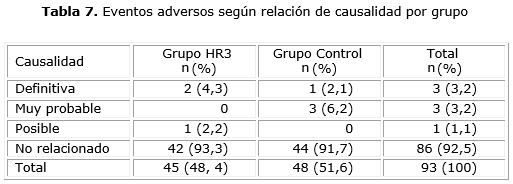
Al referirnos a la relación de causalidad se encontró que del total de eventos adversos presentados en el grupo nimotuzumab ninguno se realciona con el producto y si con la quimioterapia (fluorouracilo), con relación causal definitiva en el caso de los vómitos y las diarreas en un paciente y con una causalidad posible del insomnio con la enfermedad oncológica en otro paciente. Para el grupo control la relación de causalidad estuvo dada por la quimioterapia y los eventos adversos (EA) con relación muy probable fueron en un paciente vómitos y náuseas asociadas al fluorouracilo y en un paciente vómitos provocados por el cisplatino y con relación definitiva la radiodermitis asociada a la radioterapia, también en un paciente (tabla 7).
En cuanto al perfil de seguridad, en la muestra analizada se presentó globalmente una toxicidad muy baja con un 89,1 % de eventos clasificados como ligeros y moderados para el nimotuzumab y 63 % para el grupo control y un 8,9 % vs. 33,3 % de severos y muy severos respectivamente. De ellos ninguno estuvo relacionado con la aplicación del anticuerpo y si con la quimiradioterapia, la radioterapia y el cáncer de esófago de los pacientes.
En el estudio fueron mas frecuentes la tos, insomnio, síntomas gastrointestinales y dolor retroesternal en el grupo de nimotuzumab mientras que en el grupo control hubo un predominio de molestias gastrointeinales y de astenia, en ambos casos debidas a la quimioradioterapia y la radioterapia tal como se esperaba y a la enfermedad en cuestión. Los eventos adversos serios no estuvieron relacionados con la administración del anticuerpo.
DISCUSIÓN
Los elementos que fundamentan el diseño de esta investigación (tratamiento de QT-RT+ nimotuzumab), son los estudios previos realizados en tumores de esófago, donde se evidencia la expresión en el 90 % de estos de la proteína HER1 y la presencia del receptor. El esquema de quimioterapia empleado está justificado en varios estudios que evidencian la superioridad de la combinación de cisplatino+fluorouracilo vs fluorouracilo+fluorouracilo, con tasas de respuesta de 35 % vs. 19 %.29,30
Aproximadamente el 90 % de los pacientes fueron mayores de 40 años para los dos brazos, pertencientes al sexo masculino y de color blanco de la piel, lo que coincide con lo planteado por Andre y colaboradores para esta patología en la cual en el 2005 cerca de 14 520 casos fueron diagnosticados y 13 570 muertes fueron atribuidas a esta enfermedad, 10 530 de ellas reportadas en hombres.5
Lorenzen S y colaboradores reportan resultados de un ensayo clínico fase II en el cual 62 pacientes con carcinoma de células escamosas de esófago avanzado recibieron 6 ciclos de CDDP (100 mg/m2) el día 1 y 5—FU (1000 mg/m2, días 1-5, solo o en combinación con cetuximab (400 mg/m2 como dosis inicial y 250 mg/m2 semanalmente). Teniendo en cuenta que 32 pacientes se trataron con la combinación y 30 solo con los citostáticos, la respuesta objetiva de acuerdo a criterios del RECIST fue de 19 y 13 %, y se evidenció control de la enfermedad en el 75 % y 57 %, respectivamente. Considerando una mediana de seguimiento de 21,5 meses, la mediana del tiempo de supervivencia libre de progresión fue de 5,9 y 3,6 meses, y la mediana del tiempo de supervivencia global fue de 9,5 y 5,5 meses, respectivamente. El cetuximab resultó seguro combinado con CDDP+ 5-FU e incrementó la eficacia de la quimioterapia estándar. No se identificaron en 37 muestras evaluadas la mutación del K‒ras (codón 12/13).31
En los estudios de Bedenne L y cols y Stahl M y cols, no se evidencia diferencia estadísticamente significativa entre los grupos de QT—RT y de QT—RT—Cirugía, y se enfatiza la necesidad de una respuesta clínica a la inducción de la QT—RT como un factor pronóstico independiente para una sobrevida más duradera.32-34 No existen diferencias significativas entre las altas y bajas dosis de radiaciones ionizantes cuando se combina a QT, aunque las primeras si pueden producir un incremento de la toxicidad.35-38
Un metanálisis demuestra que la combinación concurrente de la QT—RT es superior a la RT sola en pacientes con carcinoma epidermoide inoperable, no metastásico, y es superior a la administración secuencial de éstos.39 El no control local constituye un factor pronóstico de recaída en el orden del 35-50 %, por tanto, la estadificación y el seguimiento evolutivo de los ganglios linfáticos regionales asume una importancia crucial.40
Las reacciones adversas que aparecieron con mayor frecuencia en los ensayos precedentes con el anticuerpo murino ior® egf/r3 fueron fiebre, vómitos, cefalea y dolores óseos, broncoespasmo y shock anafiláctico.41
Estudios terapéuticos actualmente en ejecución, con el AcM nimotuzumab no se han reprotado eventos adversos muy severos relacionados con su aplicación. Las reacciones adversas ligeras y moderadas que refieren los pacientes son escalofríos, fiebre, cefalea, hipotensión, temblores, desorientación en tiempo y espacio, lenguaje incoherente, disfasia motora y mialgias.
En el estudio fase II/III (N= 88 pacientes) realizado en Cuba, controlado, aleatorizado y doble ciegas, incluyó 33 pacientes con astrocitoma anaplásico (AA) y 55 con glioblastoma multiforme (GBM). Los pacientes recibieron la radioterapia convencional en combinación con nimotuzumab o placebo. El tratamiento fue bien tolerado, no se reportaron eventos adversos serios relacionados con el tratamiento. Los eventos adversos más frecuentes relacionados con la administración del AcM hR3 fueron cefalea, escalofríos, fiebre, náuseas, temblores y elevación de la fosfatasa alcalina, las transaminasas tanto la TGP como la TGO. Todos estos eventos adversos fueron de intensidad grado 1 o 2 según la CTCAE versión 03.42
En el estudio clínico fase II, exploratorio, multicéntrico, abierto, controlado y aleatorizado conducido en Cuba con el objetivo de evaluar la eficacia y seguridad al administrar el nimotuzumab en combinación con la radioterapia holocraneal en pacientes avanzados de cáncer de pulmón de células no pequeñas (CPCNP) con metástasis cerebrales, se incluyeron 15 pacientes tratados con nimotuzumab + radioterapia holocraneal y otro grupo de 15 pacientes tratados con radioterapia holocraneal sola. El tratamiento combinado del AcM hR3 y radioterapia fue bien tolerado. No se reportaron eventos adversos severos, ni serios relacionados con el tratamiento. Los eventos adversos más frecuentes reportados con la administración de la terapia combinada de nimotuzumab y RT fueron: cefalea, astenia y disnea. No se constató exacerbación de la toxicidad a la terapia radiante paliativa holocraneal con la adición del anticuerpo monoclonal. En dos pacientes del grupo que recibió la terapia combinada, se detectaron 5 eventos adversos serios no relacionados con el AcM hR3, consistentes en un segundo tumor, fractura intertrocantérica derecha, diplopía, edema cerebral y radiodermitis húmeda.43
En un ensayo clínico fase I/II desarrollado en el Hospital Hermanos Ameijeiras de Cuba, en pacientes con tumores de mama localmente avanzado, se combinó la administración del nimotuzumab con la terapia neoadyuvante (adriamicina˗ciclofosfamida) con el objetivo de demostrar la seguridad, medir la farmacocinetica de la combinación de este anticuerpo con la quimioterapia además de evaluar la eficacia del tratamiento en tumores de mama que expresaban el receptor del factor de crecimiento epidérmico Se presentaron un total de 101 eventos adversos en los pacientes tratados. Los pacientes del primer nivel de dosis presentaron un total de 17 EA, del segundo 26, del tercero 40 y del cuarto 18 eventos adversos. La administración del AcM hR3 fue bien tolerada. No se detectaron eventos adversos graves relacionados con el tratamiento. Este estudio concluyó que no determinó la dosis máxima tolerable, pero en los estudios de farmacocinética la dosis de 200 mg aumentó el aclaramiento con un decrecimiento posterior en la de 400 mg, sin diferencias significativas, lo que apunta que la dosis óptima biológica se encuentra en 200 mg. La administración concomitante del AcM hR3 y la quimioterapia (adriamicina˗ciclofosfamida), a los niveles de dosis estudiados fue bien tolerada.44
En Alemania, un ensayo clínico fase I/II para evaluar la eficacia del nimotuzumab en gliomas de alto grado de malignidad en niños y adolescentes, durante el período de inducción se le indicó a los pacientes 150 mg/m² de nimotuzumab los días 1, 8, 15, 22, 29 y 36 en infusión IV por 30 minutos; y los que no progresaron recibieron igual dosis los días 57, 78, 99 y 120. Aunque el nimotuzumab fue bien tolerado, los desórdenes del sistema nervioso (SN) fueron los EA, más frecuentes (36,8 %), seguidos por las infecciones e infestaciones (21,1 %) y las reacciones en piel y tejido subcutáneo en el sitio de la administración (15,8 %); pocos EA ocurrieron en más de un paciente: pirexia, eritema, leucopenia y trombocitopenia en dos pacientes cada uno (10,5 %). Solo se consideraron EA relacionados con la administración del nimotuzumab, fatiga y rash cutáneo; el resto fue clasificado con relación causal posible.45
En un estudio46 que combina el cetuximab y la quimioterapia con paclitaxel y carboplatino y radiaciones ionizantes se observó un incremento de las reacciones dermatológicas (incluyendo un 25 % con grado 3), así como las reacciones de hipersensibilidad. El porcentaje de reacciones grado 3 (globalmente) en el referido estudio fue muy superior a lo reportado por otros autores.47,48
El objetivo de la comunidad oncológica cubana es convertir el cáncer en una enfermedad crónica que pueda controlarse por prolongados periodos, al retrasar o detener su progresión. Los anticuerpos y vacunas terapéuticas pueden usarse durante un tiempo prolongado, incluso más allá de la progresión de la enfermedad, además de en los pacientes envejecidos, normalmente no susceptibles de recibir los tratamientos convencionales más agresivos.
El estudio permite ampliar los conocimientos sobre las combinaciones cada vez más óptimas de este anticuerpo monoclonal con otras terapias oncoespecíficas ya que los pacientes tratados con nimotuzumab tienen un mejor índice de respuesta objetiva y de control de la enfermedad, en comparación al grupo control, resultó seguro en los pacientes particiantes del estudio cuando se aplicó el nimotuzumab en combinación a la terapia establecida en las normas terapéuticas cubanas de quimioradioterapia en el tratamiento del cáncer de esófago inoperable. Se debe continuar desarrollando estudios que permitan ampliar el conocimiento sobre el uso de la combinación del nimotuzumab y la quimioterapia utilizada en el país para el tratamiento del cáncer y realizar la farmacovigilancia del producto en las condiciones de la práctica médica habitual.
REFERENCIAS BIBLIOGRÁFICAS
2. Devesa SS, Blot WJ, Fraumeni JFJr. Changing patterns in the incidence of esophageal and gastric carcinoma in the United States. Cancer. 1998;83(10):2049-53.
3. Jemal A, Murray T, Ward E. Cancer statistics, 2005. CA Cancer J Clin. 2005;55:10-30.
4. Schneider Bryan J, Urba Susan G. Preoperative chemoradiation for the treatment of locoregional esophageal cancer. The standard of Care? Semin Radiat Oncol. 2006;17:45-52.
5. Andre T, Kotelevets L, Vaillant JC, Coudray AM, Weber L, Prevot S. Vegf, Vegf-B, Vegf-C and their receptors KDR, FLT-1 and FLT-4 during the neoplastic progression of human colonic mucosa. Int J Cancer. 2000;86(2):174-81.
6. Arteaga CL.The epidermal growth factor receptor: from mutant oncogene in nonhuman cancers to therapeutic target in human neoplasia. Semin Oncol. 2002;29(5 Suppl 14):3-9.
7. Oficina Nacional de Estadísticas e Información. Anuario Estadístico de Cuba, edición 2013. La Habana: OFN; 2013.
8. Alfonso L. Oncología preguntas y respuestas. Capítulo 12. Cánceres del tubo digestivo y glándulas anexas. Esófago, estómago, intestino delgado, colon, recto, ano, hígado y páncreas exocrino. Barcelona-Philadelphia: Editorial Prous Science; 2001. p. 331-74.
9. van Meerten E, van der Gaast A. Systemic treatment for oesophageal cancer. Eur J Cancer. 2005;41:664-72.
10. Mariette C, Piessen G, Triboulet JP. Therapeutic strategies in oesophageal carcinoma: role of surgery and other modalities. Lancet Oncol. 2007 June;8:545-53.
11. Hulscher JB, van Sandick JW, de Boer AG. Extended transthoracic resection compared with limited transhiatal resection for adenocarcinoma of the esophagus. N Engl J Med. 2002;347(21):1662-9.
12. Altorki N, Skinner D. Should en bloc esophagectomy be the standardof care for esophageal carcinoma? Ann Surg. 2001;234:581-7.
13. Mariette C, Taillier G, Van Seuningen I, Triboulet JP. Factors affecting postoperative course and survival after en bloc resectionfor esophageal carcinoma. Ann Thorac Surg. 2004;78:1177-83.
14. Mariette C. Surgery alone in the curative treatment of localised oesophagealcarcinoma. Eur J Surg Oncol. 2004;30:869-76.
15. Mariette C, Piessen G, Lamblin A, Mirabel X, Adenis A, Triboulet JP. Impact of preoperative radiochemotherapy on postoperativecourse and survival in patients with locally advanced squamous celloesophageal carcinoma. Br J Surg. 2006;93:1077-83.
16. Mariette C, Triboulet JP. Is preoperative chemoradiation eff ective in treatment of oesophageal carcinoma? Lancet Oncol. 2005;6:635-7.
17. Negri DR, Tosi E, Valota O, Ferrini S, Cambiaggi A, Sforzini S, et al. In vitro and in vivo stability and anti-tumour efficacy of an anti-EGFR/anti-CD3 F(ab')2 bispecific monoclonal antibody. Br J Cancer. 1995;72(4):928-33.
18. Wallace PK, Romet-Lemonne JL, Chokri M, Kasper LH, Fanger MW, Fadul CE. Production of macrophage-activated killer cells for targeting of glioblastoma cells with bispecific antibody to FcgammaRI and the epidermal growth factor receptor. Cancer Immunol Immunother. 2000;49(9):493-503.
19. Crombet T, Osorio M, Cruz T, Roca C, del Castillo R, Mon R, et al. Use of the humanized anti-epidermal growth factor receptor monoclonal antibody h-R3 in combination with radiotherapy in the treatment of locally advanced head and neck cancer patients. J Clin Oncol. 2004;22:1646-54.
20. Verduzco-Rodriguez L, Aguirre-Gonzalez EH, Verduzco-Aguirre HC. Durable complete response induced by paclitaxel-nimotuzumab-methotrexate chemotherapy in a patient with metastatic head and neck squamous cell carcinoma. Hematol Oncol Stem Cell Ther. 2011;4:182-4.
21. Basavaraj C, Sierra P, Shivu J, Melarkode R, Montero E, Nair P. Nimotuzumab with chemoradiation confers survival advantage in treatment naive head and neck tumors overexpressing EGFR. Cancer Biol Ther. 2010;10.
22. Ramos TC, Figueredo J, Catala M. Treatment of high-grade glioma patients with the humanized anti-epidermal growth factor receptor (EGFR) antibody h-R3: report from a phase I/II trial. Cancer Biol Ther. 2006;5:375-9.
23. Crombet T. Use the humanized anti-EGFR MAb (nimotuzumab) and radiotherapy for the treatment of high grade glioma patients European Journal of Cancer. 2008 suppl;6:168.
24. Crombet T, Cabanas R, Alert J. Nimotuzumab and radiotherapy in children and adolescents with brain stem glioma: preliminary results from a phase II study. Eur J Cancer Suppl. 2009:7.
25. Ramos-Suzarte M, Lorenzo-Luaces P, Lazo NG. Treatment of malignant, non-resectable, epithelial origin esophageal tumours with the humanized anti-epidermal growth factor antibody nimotuzumab combined with radiation therapy and chemotherapy. Cancer Biol Ther. 2012;13:600-5.
26. Strumberg D, Schultheis B, Scheulen ME. Phase II study of nimotuzumab, a humanized monoclonal anti-epidermal growth factor receptor (EGFR) antibody, in patients with locally advanced or metastatic pancreatic cancer. Invest New Drugs. 2012 Jun;30(3):1138-43. doi: 10.1007/s10637-010-9619-8.
27. Macias A, Neninger E, Santiesteban E. Preliminary results of a phase II clinical trial of the anti EGFR monoclonal antibody Nimotuzumab in combination with whole brain radiation therapy in patients diagnosed with advanced non-small cell lung cancer tumors unresectable brain metastases. Eur J Cancer. 2008;Suppl:160-1.
28. National Cancer Institute. Common Terminology Criteria for Adverse Eventes (CTCAE) Version 4.0. Published: May 28, 2009. [citado 5 mayo 2014]. Disponible en: http://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03_2010-06-14_QuickReference_5x7.pdf
29. Fiorica F, Di Bona D, Schepis F. Preoperative chemoradiotherapy for oesophageal cancer: a systematic review and meta-analysis. Gut. 2004;53:925-30.
30. Ng T, Dipetrillo T, Purviance J, Safran H. Multimodality treatment of esophageal cancer: a review of the current status and future directions. Curr Oncol Rep. 2006;8:174-82.
31. Lorenzen S, Schuster T, Porschen R, Al-Batran SE, Hofheinz R, Thuss-Patience P, et al. Cetuximab plus cisplatin-5-fluorouracil versus cisplatin-5-fluorouracil alone in first-line metastatic squamous cell carcinoma of the esophagus: a randomized phase II study of the Arbeitsgemeinschaft Internistische Onkologie. Ann Oncol. 2009 Oct;20(10):1667-73.
32. Bedenne L, Michel P, Bouche O. Chemoradiation followed by surgery compared with chemoradiation alone in squamous cancer of the esophagus: FFCD 9102. J Clin Oncol. 2007;25:1160-8.
33. Stahl M, Stuschke M, Lehmann N. Chemoradiation with and without surgery in patients with locally advanced squamous cell carcinoma of the esophagus. J Clin Oncol. 2006;24:531.
34. Stahl M, Wilke H, Lehmann. Long-term results of a phase II study investigating chemoradiation with and without surgery in locally advanced squamous cell carcinoma (LA-SCC) of the esophagus. J Clin Oncol. 2008;26:4530.
35. Minsky BD, Pajak TF, Ginsberg RJ. INT 0123 (Radiation Therapy Oncology Group 94-05) phase III trial of combined-modality therapy for esophageal cancer: high-dose versus standard-dose radiation therapy. J Clin Oncol. 2002;20:1667-1174.
36. Munro AJ. Oesophageal cancer: a view over overviews. The Lancet. 2004;364(9434):566-8.
37. Ishikura S, Nikei K, Ohtsu A. Long-term toxicity after definitive chemoradiotherapy for squamous cell carcinoma of the thoracic esophagus. J Clin Oncol. 2003;21:2697-702.
38. Ishikura S, Nihei K, Ohtsu A, Boku N, Hironaka S, Mera K, et al. Long-Term Toxicity After Definitive Chemoradiotherapy for Squamous Cell Carcinoma of the Thoracic Esophagus. JCO. 2003 Jul 15 [citado 5 Mayo 2014];21(14):2697-2702. Disponible en: http://jco.ascopubs.org/content/21/14/2697.abstract
39. Wong RK, Malthaner RA, Zuraw L. Cancer care ontario practice guidelines initiative gastrointestinal c ancer disease site group: combined modality radiotherapy and chemotherapy in the non-surgical management of localized carcinoma of the esophagus: a practice guideline. Int J Radiat Oncol Biol Phys. 2003;55:930-42.
40. Cooper JS, Guo MD, Herskovic A, et al. Chemoradiotherapy of locally advanced esophageal cancer. Long-term follow-up of prospective randomized trial (Radiation Therapy Oncology Group 85-01). JAMA. 1999;281:1623-7.
41. Crombet T. Use of the humanized anti-epidermal growth factor receptor monoclonal antibody h-R3 in combination with radiotherapy in the treatment of locally advanced head and neck cancer patients. J Clin Oncol. 2004;22(9).
42. Solomon MT, Selva JC, Figueredo J. Radiotherapy plus the anti-EGFR mAb nimotuzumab or placebo for the treatment of high-grade glioma patients. J Clin Oncol 2012;30.
43. Macias A, Neninger E, Santiesteban E. Preliminary results of a phase II clinical trial of the anti EGFR monoclonal antibody Nimotuzumab in combination with whole brain radiation therapy in patients diagnosed with advanced non-small cell lung cancer tumors unresectable brain metastases. Eur J Cancer. 2008;Suppl:160-1.
44. Soriano JL, Ramos Suzarte M, Wilkison B, Viada CE, Garcia E, Jiménez G, et al. Tratamiento del cáncer de mama avanzado con el anticuerpo monoclonal hR3 en combinación con doxorrubicina y ciclofosfamida. EC Fase I. Ciudad de La Habana: CIM; 2003.
45. Crombet Ramos T, Figueredo J, Catala M, González S, Selva JC, Cruz TM, et al. Treatment of High-Grade Glioma Patients with the Humanized Anti-Epidermal Growth Factor Receptor (EGFR) Antibody h-R3 Report from a Phase I/II Trial. Cancer Biology & Therapy 2006 April; 5(4): 375-379.
46. Safran H, Suntharalingam M, Dipetrillo T, Ng T, Doyle LA, Krasna M, et al. Cetuximab with concurrent chemoradiation for esophagogastriccancer: assessment of toxicity. Int J Radiat Oncol Biol Phys. 2008;70:391-5.
47. Saltz L, Meropol NJ, Loehrer PJ. Phase II trial of cetuximab in patients with refractory colorectal cancer that expresses the epidermal growth factor receptor. J Clin Oncol. 2004;22:1201-8.
48. Cunningham D, Humblet Y, Siena S. Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer. N Engl J Med. 2004;351:337-45.
Recibido: 5 de mayo de 2014.
Aprobado: 3 de septiembre de 2014.
Lilia Saborido Martín. Centro Nacional Coordinador de Ensayos Clínicos (CENCEC). Calle 200 esq 21. Atabey. Playa. La Habana. Cuba. Teléfono 271 7345; 271 7397, ext. 107.